缝隙连接在同型半胱氨酸介导的自发性高血压大鼠血管平滑肌细胞增殖中的作用*
2012-08-30胡清华王恩帮司军强孙志萍李增春
钟 华,胡清华,王恩帮,司军强,孙志萍,李增春,何 芳△
(1.新疆地方病与民族高发病教育部重点实验室,2.石河子大学医学院病理生理教研室,3.生理教研室,4.医学机能实验中心,石河子832002;5.华中科技大学同济医学院病理生理学系,卫生部呼吸系统疾病重点实验室,湖北 武汉 430030)
血管平滑肌细胞(vascular smooth muscle cell,VSMCs)增殖、迁移和表型的变化导致的血管壁增厚和血管紧张度的增加是高血压发病的关键。由缝隙连接蛋白(connexin,Cx)构成的直接通讯-缝隙连接(gap junction,GJ)在调节血管舒缩、血管平滑肌细胞增殖、平滑肌的表型转变中起着重要作用,并与高血压发生密切相关[1]。我们及其他学者前期的研究发现同型半胱氨酸(homocysteine,Hcy)血浆水平升高使人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性减弱、一氧化氮(nitric oxide,NO)含量降低,并削弱了NO的血管舒张作用,增加氧化应激,刺激血管平滑肌细胞增生,改变血管壁弹性,增加血管阻力,因此促成血压升高[2,3],GJ是否参与了Hcy介导的高血压大鼠VSMCs增殖效应尚不清楚。因此本文以体外培养自发性高血压大鼠VSMCs为研究对象,初步探讨了缝隙连接在Hcy介导的SHR血管平滑肌细胞增殖中的作用及分子机制,为高血压的防治提供新靶标。
1 材料与方法
1.1 材料
1.1.1 动物 3~10周龄,150~200 g自发性高血压大鼠(购自北京维通利华实验动物有限责任公司,许可证编号SCXK京2007-0001),雌雄不限。
1.1.2 主要试剂 DMEM培养基(Gibco),胎牛血清/小牛血清(Hyclone),胰蛋白酶(Sigma),Hcy(Sigma),18α-GA(Sigma),抗 а-Actin 单克隆抗体(Dako),抗Cx40单克隆抗体(Invitrogen),抗Cx43单克隆抗体(Invitrogen),罗氏黄(Molecular probes),罗丹明-葡聚糖(Molecular probes),发光试剂盒(Pierce)
1.2 方法
1.2.1 VSMCs的培养和鉴定 取3~10周龄,150~200 g自发性高血压大鼠,雌雄不限,断头处死。无菌条件下取胸主动脉,以贴块法培养VSMC,细胞生长融合后,用0.25%的胰蛋白酶消化,以105~106cells/ml的密度传代培养,对细胞进行形态学观察并对细胞内平滑肌肌动蛋白α-Actin进行免疫细胞化学染色,95%以上的细胞呈阳性着色,证实细胞为VSMC。取3~5代细胞用于实验。
1.2.2 实验分组 将细胞以5×104cells/ml的密度培养24 h后吸去孔内液体,加入无血清培养基,24 h后再次吸去孔内液体,按以下分组加入试剂:(1)对照组:加含10%FBS的DMEM;(2)Hcy组:加含Hcy浓度为0.05 mmol/L的含10%FBS的DMEM;(3)缝隙连接阻断剂组:加含18α-GA 浓度为50 μ mol/ml的含10%FBS的DMEM;(4)Hcy+缝隙连接阻断剂组:加含Hcy和18α-GA的浓度分别为0.05 mmol/L和 50 μ mol/ml的含 10%FBS的 DMEM。
1.2.3 免疫荧光细胞化学检测Cx40、Cx43在细胞内表达及共定位 按实验分组制作细胞爬片,用PBS洗三遍,4%预冷的多聚甲醛固定20 min后用含0.2%Triton的PBS液洗三遍,0.2%Triton X-100室温透膜30 min,含0.2%Triton的PBS洗三遍,血清封闭30 min,含0.2%Triton的PBS洗三遍,加入一抗Cx40(1∶100)、Cx43(1∶50)4℃湿盒内过夜,含0.2%Triton的PBS洗三遍后,加入FITC标记二抗(1∶50);罗丹明TRITC标记二抗(1∶50),室温避光孵育2 h,含0.2%Triton的PBS冲洗3次,加核染料DAPI(1∶1 000)室温避光孵育15 min,含0.2%Triton的PBS洗三遍,60%缓冲甘油封片,激光共聚焦显微镜下观察。
1.2.4 MTT法检测VSMCs的增殖活性 制备细胞悬液,用含10%FBS的DMEM液稀释成5×104cells/ml,接种于 96孔板 ,每孔加入 200 μ l混匀后的细胞悬液,置于37℃,5%CO2恒温培养箱中孵育24 h。弃去培养液,用PBS液冲洗1~2遍。每孔加入不含FBS的DMEM 液 ,各200 μ l,继续培养24 h,使细胞同步于G0/G1期。弃去培养液,分别按实验分组加入试剂,每组8个复孔,置于培养箱培养 24 h后,各组弃去培养液,每孔加入MTT 20 μ l,孵育 4 h,加入DMSO 150 μ l,于酶标仪上检测各孔570 nm处吸光度(A值)。
1.2.5 流式细胞仪检测细胞周期 在六孔板内各组试剂作用24 h后吸净孔内培养基,PBS冲洗两次,离心后,弃上清液加PBS液吹打均匀,离心,重复2次弃上清液加PBS液吹打均匀,然后加入70%酒精4℃过夜,至少18 h,离心后,加PBS重悬离心同上,重复2次后,加碘化丙锭(propidium iodide,PI)染液0.5 ml,置于4℃,30 min后上流式细胞仪,重复4次,进行细胞周期测定,通过特殊软件计算S期的百分率,以S值反映细胞增殖能力。
1.2.6 Western blot法检测SHR VSMCs内Cx40、Cx43蛋白表达 在六孔板内各组试剂作用24 h后吸净孔内培养基,预冷PBS冲洗3次,加入细胞裂解液200 μ l,吹打 ,转入 1.5 ml EP 管中,保持 冰上 30 min后4℃离心,取上清用5×加样缓冲液稀释,煮沸6~8 min,BCA法测蛋白质浓度进行蛋白质定量,-20℃保存。所有实验均独立重复3次。以上蛋白样品(30 μ g)经10%聚丙烯凝胶电泳分离后,恒压25 V电转移50 min到硝酸纤维素滤膜(NC)上,然后封闭缓冲液(5%脱脂牛奶或牛血清白蛋白)中封闭1 h。将膜放入用5%封闭液稀释的第一抗体(Cx43稀释比例为1∶1 000;Cx40稀释比例为 1∶200)中,在室温下孵育,持续摇动 2 h。1×TBST(10 mmol/L Tris-HCl,pH 7.4,150 mmol/L氯化钠,0.05%Tween-20)洗膜,将膜用封闭缓冲液稀释的辣根过氧化物酶(HRP)标记的第二抗体(1∶2 000稀释),室温作用2 h,1×TBST洗膜,新鲜配制的ECL显色液1 ml(A、B液等体积混匀)和膜孵育1 min,封入保鲜膜中,压片,显影于感光胶片上。将经以上处理的NC膜用洗脱缓冲液(strip buffer)室温孵育1 h后,洗膜3次,每次15 min。用β-actin内参抗体(1∶1 000)室温孵育2h,以同样方法显影于感光胶片。用Bandleader 3.0软件对条带进行灰度扫描,按下述公式分别计算三次实验中样品蛋白的相对含量:蛋白相对含量(该蛋白条带的灰度值-背景的灰度值)/(对照条带的灰度值-背景的灰度值),以此比值计算均数与标准差。
1.2.7 染料示踪分子传递法(划痕标记染料传输法)检测血管平滑肌细胞间缝隙连接功能 在六孔板内各组试剂作用24 h后吸净孔内培养基,以37℃预温的PBS冲洗细胞3次,加荧光染料0.05%罗氏黄(Lucifer yellow,LY)和 0.05%罗丹明-葡聚糖1∶1混合液,每孔1 ml,用锐利的外科手术刀在细胞表面上划痕数条并计时,孵育3 min吸出荧光染料,PBS冲洗细胞3次,然后加入少量PBS以刚好覆盖细胞为宜,荧光显微镜下观察,罗氏黄荧光的显示用FITC系统的滤光片,罗丹明-葡聚糖用罗丹明系统滤光片,LY荧光染料传递百分数=LY荧光阳性细胞数(划痕细胞外)/划痕标记的细胞(即RD+LY阳性细胞数),重复实验3次,统计分析后,以此代表缝隙连接功能的强弱。其大小代表细胞间缝隙连接通讯功能强弱。
1.3 统计学处理
2 结果
2.1 免疫荧光技术检测SHR VSMCs中Cx43与Cx40蛋白的表达及两者的共定位
共聚焦荧光显微镜下观察,绿色荧光为Cx43的阳性着色,主要定位于胞浆,红色荧光为Cx40的阳性着色,主要定位于胞浆与胞膜,橙色荧光为两者的合成荧光,主要定位于胞浆,蓝色荧光显示为细胞核的DNA染料(DAPI)阳性着色,可见SHR VSMCs中Cx43与Cx40蛋白表达呈阳性,两者共定位于胞浆(图1)。
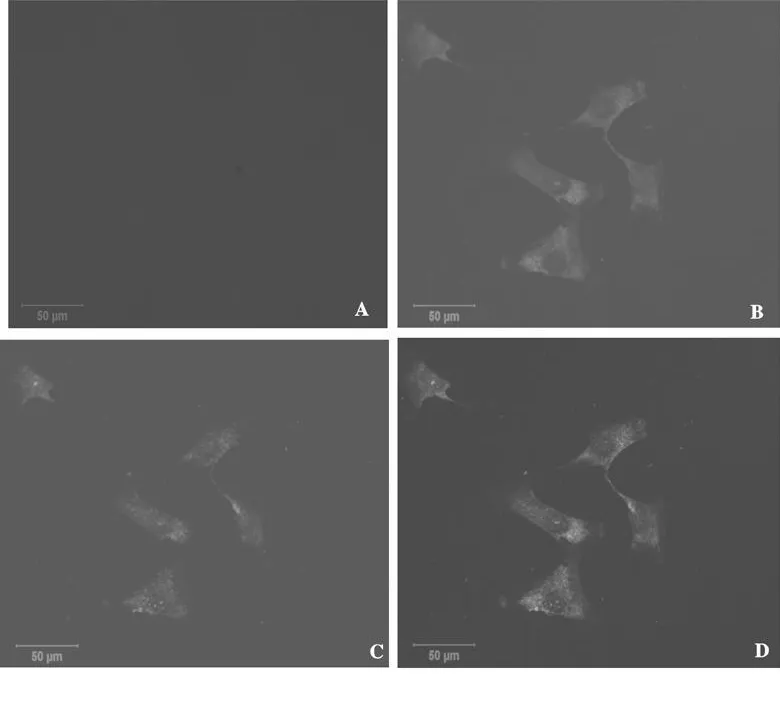
Fig.1 Expression and co-localization of the Cx43 and Cx40 proteins in the SHR VSMCs by confocal microscopy(FITC,TRITC,DAPI,confocal microscopy×40)
2.2 VSMCs的增殖
2.2.1 各实验组VSMCs的增殖活性 结果显示:与control组相比,Hcy组的A值增高(P<0.05),VSMCs增殖活性增加,缝隙连接阻断剂(18α-GA)组的A值降低(P<0.05),VSMCs增殖活性减少,Hcy+18α-GA组A值无明显差异(P>0.05);与Hcy组相比,Hcy+18α-GA组A值明显降低(P<0.05),VSMCs增殖活性减少(表1)。
Tab.1 A value of different groups in SHR VSMCs by MTT(±s,n=10)

Tab.1 A value of different groups in SHR VSMCs by MTT(±s,n=10)
Hcy:Homocysteine;GA:Glycyrrhetinic acid;SHR:Spontaneously hypertention rat;VSMC:Vascular smooth muscle cell*P<0.05 vs control;#P<0.05 vs Hcy group
Group A570 Control 0.34±0.04 Hcy 0.44±0.04*18α-GA 0.27±0.02*#Hcy+18α-GA 0.32±0.05#
2.2.2 流式细胞仪检测细胞周期 与control组相比,Hcy组S值增高(P<0.05),VSMCs增殖能力增加,18α-GA组S值降低(P<0.05),VSMCs增殖能力减弱,Hcy+18α-GA组 S值无显著性差异(P>0.05);与Hcy组相比,Hcy+18α-GA 组S值明显降低(P<0.05),VSMCs增殖能力减弱(图2,表2)。
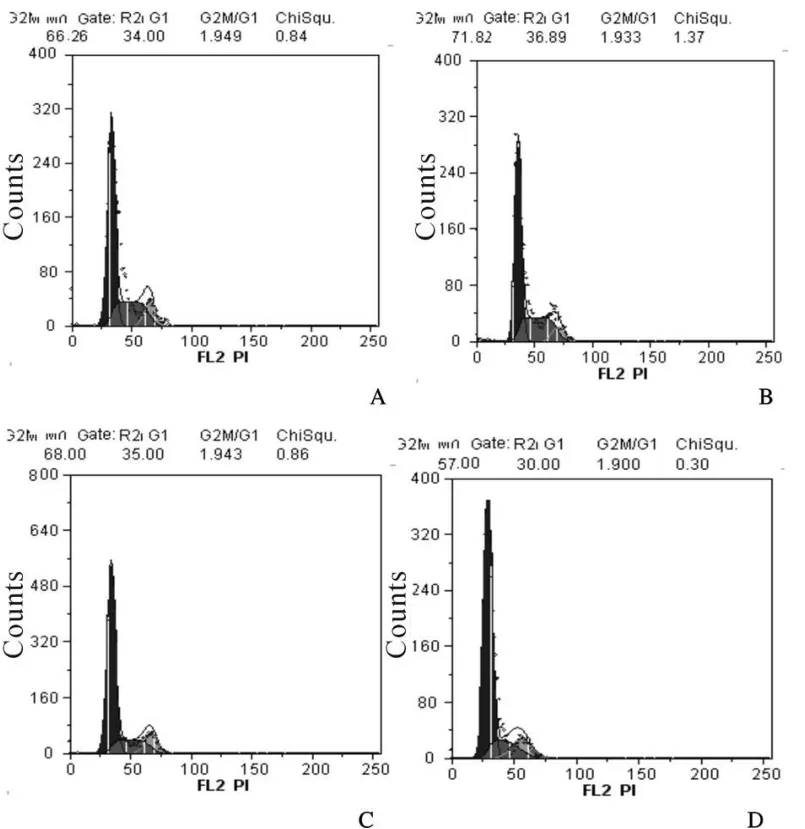
Fig.2 PI atlas of cell cycle in SHR VSMCs from different groups A:Control group;B:Hcy group;C:18α-GA group;D:Hcy+18α-GA group;PI:Propidium iodide
Tab.2 Percentage of speriod in cell cycle in SHR VSMCs of different groups(±s,n=4)

Tab.2 Percentage of speriod in cell cycle in SHR VSMCs of different groups(±s,n=4)
Hcy:Homocysteine;GA:Glycyrrhetinic acid;SHR:Spon taneously hypertensive rat;VSMC:Vascular smooth muscle cell*P<0.05 vs control;#P<0.05 vs Hcy
Group Percentage of speriod in cell cycle Control 23.36±1.89 Hcy 29.40±2.07*18α-GA 14.33 ±1.13*#Hcy+18α-GA 21.18 ±1.37#
2.2.3 Western blot法检测SHR VSMCs内Cx40、Cx43蛋白表达 与control组相比,Hcy组Cx43、Cx40蛋白表达均增强(P<0.05),18α-GA 组Cx43、Cx40表达均减弱(P<0.05),Hcy+18α-GA 组Cx43、Cx40表达均无显著性差异(P>0.05);与Hcy组相比,Hcy+18α-GA 组 Cx43、Cx43 表达减弱(P<0.05,图3,表 3)。
2.2.4 染料示踪分子传递法检测血管平滑肌细胞间缝隙连接功能 与control组相比较,Hcy组荧光染料传递分数增加,缝隙连接功能明显增强(P<0.05),18α-GA组荧光染料传递分数降低,缝隙连接功能明显减弱(P<0.05),Hcy+18α-GA组荧光染料传递分数无明显差异,缝隙连接功能无显著差异(P>0.05);与Hcy组相比,Hcy+18α-GA 组荧光染料传递分数降低,缝隙连接功能显著降低(P<0.05,图 4,表 4)。

Fig.3 Expression of the Cx43 and Cx40 proteins in SHR VSMCs of different groups
Tab.3 Expression of the Cx43 and Cx40 proteins in VSMC of different groups(±s,n=3)

Tab.3 Expression of the Cx43 and Cx40 proteins in VSMC of different groups(±s,n=3)
Hcy:Homocysteine;GA:Glycyrrhetinic acid;VSMC:Vascular smooth muscle cell;Cx:Connexin*P<0.05 vs control;#P<0.05 vs Hcy
Group Cx43/β-actin Cx40/β-actin Control 0.31±0.02 0.36±0.01 Hcy 0.62±0.14* 0.42±0.02*18α-GA 0.28±0.01*# 0.31±0.01*#Hcy+18α-GA0.32±0.01# 0.35±0.02#

Fig.4 Atlas of gap junctionfunction detected by scrape dye transfer method of scrape dye transfer method in VSMC of different groups(scale bar=100μ m)
3 讨论
近年来的研究表明高同型半胱氨酸血症能够导致血管内皮损害,促进低密度脂蛋白的氧化、血小板的聚集、血管平滑肌细胞增殖,对正常大鼠VSMCs的作用由于细胞密度,Hcy浓度的不同而不同。研究发现一定剂量的Hcy能诱导SHR VSMCs增殖[5,6],在我们前期的研究中显示:随着Hcy浓度的升高,SHR VSMCs增殖增加明显,当Hcy浓度 >0.1 mmol/L时,细胞增殖增加开始降低。
Tab.4 Percentage of immune fluorescent dye transfered in SHR VSMCs of different groups(±s,n=3)
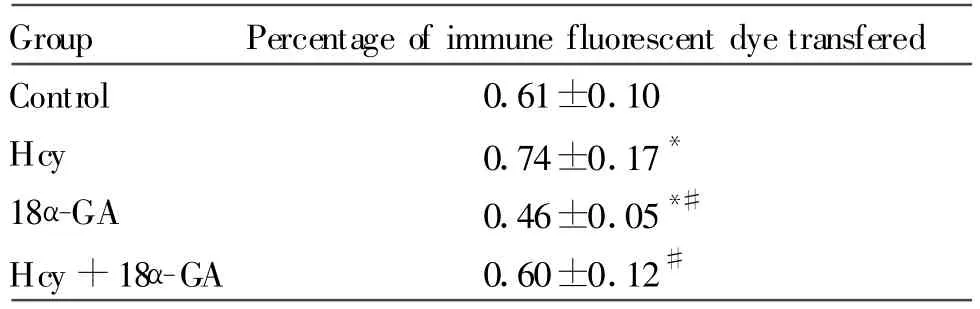
Tab.4 Percentage of immune fluorescent dye transfered in SHR VSMCs of different groups(±s,n=3)
Hcy:Homocysteine;GA:Glycyrrhetinic acid;SHR:Spontaneously hypertension rat;VSMC:Vascular smooth muscle cell*P<0.05 vs control;#P<0.05 vs Hcy
Group Percentage of immune fluorescent dye transfered Control 0.61±0.10 Hcy 0.74±0.17*18α-GA 0.46 ±0.05*#Hcy+18α-GA 0.60 ±0.12#
缝隙连接是由连接相邻两个细胞之间的连接通道排列而成的一种特殊膜结构。它由细胞膜上的连接子相互衔接而成,每个连接子由六个缝隙连接蛋白(Cx)围成,连接子即Cx的六聚体所形成的跨膜蛋白通道[7]。不同类型的连接蛋白可以形成不同类型的连接子,构成不同类型的连接通道,不同连接蛋白分子之间组合形成的缝隙连接通道的通透性和导电性有所不同[8],从而使得缝隙连接在结构组成和功能上表现出多样性[9],并对血管平滑肌舒缩等生理过程起着重要的调控作用。而血管平滑肌细胞以Cx43,Cx40表达为主。
我们通过用Hcy和缝隙连接阻断剂(18α-GA)处理SHR VSMCs,通过MTT法和流式细胞技术检测SHR VSMCs A值和S值发现:Hcy进一步促进了细胞的增殖,当缝隙连接阻断后,完全阻断了Hcy对细胞的促增殖效应。本研究结果首次证实,缝隙连接可能参与了Hcy介导的SHRVSMCs的增殖作用。
为了进一步探讨Hcy是否通过改变连接蛋白的表达,调节缝隙连接通道的功能,影响细胞间直接通讯,并导致血管平滑肌细胞增殖?在本研究中我们用激光共聚焦显微镜观察Cx43、Cx40蛋白表达及定位,结果显示两者共定位于胞浆,并通过Western blot各组Cx43、Cx40的蛋白表达,结合划痕标记染料传输法检测了不同处理因素作用下各组缝隙连接功能的变化,结果发现:Hcy可使SHR VSMCs Cx43和Cx40蛋白表达上调,增强了缝隙连接通讯功能。缝隙连接阻断剂抑制了Hcy引发的Cx43和Cx40蛋白表达上调,并降低了缝隙连接功能。
在以往的研究中已证实Hcy都能通过细胞间间接通讯的方式引起高血压,动脉粥样硬化等心血管疾病的发生和发展。本研究以SHR血管平滑肌细胞为模型,发现Hcy通过上调SHR血管平滑肌细胞缝隙连接蛋白Cx43和/或Cx40的表达,引起细胞间直接通讯-缝隙连接通讯功能的增强,促进了SHR血管平滑肌细胞的增殖作用。进一步阐明了Hcy在高血压等血管平滑肌细胞增殖相关疾病中的作用机制,并提供了新的理论基础。
此外,缝隙连接功能的调节受多种因素的影响,如缝隙连接蛋白的表达,缝隙连接蛋白的磷酸化等,在本研究中我们仅从缝隙连接蛋白的表达做了初步研究,那么在不同处理因素作用下,缝隙连接蛋白的磷酸化有何变化?另外在本研究发现缝隙连接蛋白Cx43、Cx40参与了Hcy介导SHR血管平滑肌细胞增殖作用,在今后的研究中,我们将通过干扰Cx43、Cx40基因,进一步探讨缝隙连接在Hcy介导SHR血管平滑肌细胞增殖作用及机制,为心脑血管疾病防治提供新靶标。
[1]Azzam E I,de Toledo S M,Little J B.Evidence for the participation of gap junction-mediated intercellular communication in the transmission of damage singals from alpha-particle irradiated to nonirradiated cells[J].ProcNatlAcad Sci USA,2001,98(2):473-478.
[2]张会敏,张海洋,邓峰美,等.同型半胱氨酸对钙离子激活状态下内皮细胞eNOS活性及NO含量的影响[J].石河子大学学报,2007,25(2):196-199.
[3]Rodrigo R,Passalacqua W,Araya J,et al.Homocysteine and essential hypertension[J].J Clin Pharmacol,2003,43(12):1299-1306.
[4]钟 华,何 芳,胡清华,等.ERK和Smad通路在TGF-β1抑制大鼠血管平滑肌细胞增殖中的作用[J].中国病理生理杂志,2009,25(9):1665-1670.
[5]Lee H Y,Chae I H,Kim H S,et al.Differential effects of homocysteine on porcine endothelial and vascular smooth muscle cells[J].J Cardiovasc Pharmacol,2002,39(5):643-651.
[6]Woo D K,Dudrick S J,Sumpio B E,et al.Homocysteine stimulatesMAP kinase in bovine aortic smooth muscle cells[J].Surgery,2000,128(1):59-66.
[7] Söhl G,Willecke K.Gap junctions and the connexin protein family[J].Cardiovasc Res,2004,62(2):228-232.
[8]Huang X D,Sandushy G E,Zipes D P,et al.Heterogeneous loss of Cx43 protein in ischemic dog heats[J].J Cardiovasc Eletrophysiol,1999,10(1):79-91.
[9]Figueroa X F,Duling B R.Gap junctions in the control of vascular function[J].Antioxid Redox Signal,2009,11(2):251-266.
