Tau/APP/PS1三转基因小鼠模型的建立及生物学特征*
2012-08-30王利利朱小南陈汝筑汪雪兰
王利利,纳 鑫,朱小南,陈汝筑,汪 海,汪雪兰△
(1.中山大学医学院药理学教研室,广州 510080;2.军事医学科学院卫生学环境医学研究所,天津 300050)
阿尔茨海默病(Alzheimer's disease,AD)是中枢神经系统退行性疾病,其典型的病理改变为神经纤维缠结(neurofibrillary tangle,NFT)和老年斑(senile plaque,SP),分别由Tau蛋白异常磷酸化和淀粉样蛋白(β-amyloid protein,Aβ)沉积引起。Tau和Aβ在AD发病机制中的作用和相互关系,以及产生的前后顺序等尚未有定论[1]。
AD动物模型是研究AD发病机制和研发治疗药物的必要工具。与AD相关的Tau、淀粉样前体蛋白(amyloid precusor protein,APP)、早老素(presenilins,PS)等基因的单转基因模型通常只能模拟AD其中一种病理变化。鉴于AD发病为多因素共同致病,所以利用不同的转基因鼠杂交或多个基因同时转入等方法,得到的多重(双转或三转)转基因模型能更好的模拟临床AD的发病过程和病理特征[2]。
本课题是将自行建立的Tau转基因小鼠[3]与美国Jackson实验室引种的APP/PS1双转基因小鼠[4]杂交,筛选获得Tau/APP/PS1三转基因小鼠,旨在建立具有Tau和Aβ两种病理改变和学习记忆障碍的动物模型,为深入探究Tau与Aβ的关系、阐明AD的发病机制以及研发靶点治疗药物提供实验工具。
1 材料与方法
1.1 动物
Tau转基因小鼠由本实验室自行建立的,APP/PS1二转基因小鼠购自南京大学模式动物研究所,是从 美国Jackson实验室引种,品系名称 B6C3-Tg[APPswe,PSEN1dE9]m 85Dbo/J。
1.2 药品与试剂
抗人Tau蛋白的单克隆抗体(Tau-13)购自Santa Cruz公司;抗人Aβ蛋白的单克隆抗体购自CST公司;PVDF膜、二抗及ECL发光试剂盒均购自Amersham公司;ABC染色剂和DAB显色剂购自Vector公司。
1.3 基因型鉴定
1.3.1 基因组DNA的提取 取鼠尾0.5~1 cm放入0.5 ml裂解缓冲液中(1%SDS、75 mmol/L NaCl,10 mmol/L Tris-Cl、25 mmol/L EDTA),加 20 g/L 蛋白酶K 2.5 μ l,置55℃振动恒温摇床200 r/min消化过夜。酚/氯仿法提取和纯化基因组DNA。
1.3.2 PCR Tau引物序列为5'-GGAGTTCGAAGTGATGGAAG-3'和5'-GGTTTTTGCTGGAATCCTGG-3',APP和PS1引物是根据Jackson实验室网站公布的序列。PCR反应为 94℃5 min;94℃45 s、56℃45 s和72℃45 s,共35个循环,72℃10min,2%琼脂糖凝胶电泳后,用GENE GENIUS凝胶成像系统分析。
1.4 Morris水迷宫观测学习记忆的改变
1.4.1 定位航行实验 实验5 d,每天训练4次,每次间隔15 min。训练时随机选择一个象限为入水点,采用远离目标的象限入水成绩作为评价指标[4],实验时间90 s,将小鼠找到水下平台的时间计为逃逸潜伏期。
1.4.2 空间搜索试验 在最后一次训练后撤除水下平台,然后在平台所在象限的对面象限的中点为入水点将小鼠面向池壁放入水中,测定它在90 s内跨过水下平台位置的次数。记录上述参数和游泳路线轨迹。
1.5 RT-PCR检测Tau、APP、PS1基因的转录
1.5.1 总RNA的提取、鉴定和含量测定 取大脑提取RNA,琼脂糖凝胶电泳鉴定RNA的完整性,紫外分光光度计测定总RNA含量。
1.5.2 RT-PCR 反应体系包括 RNA 1 μ g,5×RT buffer 4.0 μ l,Olig(dT)20(20 μ mol/L)1.0 μ l,dNTP(10 mmol/L)2.0 μ l,RTase 1.0 μ l,DEPC water 至总体积为20 μ l。42℃孵育 60 min,95 ℃5 min,冰浴 5 min,PCR方法同前。
1.6 Western blot测定Tau和APP蛋白的表达量
1.6.1 蛋白的提取 取小鼠大脑,分离皮层和海马区50~100 mg于离心管中,加裂解缓冲液(50 mmol/L Tris-HCL 10 ml,10%SDS 100 μ l,NP-40 100 μ l,2%NaN3 100 μ l,100 mmol/L PMSF 100 μ l,200 mmol/L NaVO450 μ l,EGTA 38.036 mg,蛋白酶抑制剂半片),12 000 r/min超声破碎30 min,取上清,100℃煮沸5 min备用。
1.6.2 聚丙烯酰胺凝胶电泳 配制8%的分离胶和4%的积层胶,取样本35 μ g上样于加样孔中,200 V恒压下电泳45 min。100 V转膜60 min,孵育目的抗体,曝光,拍照,计算机图像分析。
1.7 Bielschowsky染色法观察神经纤维缠结
将脑组织切片浸在4%硝酸银中30 min;10%甲醛数秒,滴加氨银乙醇溶液20~40 s,10%甲醛1~2 min,5%硫代硫酸钠固定;梯度酒精脱水,中性树胶封片。
1.8 ABC免疫组化法观察老年斑
按试剂盒步骤操作。
2 结果
2.1 基因型鉴定
内参β-actin1是 700 bp,β-actin2是 300 bp;Tau 是500 bp,APP是350 bp,PS1是608 bp。PCR结果显示,1号是Tau小鼠,2号和3号为Tau/APP/PS1小鼠(图1)。

Fig.1 Agarose gel electrophoresis of PCR products
2.2 大脑Tau、APP、PS1基因的转录
Tau为500 bp,APP为350 bp,PS1为608 bp。RTPCR结果显示,1号是Wt小鼠,2号是Tau小鼠;3号是APP/PS1小鼠;4号是Tau/APP/PS1小鼠(图2)。
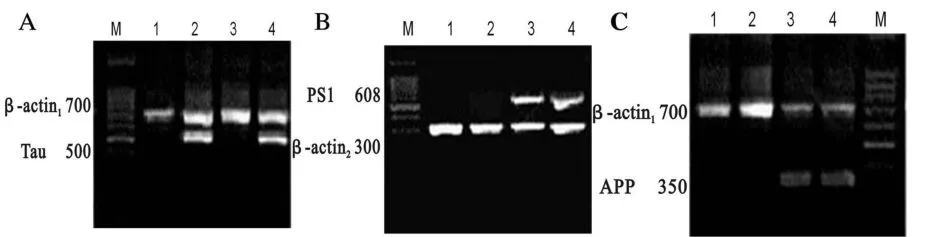
Fig.2 Detection gene transcription in the brains of mice
2.3 海马和皮层的Tau和Aβ蛋白表达量
取8月龄小鼠,Western blot结果显示:4是Tau/APP/PS1小鼠的海马及皮层,均有Tau和Aβ蛋白;3是APP/PS1小鼠的海马及皮层,只有Aβ蛋白,2是Tau小鼠的海马及皮层,只有Tau蛋白(图3)。Tau蛋白量在Tau/APP/PS1和Tau小鼠的海马和皮层无差异;Aβ蛋白量在Tau/APP/PS1小鼠的海马高于APP/PS1小鼠29.6%,在皮层无差异(表1)。Tau/APP/PS1小鼠海马Tau蛋白量高于皮层22.1%,皮层Aβ蛋白量高于海马48.6%(表2)。

Fig.3 Expression of Tau and Aβ protein in 8-month transgenic mice(n=5)
Tab.1 Comparison of Tau and A β protein content in 8-month transgenic mice(±s,n=5)

Tab.1 Comparison of Tau and A β protein content in 8-month transgenic mice(±s,n=5)
*P<0.05 vs APP/PS1
Protein type Mouse type Hippocampus Cortex Tau Tau 1.000±0.031 1.000±0.027 Tau/APP/PS1 1.053±0.125 1.029±0.314 Aβ APP/PS1 1.000±0.028 1.000±0.041 Tau/APP/PS1 1.296±0.264*0.865±0.276
Tab.2 Comparison of Tau and A β protein content in Tau/APP/PS1 transgenic mice(±s,n=5)

Tab.2 Comparison of Tau and A β protein content in Tau/APP/PS1 transgenic mice(±s,n=5)
*P<0.05 vs Tau/APP/PS1
Protein type Hippocampus Cortex Tau 1.221±0.236 1.000±0.147*Aβ 0.673±0.235 1.000±0.179*
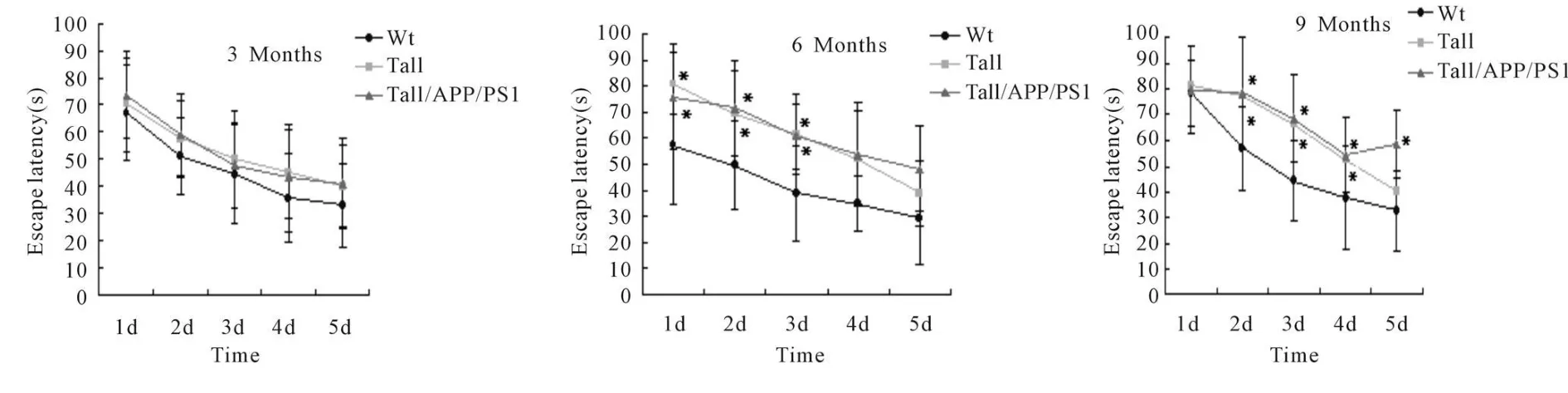
Fig.8 Escape latency in Tau/APP/PS1 triple transgenic mice of different months(±s,n=10)
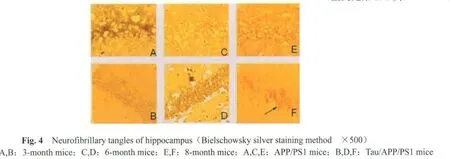
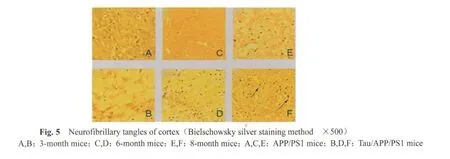
2.4 海马和皮层的神经纤维缠结
取3、6和8月龄小鼠,F是8月龄Tau/APP/PS1小鼠的海马和皮层 Bielschowsky染色可见火焰状或球形的神经纤维缠结;E是8月龄的APP/PS1小鼠的海马和皮层,未见此改变。箭头所示为神经纤维缠结(图 4,5见彩图页Ⅰ)。
2.5 海马和皮层的老年斑
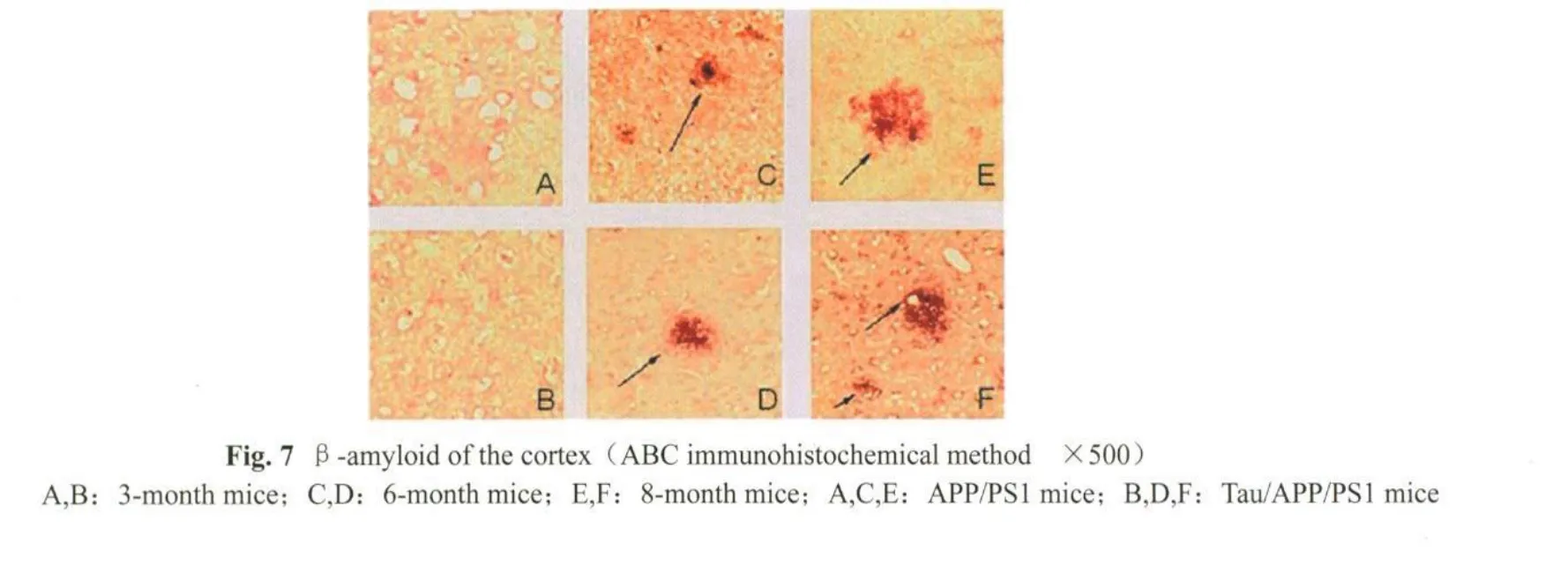
取3、6和8月龄小鼠,C是 6月龄APP/PS1小鼠的海马和皮层,ABC免疫组化可见少量老年斑;右D是6月龄Tau/APP/PS1小鼠皮层可见老年斑,而海马没有;E和F分别是8月龄的APP/PS1、Tau/APP/PS1小鼠的海马和皮层,均可见老年斑。箭头所示为老年斑(图6,7见彩图页Ⅰ)

2.6 学习记忆的改变
取3、6和9月龄小鼠,Morris水迷宫实验显示:6月龄Tau/APP/PS1小鼠逃逸潜伏期在第1、2、3天时分别为73.49±15.94(s)、59.16±14.96(s)、47.92±15.76(s),9月龄时在第2、3、4、5天时逃逸潜伏期分别为78.45±21.33、68.43±14.58、54.35±14.58、58.43±13.26,与Wt小鼠相比延长(图 8,P<0.05)。
6月龄Tau/APP/PS1小鼠穿越平台次数为2.00±0.54,9月龄Tau/APP/PS1小鼠穿越平台次数为2.40±0.72,与Wt小鼠相比穿越平台次数减少(图9)。
3 讨论
AD的转基因动物模型包括单转和多重(双转或三转)转基因模型,多重转基因模型比单转模型的模拟AD病理变化和行为学改变特征的程度更高,逐渐成为研究AD的主流动物模型。多重转基因小鼠的建立方法有多种,主要通过杂交繁育、显微共注射或同时运用两种方法。AD最常见的双转基因模型是APP/PS1小鼠,大多是转入APPswe基因,但转入PS基因片段会有多种选择,此类模型通常在6月龄发现Aβ蛋白沉积,9月龄出现学习记忆障碍[5]。APP/Tau双转基因小鼠是首个能同时出现NFT和SP,模拟AD病理特征较为全面的转基因小鼠模型。由Tg2576小鼠和tau P301L(JNPL3)小鼠杂交而来,名为TAPP鼠[6],但常表现为体重减轻、后肢萎缩、弯腰驼背、发音和睁眼困难,其行为学改变因其身体状况差而较难确定。APP/PS1/Tau三转基因小鼠是先由单转PS1M146V小鼠自交得到纯合子,再分别将突变基因APPSwe和tauP301L显微注射入纯合子的胚胎干细胞,筛选而得[7];在6月龄出现认知障碍和Aβ沉积;Aβ沉积出现在NFT之前,首先沉积在皮质,然后在海马。12月龄出现NFT,是先海马后皮质。
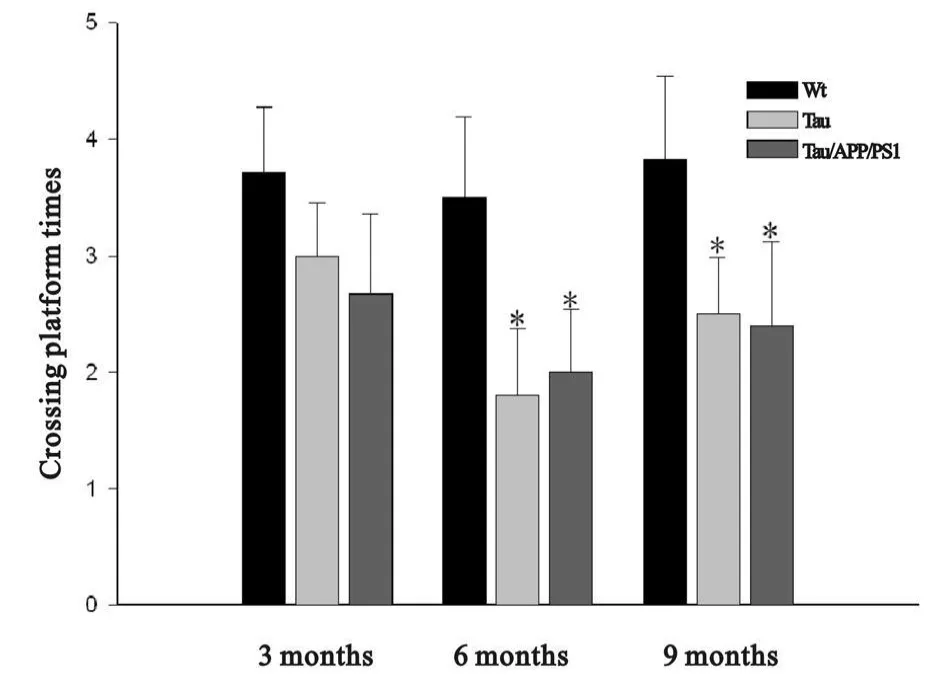
Fig.9 Platform probe frequency in transgenic mice of different months(±s,n=10)
Jankowsky等[4]将由小鼠的朊蛋白启动子(Prp)启动的突变APP和PS1基因显微共注射到小鼠受精卵中,构建了APP/SP1双转基因小鼠模型,APP和PS1基因是整合在染色体的同一或相临位置,即APP和PS1是连锁的。6月龄APP/SP1小鼠脑内可见老年斑,并有行为学改变。本实验室将带有小鼠特异性的神经元启动子Thy-1和含有P301L突变的人最长Tau蛋白的异构体,用雄原核显微注射法,建立了Tau转基因小鼠模型[3],能稳定传代,9月龄可见神经元纤维缠结和有空间记忆力损害,12月龄有神经元丢失。
本课题是将以上的Tau转基因小鼠与APP/SP1转基因小鼠杂交,建立Tau/APP/PS1三转基因小鼠模型。实验结果显示,Tau/APP/PS1小鼠大脑可转录和表达Tau、APP和PS1三种外源基因;8月龄Tau/APP/PS1小鼠海马Aβ蛋白高于APP/PS1小鼠29.6%,海马Tau蛋白高于皮层22.1%,皮层Aβ蛋白比海马高48.6%;8月龄海马与皮层可观察到大量的NFTs;6月龄皮层可见老年斑,比相同月龄的APP/PS1小鼠多;6月龄开始记忆保持能力受损。提示,Tau/APP/PS1三转基因小鼠中Tau基因的表达能促进Aβ含量的增加;NFT先出现在海马,SP则在皮层出现较早;Aβ沉积首先在皮层,而后到海马。
本研究建立的Tau/APP/PS1三转基因小鼠模型与Wengenack等人[5]建立的APP/PS1双转基因小鼠相比,增加了Tau病变;与Lewis等人[6]建立的APP/Tau双转基因小鼠相比,没有大脑外的身体改变;与Oddo等人[7]建立的APP/PS1/Tau三转基因小鼠有相似之处。此模型尚需传代建系和深入研究其他生物学特征,并需要用染色体荧光原位杂交确定外源基因的插入位点。
AD的动物转基因和非转基因模型有多种,每一种模型都在一定的程度上或某些方面模拟AD的病理改变或症状,每种建立转基因模型的方法各自具有相应的适用范围和作用,又各有优势与不足,但仍然没有一种模型可以完全模拟完整的AD特征[8]。
目前国内AD研究所用的Tau/APP/PS1三重转基因小鼠全部依赖国外进口,存在成本昂贵和外源基因易丢失等问题。本研究所建立的Tau/APP/PS1三转基因小鼠模型具有Tau和Aβ两种病理改变和学习记忆障碍,为深入探究Tau与Aβ的关系、阐明AD的发病机制以及研发靶点治疗药物提供实验工具。
[1]LaFerla F M.Pathways linking Abeta and tau pathologies[J].Biochem Soc Trans,2010,38(4):993-995.
[2]Schaeffer E L,Figueiro M,Gattaz W F.Insights into Alzheimer disease pathogenesis from studies in transgenic animal models[J].Clinics,2011,66(S1):45-54.
[3]王艳艳,陈汝筑,朱小南,等.含P301L突变的Tau转基因小鼠纯合子品系的建立及鉴定[J].中国应用生理学杂志,2012,28(3):242-245.
[4]Jankowsky J L,Slunt H H,Ratovitski T,et al.Co-expression of multiple transgenes in mouse CNS:a comparison of strategies[J].Biomol Eng,2001,17(6):157-165.
[5]Wengenack T M,WhelanS,Curran G L,et al.Quantitative histological analysis of amyloid deposition in Alzheimer's double transgenic mouse brain[J].Neurosci,2000,101(4):939-944.
[6]Lewis J,Dickson D W,LinW L,et al.Enhanced neurofibrillary degeneration in transgenic mice expressing mutant tau and APP[J].Sci,2001,293(5534):1487-1491.
[7]Oddo S,Caccamo A,Kitazawa M,et al.Amyloid deposition precedes tangle formation in a triple transgenic model of Alzheimer's disease[J].Neurobiol Aging,2003,24(8):1063-1070.
[8]Braidy N,Muñoz P,Palacios A Get al.Recent rodent models for Alzheimer's disease:clinical implications and basic research[J].J Neural Transm,2012,119(2):173-195.
