高压氧暴露大鼠肺组织内PPAR通路分子变化规律*
2012-08-30包晓辰方以群
攸 璞,姚 健,包晓辰,马 骏,张 师,方以群
(海军医学研究所,上海 200433)
氧中毒是指由于呼吸了高氧分压气体后而产生的一种有害反应。肺脏即为其中的主要靶器官之一[1]。在潜水作业、隧道施工等高气压作业环境下,作业人员会遇到长时间暴露于高分压氧的情况,从而有引起氧中毒的风险。而肺型氧中毒常常表现为胸骨后不适伴轻度干咳,并缓慢加重;然后出现胸骨后疼痛,且疼痛逐渐沿支气管树向整个胸部蔓延,吸气时为甚;疼痛逐渐加剧,出现不可控制的咳嗽;最终休息时也会伴有呼吸困难[2]。因此,一旦发生氧中毒不仅大大降低作业效率,也有可能危及作业人员的生命安全。
过氧化物酶增殖体激活受体(peroxisome proliferator-activated receptor,PPAR)是核激素受体超家族的成员,是最早于降血脂药物氯贝丁酯服用后肝脏实质细胞内发现的,具备介导过氧化物酶体增殖作用的分子[3]。对其进一步的研究表明,该家族分子参与了多个生物过程的基因表达调控,包括脂代谢和胰岛素敏感性。在PPAR相关的治疗炎症反应的尝试中,有大量实验使用了PPAR配体(常见的有PGZ,TGZ,PGJ2和RGZ等)用来治疗脑、肺脏、胃肠道和肾脏等组织器官的缺血/再灌注损伤模型中,这些配体主要表现为一种抗炎症和抑增殖作用,尤其是PPAR-γ的配体可以抑制原炎症基因的表达,比如TNF-α,IL-1β,MMP-9,ICAM-1和iNOS等,从而达到减弱甚至预防各器官的缺血/再灌注损伤的目的[4]。既然PPAR通路在炎症过程中发挥着重要的调控作用,因此本实验旨在研究常见PPAR通路中的各分子在肺型氧中毒模型中的表达变化规律,为进一步治疗肺型氧中毒提供新的靶标。
1 材料与方法
1.1 仪器与材料
成年雄性SD大鼠(上海市中国科学院动物中心,体重260~280 g),动物高压氧舱(上海 7 0 1研究所杨园医用氧舱厂),医用氧气(上海市江南气体公司),钠石灰(上海五四化工厂)。
1.2 动物分组
12只SD大鼠随机分为4组(n=3):(1)高压常氧组;(2)高压氧2 h组;(3)高压氧4 h组;(4)高压氧6 h组。以上每组动物用于芯片检测。15只SD大鼠随机分为5组(n=3):(1)高压常氧组;(2)高压氧2 h组;(3)高压氧4h组,(4)高压氧6 h组;(5)高压氧8 h组。高压氧暴露方案为0.23 MPa,持续2 h、4 h、6 h、8 h。以上每组动物用于病理分析与 RTPCR检测。
1.3 肺型氧中毒模型的制备
动物进舱前舱内预先放置钠石灰(2 kg),动物进舱后,纯氧洗舱 5 min,使舱内O2浓度>99%,以0.1 MPa/min的速率加压至0.23 MPa,持续微量通风,维持舱内O2浓度>99%。暴露相应时间后,动物减压出舱,进行指标测定。
1.4 肺组织病理学检查
动物处死后,取左肺下叶,用10%福尔马林固定,石蜡包埋,切片,HE染色。染色后用显微镜观察拍照其病理改变。
1.5 大鼠oligo芯片检测氧中毒时间序列表达谱
从高压常氧组、高压氧暴露2 h、4 h和6 h组各3只大鼠分离得到的左肺下叶,用Trizol试剂提取总RNA,经DNA酶处理去除基因组后送公司检测(大鼠40 k全基因组芯片)。
1.6 RT-PCR检测
从高压常氧组、高压氧暴露2 h、4 h、6 h和8 h组各3只大鼠分离得到的左肺下叶,用Trizol试剂提取总RNA,经DNA酶处理去除基因组后经MMLV逆转录合成获得第一链cDNA,再经PPAR-α,PPAR-δ和PPAR-γ特异引物检测。
2 结果
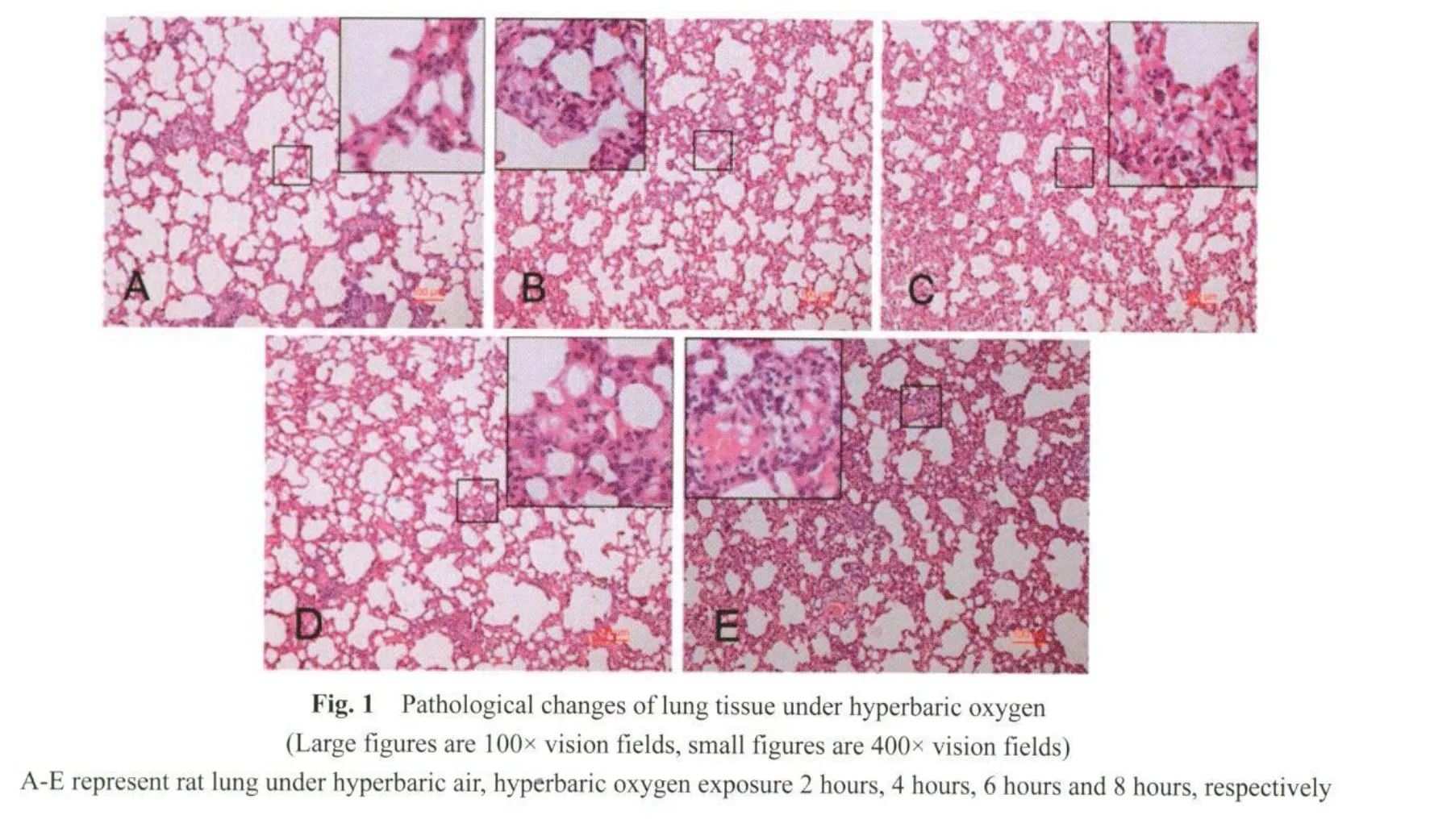
2.1 肺脏病理改变随呼吸高压氧时间延长而逐渐加重
在高压氧暴露2 h后即可见到少量炎细胞浸润(图1B)。4 h后病理改变明显,可见大量炎细胞浸润,并且肺泡间隔增厚明显(图1BC)。有趣的是,呼吸6 h后肺脏病理改变略有减轻(图1D),考虑为机体的一种适应反应,但继续延长高压氧作用时间后肺脏病理改变剧烈,可见大量炎细胞浸润伴有红细胞渗漏,并有明显渗出液(图1E)。从而,病理结果提示,随着呼吸高压氧的时间延长,肺脏损伤逐渐加重,以炎细胞浸润、肺泡间隔增厚甚至有大量渗出液为主要表现(图1见彩图页Ⅱ)。
2.2 肺型氧中毒肺组织表达谱分析
为了研究氧中毒过程中肺组织中病理改变的分子基础,我们采取了大鼠的全基因组表达芯片检测了高压氧处理后2 h、4 h、6 h以及高压常氧肺组织的表达谱。经过归一化与过滤处理后可得到488条差异表达基因,进一步经过SOM聚类法可得4种不同表达模式的基因类(图2),其中第四类的基因在高压氧处理出现逐渐升高的表达模式,与病理改变相符,提示这类基因中含有氧中毒损伤调控关键基因。于是,对该类基因进一步采用了基因本体论(Gene ontology,Go)富集分析,在被富集的功能类中可见PPAR通路中的6条基因均出现在第4类,这些基因包括Ucp1,Pck1,Apoa1,Apoa2,Acdc和Fabp7,经过KEGG查询后可知这些基因均为PPAR通路的下游靶基因,也就是说很可能在氧中毒的过程中PPAR通路得到了激活。
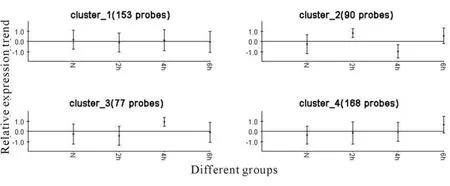
Fig.2 488 differential expression genes were clustered by SOM method
2.3 PPAR信号通路中配体分子的RT-PCR检测
前面的结果提示PPAR通路可能在氧中毒模型的肺组织中激活,为了研究该通路中的上游分子PPAR各基因是否被激活,我们通过RT-PCR检测了PPAR家族成员PPAR-α,PPAR-δ和PPAR-γ的表达情况,如图3所示,随着氧中毒肺组织损伤程度的加重,PPAR-δ和PPAR-γ均发生了上调,而PPAR-α未能检测到表达,因此我们的结果提示PPAR通路的激活可能是通过PPAR-δ和PPAR-γ的上调来介导的。
3 讨论
肺型氧中毒在病理学上表现为肺部出现充血、出血、渗出和炎细胞浸润等炎症表现。本研究结果提示,动物经过高压氧处理后,肺脏呈现逐渐加重的表现,进一步验证了高压氧暴露造成的肺损伤是一种炎症反应,而且这种炎症反应随着暴露时间的延长而逐渐加重。
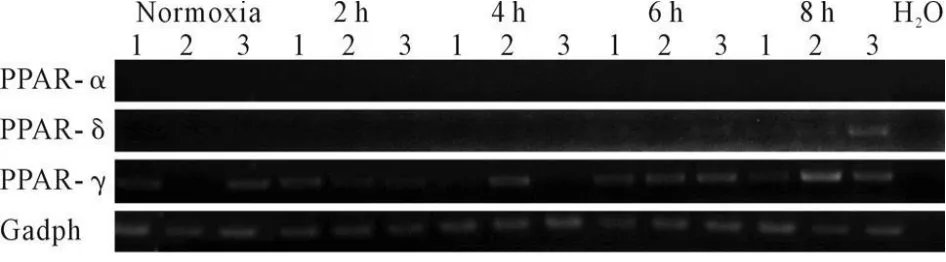
Fig.3 Detecting expression of PPAR member genes by RT-PCR 1-3 represent repeat of lung tissues in different groups
目前已知的PPAR同种型基因一共有三个,即PPAR-α、PPAR-δ和 PPAR-γ[5]。PPAR 通路在正常状态下,PPAR与视黄醇类X受体以异二聚体形式存在,并且受到一些协同抑制分子的作用而抑制了其活性。只有在PPAR配体出现的时候,使得以上协同抑制分子解离,紧接着在协同激活分子参与的情况下结合到特异的PPAR反应元件上从而转录目标基因。已经证实的PPAR参与生物过程有:脂肪细胞的分化、糖脂代谢和白细胞(如单核/巨嗜细胞、淋巴细胞和树突状细胞等)免疫反应等[6]。特别的,在炎症反应过程中,PPAR扮演着重要的抗炎角色,大量研究显示该类分子有抑制促炎因子释放的作用,这些促炎因子包括细胞因子(如白介素1和6、肿瘤坏死因子α等),一氧化氮和机制金属蛋白酶等的释放[4,7]。而其中的机制,可能是部分通过抑制NF-κ B、AP和Stat1来实现的。目前有多个研究显示PPAR通路在多种组织的缺血/再灌注损伤中有保护作用,而且已经有部分PPAR配体类似物用于临床预防或治疗器官的缺血再灌注损伤[8]。但是,一直未见有该通路在氧中毒中的研究。本研究以肺型氧中毒为模型,研究了PPAR通路分子在氧中毒发生过程中的表达情况。
由于氧中毒是一个高压氧的持续积累损伤作用,因此本实验采用了不同时间点检测肺组织损伤变化和表达谱变化。本实验的病理结果也说明随着暴露时间的延长,肺部损伤逐渐加重,有趣的是在6 h时间点上病理损伤略有缓解,考虑是一种机体的适应性反应,而且在暴露了8 h后肺损伤程度最为严重,提示了机体的失代偿表现。而对其表达谱分析显示,在与损伤程度相关的类中,含有PPAR通路中的多个下游靶基因发生了上调,提示了PPAR通路的激活,并且RT-PCR检测到PPAR-δ和PPAR-γ的上调,从而说明了该通路确实在氧中毒发生过程中激活。由于PPAR的抑制炎症反应作用,因此考虑这种随损伤程度相关的通路激活是机体的一种保护性反应,只是未能完全抵消氧中毒所造成的损伤,最终发生失代偿。
综上所述,PPAR通路在肺型氧中毒模型中的肺组织内得到激活,是机体本身的一种保护性作用,该通路的进一步激活是否能够逆转氧中毒所造成的肺组织损伤以及其中的调控机制还有待于下一步的深入研究。
[1]Mach W J,Thimmesch A R,Pierce J T,et al.Consequences of hyperoxia and the toxicity of oxygen in the lung[J].NursResPract,2011,2011:260482.
[2]Hedley-Whyte J.Pulmonary oxygen toxicity:investigation and mentoring[J].Ulster Med J,2008,77(1):39-42.
[3]Martin H.Role of PPAR-gamma in inflammation.Prospects for therapeutic intervention by food components[J].Mutat Res,2010,690(1-2):57-63.
[4]Belvisi M G,Mitchell J A.Targeting PPAR receptors in the airway for the treatment of inflammatory lung disease[J].Br J Pharmacol,2009,158(4):994-1003.
[5]Paola R D,Cuzzocrea S.Peroxisome proliferator-activated receptors and acute lung injury[J].PPAR Res,2007,2007:63745.
[6]Maeda T,Kishioka S.PPAR and pain[J].Int Rev Neurobiol,2009,85:165-177.
[7]Wang X,Wang Y,Zhao X,et al.Potential effects of peroxisome proliferator-activated receptor activator on LPS-induced lung injury in rats[J].Pulm Pharmacol Ther,2009,22(4):318-325.
[8]Di Paola R,Cuzzocrea S.Peroxisome proliferator-activated receptors ligands and ischemia-reperfusion injury[J].Naunyn Schmiedebergs Arch Pharmacol,2007,375(3):157-175.
