百里香染色体制片优化及核型分析
2012-08-20杨宁谈永霞李巧峡贾凌云陈锡莲刘效瑞
杨宁,谈永霞,2,李巧峡,贾凌云,陈锡莲,刘效瑞
(1.西北师范大学生命科学学院,甘肃 兰州730070;2.兰州理工大学生命科学与工程学院,甘肃 兰州730070;3.定西市旱作农业科研推广中心,甘肃 定西743000)
百里香(Thymus mongolicus),又名地姜、地椒、麝香草,为唇形科百里香属植物。百里香的株型奇特低矮,花型小,花色艳丽,且全株芳香,喜凉爽气候,喜光,稍耐荫,耐寒耐旱,忌湿,耐贫瘠[1]。百里香属植物原产于地中海沿岸,全球约有400多个种,广泛分布在北非、欧洲和亚洲温带地区,经济栽培以南欧最多[2]。我国有11种,2个变种,分布于甘肃、新疆、青海、西藏及黄河流域及以北地区[3]。百里香属植物具有分布广泛、适应性强、种内多型性较为普遍等特点,在温带干旱半干旱地区的荒漠化生境的植物群落组成及生态演替中发挥着重要的生态功能[4,5]。作为一种颇具开发价值的多用途植物,近年来,百里香作为芳香蔬菜、药用植物、香料作物、蜜源植物、观赏植被及干旱土壤的水土保持植物被大面积种植[6]。
形态学分类方法是最基本的植物分类方法,在植物分类研究中一直沿用。但是由于百里香属植物不同种之间的形态差异较小,加之近年来国外品种的大量引进,所以,仅以形态学方法难以提供可靠的分类依据,亟需采用多种方法来加强百里香属植物的分类研究[1]。随着分子生物学技术的发展,分子标记及基因序列的分析方法已被广泛应用于物种的亲缘关系、遗传变异及系统演化的研究。由于分子的研究方法是基于染色体上的一段DNA序列,因此其结果有时不如用染色体组分析法直观[7]。染色体核型分析技术能明确识别各个染色体的特征,有助于基因定位的研究,它是细胞遗传学的一项基本技术,也是染色体工程、细胞分类学和植物育种学的一个不可缺少的手段。对染色体进行核型分析,不仅有助于了解生物的遗传组成、遗传变异规律和发育机制,而且对预测鉴定种间杂交和多倍体育种的结果、了解性别遗传机理以及基因组数、物种起源、进化和种族关系的鉴定都具有重要的参考价值[8,9]。通过对细胞核染色体核型稳定特征(染色体的数目、相对长度、着丝点位置、核型不对称系数和随体的有无等)的分析,可以作为分类指标而被利用。因此,染色体核型分析技术可为研究生物的系统发育和亲缘关系提供依据[10]。
由于百里香属植物的染色体非常小,为1~2μm,一般较难观察,所以国内外对百里香属植物染色体数目、核型分析的研究的相关报道极少,国内仅见权俊萍等[11]对我国产4种2个变种百里香属植物进行了染色体数目及核型分析研究,国外对百里香属植物的研究较为广泛和深入,并依据形态学差异及地理分布特点等将其分为Micantes,Mastichina,Piperella,Teucrioides,Pseudothymbra,Thymus,Hyphodromi和Serpyllum 等8个组,其中分布于亚洲的种多存在Hyphodromi和Serpyllum组中[12]。然而对我国百里香属植物染色体的数目、核型分析方面的特征、染色体数目在种(变种)间的差异及其在百里香属所在组等方面的基础植物学问题仍有许多不清楚。笔者首次对甘肃康乐城郊百里香染色体制片技术进行了优化并对其染色体进行了核型分析,旨在积累其细胞学资料,以期为甘肃地产野生百里香的系统分类、遗传进化及遗传育种提供一定的科学依据。
1 材料与方法
1.1 材料
采自甘肃康乐县城郊百里香种子,挑选粒大饱满的百里香种子放在垫有双层湿润滤纸的培养皿中,于2009年11月置于25℃恒温培养箱中萌发。
1.2 方法
百里香幼苗芽尖为材料,选取上午8:00-10:00,每隔15min取材1次,用0.02%秋水仙素处理3h,以确定适宜的取材时间;以0.01%~0.04%秋水仙素附加8-羟基喹啉溶液作为预处理液,处理2~4h,以确定适宜的预处理液,预处理液及处理时间见表1。取预处理后的材料,漂洗2~3次,置于卡诺固定液室温下固定24h之后,用超纯水漂洗固定的材料2~3次,于0.1mol/L HCl中,60℃水浴锅内恒温分别解离5~25min,确定最适宜的解离时间;45%冰醋酸软化10min后用清水冲洗3~4次,切取百里香芽尖生长点部分,置于载玻片中央,滤纸吸去多余液体,改良石炭酸品红染色液分别染色10~80min,常规方法压片[13],之后镜检,对分散较好的染色体装片在100倍显微镜及图像分析系统下镜检并拍照。
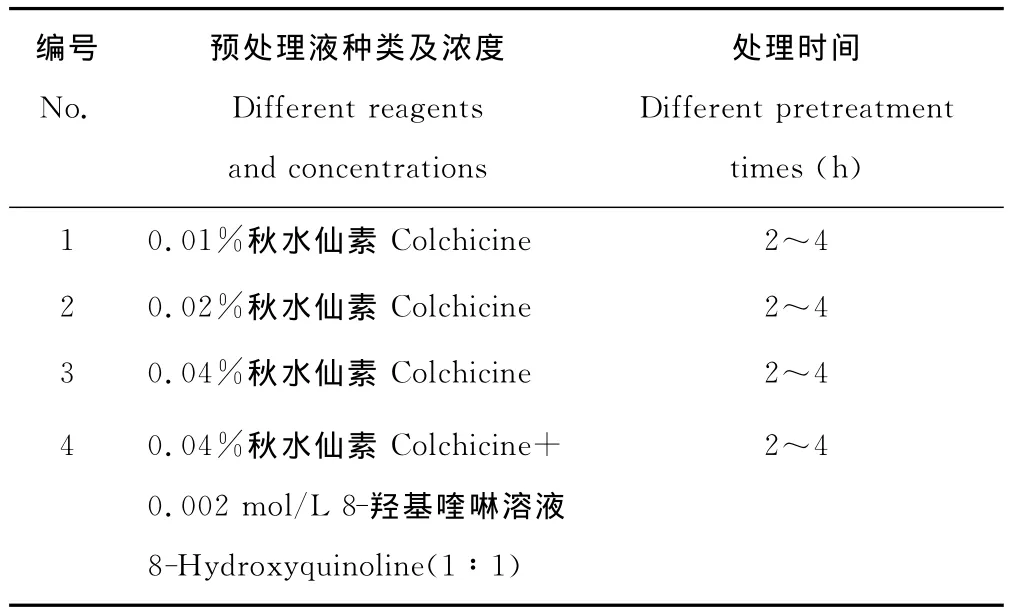
表1 预处理液及处理时间Table 1 Reagent and time for pretreatments
核型分析采用李懋学等[14,15]提出的标准进行;根据Levan等[16]的命名法则,来确定染色体的着丝点位置;染色体核型分类按照Stebbins[17]提出的根据最长与最短染色体的比值和臂比值,来区分核型对称和不对称程度;染色体相对长度指数(I.R.L)参考 Kuo[18]提出的方法计算;核型不对称系数(As.K)参考 Arano[19]的方法计算。相关公式为:

2 结果与分析
2.1 制片
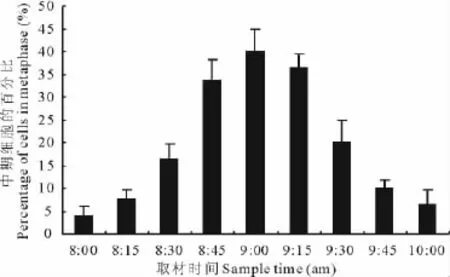
图1 不同取材时间内百里香中期细胞的百分比Fig.1 The percentage of the division cells in mitosis metaphase at different sampling times
上午8:45-9:15是观察百里香染色体数目比较好的时期,中期细胞的百分比最高可以达到40%(图1),其他取样时间虽然也可以观察到中期分裂相的细胞,但所占比例较小,不易筛选出分散较好的染色体分裂相。以0.04%秋水仙素和0.002mol/L 8-羟基喹啉等体积混合溶液预处理百里香芽尖2~3h,既发挥了秋水仙素累积分裂中期相的高效性,又保持了8-羟基喹啉能使染色体清晰,便于观察的特点(表2)。另外,在60℃,0.1mol/L HCl中解离15min,后用45%冰醋酸软化10min效果最佳;酸解5及10min由于细胞解离不充分,细胞不易分散,造成许多细胞重叠在一起,内部细胞由于接触不到染液而染色较浅,外部细胞却由于细胞质也着色,对比度低,染色体不容易观察;酸解20及25min虽然解离比较充分,细胞容易分散,细胞质也不易着色,但细胞中的染色体染色太浅而不易观察,部分细胞由于解离过度而出现破裂,染色体也出现不同程度的破坏,断裂成片段,影响染色体数目统计和核型分析(表3)。
2.2 核型分析
2.2.1 染色体数目 选择30个染色体分散良好的细胞观察计数,其中26个细胞染色体数目为24条,占计数总数的86.7%;4个细胞染色体数目为26,占计数总数的13.3%。根据核型分析标准化建议[16],确定百里香染色体数目为2n=2x=24。
2.2.2 染色体相对长度及核型分析 根据李懋学和陈瑞阳[14]提出的植物核型分析标准,进行百里香染色体核型分析。选择30个百里香细胞进行染色体计数,核型取5个细胞的平均值。测量染色体长臂和短臂,计算染色体相对长度、臂比值、染色体相对长度指数,按照染色体总长度由长至短的顺序对染色体进行排列和编号(表4,图2~4)。
实验结果可以得出百里香染色体的数目为2n=2x=24,其中第2号和第7号为近中部着丝粒染色体(sm),其余均为中部着丝粒染色体(m);由长染色体(L)、中长染色体(M2)、中短染色体(M1)和短染色体(S)4种染色体组成。核型公式为2n=2x=24=20m+4sm,核染色体相对长度在7.07%~13.13%,染色体长度比为1.86,染色体臂比大于2∶1的染色体占8.33%,按照Stebbins[17]的核型分类标准,百里香的核型属2A型,核型不对称系数为59.63%。
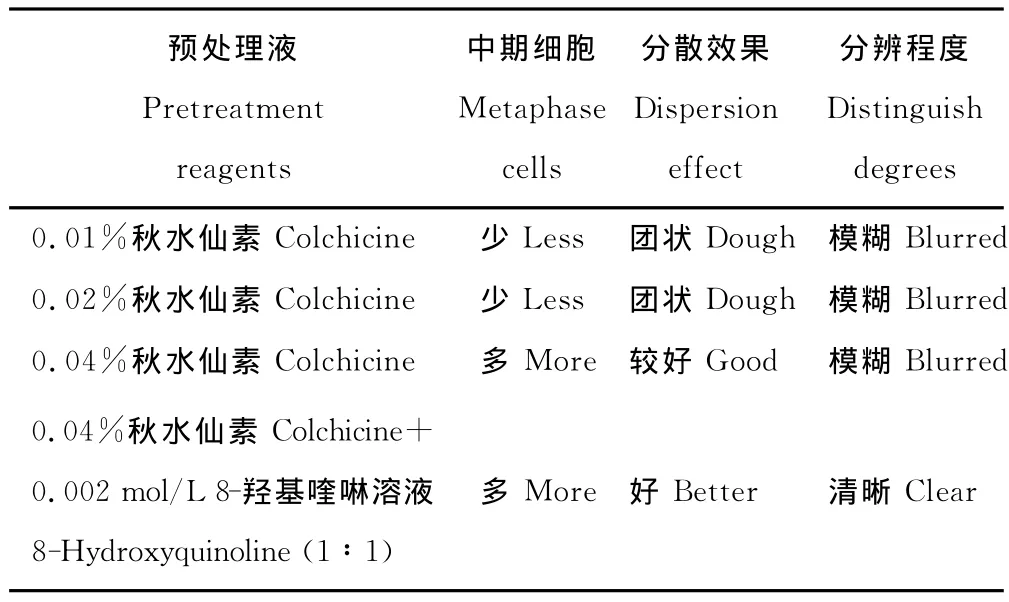
表2 不同预处理液的效果比较Table 2 Effects of different reagent for pretreatment
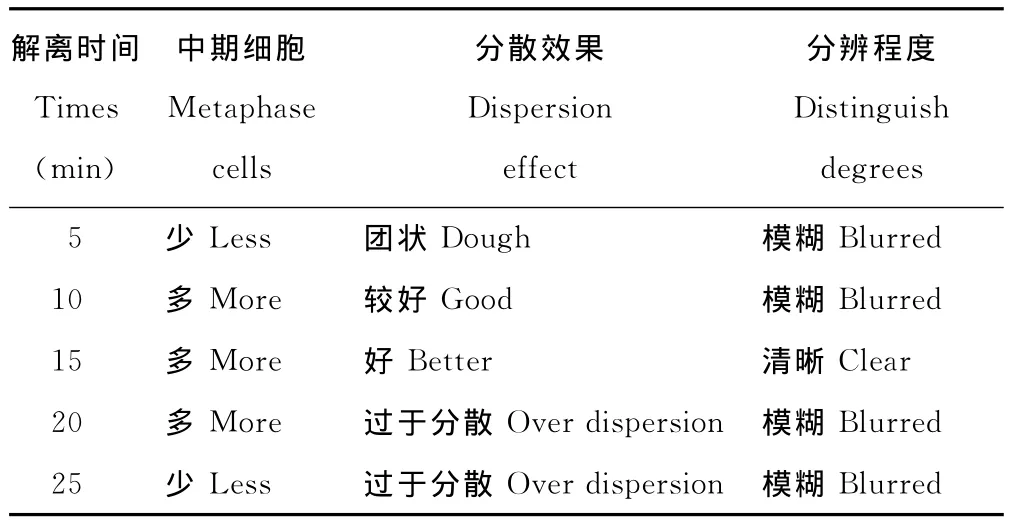
表3 不同解离时间的效果比较Table 3 Effect of different dissociation time
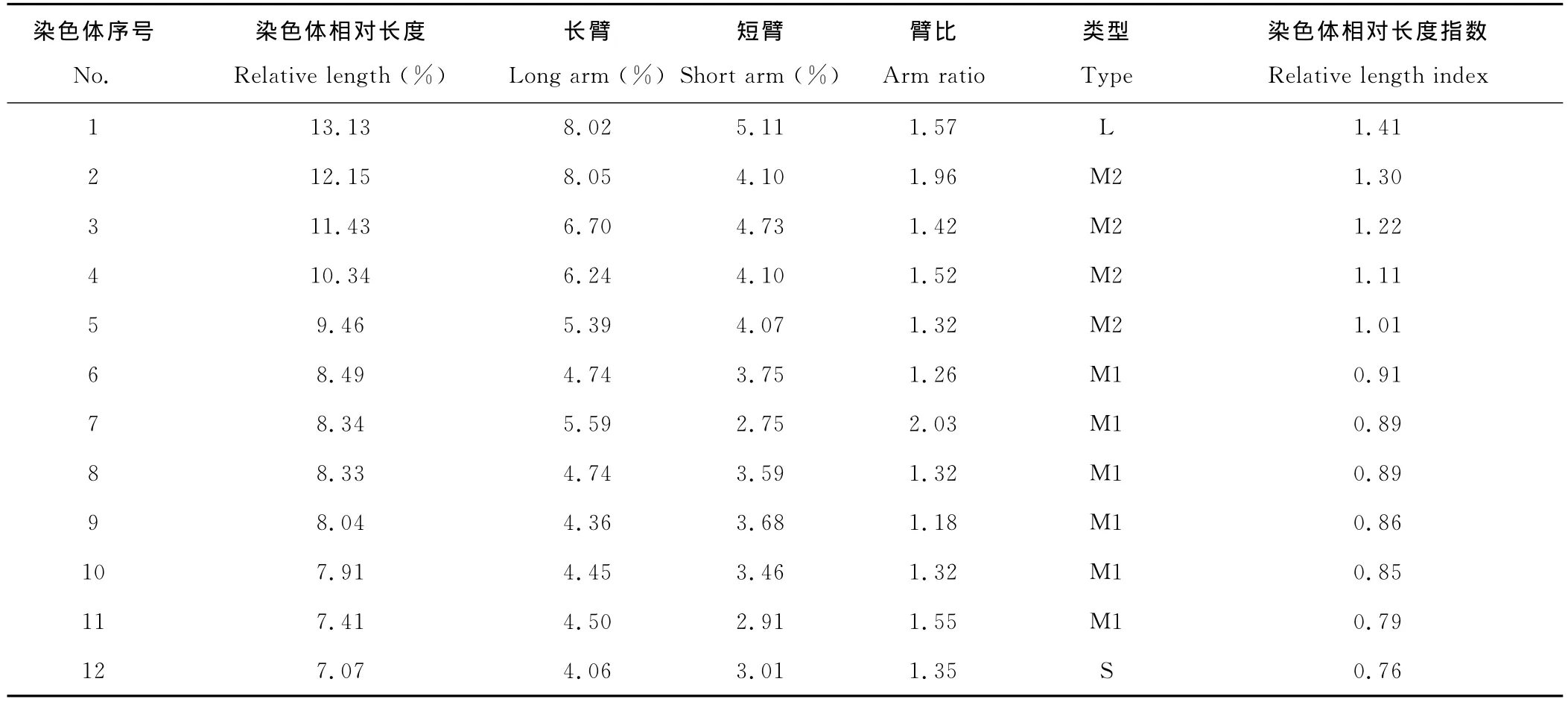
表4 百里香染色体的核型参数Table 4 Karyotype parameters of chromosome in T.mongolicus
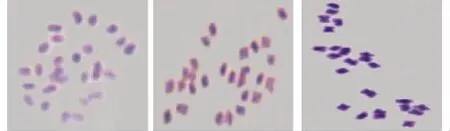
图2 百里香染色体形态Fig.2 The chromosome morphology of T.mongolicus
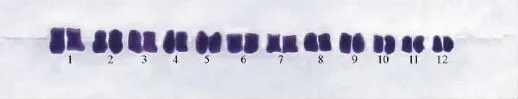
图3 百里香染色体的核型图Fig.3 Karyotype of chromosome in T.mongolicus
3 讨论
3.1 百里香染色体制片技术的探究
根据李懋学等[14,15]提出的植物核型分析标准,确定百里香的染色体属于小染色体,这给百里香染色体数目的统计和核型分析带来很大困难。取材部位、取材时间、预处理液的种类和浓度、预处理时间、酸解的时间及方法、染色时间等都影响实验的成败。理论上讲,任何时间取样压片,都可以从正常生长的根中获得中期分裂相[20,21]。但是如果分裂相所占的比例很小,核型分析就十分困难。李国珍[22]认为,一般植物细胞染色体的分裂高峰期在上午的8:00-10:00,而董然等[23]在对长白山3种橐吾(Ligulariasibirica)的核型研究中,取材时间为上午10:00,赵振军[24]在阿拉伯茶(Cathaedulis)细胞的研究中得出细胞集中分裂时间在上午8:30-11:30,阎素丽[25]在对向日葵(Helianthusannus)的核型分析中发现上午9:30-10:00是取材的最佳时间,而本实验初步观察到百里香在上午8:45-9:15间存在分裂高峰期,将近40%的细胞处于分裂中期,有利于筛选分散良好的百里香染色体用于核型分析。
在染色体制片中对材料进行预处理主要是阻断纺锤体的形成,使细胞分裂终止在中期阶段,可提高中期分裂相的出现频率。由于植物不同物种之间的差异性,不同植物所适合的预处理液一般不同。张永兵等[26]在对甜瓜(Cucumismelo)的核型分析中用对二氯苯和纺线菌酮的混合液预处理甜瓜根尖,获得了主、次缢痕清晰、分散良好的中期染色体分裂相,张红梅等[27]在青花菜(Brassicaoleracea)染色体核型分析中得出用0.002mol/L 8-羟基喹啉处理2.5h染色体分散性最好。本实验确定在百里香染色体制片中以0.04%秋水仙素和0.002mol/L 8-羟基喹啉等体积混合溶液预处理百里香芽尖2~3h,秋水仙素累积分裂中期相最多,结合8-羟基喹啉又能使染色体更清晰、便于观察。
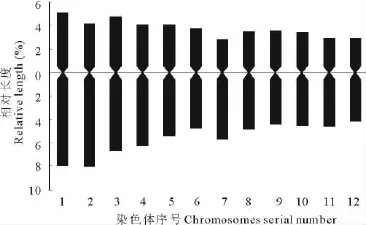
图4 百里香染色体的核型模式图Fig.4 Karyotype pattern of chromosome in T.mongolicus
3.2 百里香的遗传分类学探讨
国外对百里香属内各组部分种的研究结果表明,Micantes组染色体为二倍体,染色体数目为30,Mastichina组的染色体为二倍体和四倍体,染色体数目有30,58,60,染色体基数多为15或15的倍数;Piperella组的染色体为二倍体,基数为14;Pseudothymbra组的染色体包括有二倍体和四倍体,染色体数目包括28,30,56,染色体基数为14,15或相应的倍数;Thymus组的染色体比较复杂,染色体数目包括有28,30,54,56,58,基数多为14,15,27,28,29;Hyphodromi组染色体数目有26,28,42,54,56,58,60,62,84,90,染色体基数包括13,14,21及它们的倍数等等;Serpyllum组同 Hyphodromi组较相似,染色体数目有24,26,28,30,32,35,52,56,58,84,90,染色体基数包括12,13,14,21等[11,28]。本实验结果表明,甘肃康乐地产野生百里香的染色体为2倍体:2n=2x,染色体基数为12,对比国外报道的百里香属各组的染色体数目资料,初步比较发现产自甘肃康乐县的百里香染色体数目及形态特征与百里香属内的Serpyllum组在染色体基数及数目方面较为相似。一般认为,核型进化的基本趋势是由对称向不对称发展的,系统演化上处于比较古老或原始的植物,大多具有较对称的核型,而不对称的核型则常见于衍生的、特化的以及比较进化的植物类群中[15]。核型不对称系数越接近50%,核型的对称程度越高,进化程度越原始,对甘肃地产百里香核型不对称系数和核型类型分析,百里香的核型不对称系数为59.63%,接近于50%,具有较大的对称性;其核型属2A型,表明甘肃地产百里香在百里香属中是相对较为原始的。而权俊萍等[11]对我国4种、2个亚种百里香属植物的研究结果中表明,除百里香种未确定外,其他3种及2个亚种的核型均为2B,说明它们在百里香属中是比较进化的,这与对甘肃康乐县地产百里香核型的研究结果有一定的差异,推测甘肃康乐地产百里香在百里香属中是比较原始,不能归属于上述3种。关于其在百里香属内的系统地位问题,还需进一步研究,才能作出准确判断。
[1] 卞金山,杜广明,赵波.我国百里香属植物研究进展[J].草原与草坪,2007,1:78-81.
[2] 中国科学院中国植物志编辑委员会(云南省植物研究所).中国植物志(第65卷.第2分册)[M].北京:科学出版社,1977:256.
[3] 中国科学院植物研究所.中国高等植物图鉴(第三册)[M].北京:科学出版社,2002:681.
[4] Sotomayor J A.Estudio sobre plantas aromaticas de los generos Salviay Thymus,espontaneas en el Sureste Iberico,para suestablecimiento como cultivo[D].Murcia,Spain:University of Murcia.Departamen to de Biologia Vegetal(Botanica),1998.
[5] 张颖,贾志斌,杨持.百里香无性系的克隆生长特性[J].植物生态学报,2007,31(4):630-636.
[6] 员铭,吕国华.百里香应用价值研究[J].安徽农学通报,2007,13(2):89-91.
[7] 张春,王晓丽,于海清,等.拟鹅观草属与鹅观草属和披碱草属属间及种间杂种的细胞学研究[J].草业学报,2009,18(3):86-93.
[8] 吴仲庆.水产生物遗传育种学[M].厦门:厦门大学出版社,2000.
[9] 林明敏,朱香萍.石鲽染色体核型分析[J].青岛农业大学学报(自然科学版),2009,(2):128-130.
[10] 高天鹏,王转莉,郭怀清,等.青藏高原东缘3种风毛菊属植物的核型研究[J].草业学报,2009,18(2):169-174.
[11] 权俊萍,夏冰,何树兰,等.百里香属植物染色体分析[J].石河子大学学报(自然科学版),2010,28(1):18-21.
[12] Morales R.Synopsis of the genus Thymus L.in the Mediterranean area[J].Lagascalia,1997,19(1):249-262.
[13] 刘祖洞,江绍慧.遗传学实验[M].北京:高等教育出版社,1979:10.
[14] 李懋学,陈瑞阳.关于植物核型分析的标准化问题[J].武汉植物研究,1985,3(4):297-302.
[15] 李懋学,张赞平.作物染色体及其研究技术[M].北京:中国农业出版社,1996:1-37.
[16] Levan A,Fredga K,Sandberg A A.Nomenclature for centromeric position on chromosomes[J].Hereditas,1964,52:197-201.
[17] Stebbins G L.Chromosomal Evolution in Higher Plants[M].London:Edward Arnold L TD,1971:87-89.
[18] Kuo S R.Karyotype analysis of some Formosan gymnosperms[J].Taiwania,1972,17(1):66-80.
[19] Arano H.The karotypes and the speciations in subfamily Carduoi deae of Japan[J].Japanese Journal of Botany,1965,19(3):31-67.
[20] 刘永安,冯海生,陈志国,等.植物染色体核型分析常用方法概述[J].贵州农业科学,2006,34(1):98-102.
[21] Li M X.Application of P-dichlorobenzene in chromosome pre-treatment in plants[J].Hereditas,1980,2(6):30-32.
[22] 李国珍.染色体及其研究方法[M].北京:科学出版社,1985.
[23] 董然,瞿小杰,王丽清,等.长白山3种橐吾的核型研究[J].草业学报,2010,19(4):259-263.
[24] 赵振军.阿拉伯茶组织培养与核型分析[D].南京:南京农业大学,2006.
[25] 阎素丽.向日葵染色体核型分析及单染色体微切割、微分离和微克隆[D].呼和浩特:内蒙古农业大学,2009.
[26] 张永兵,陈劲枫,伊鸿平,等.甜瓜有丝分裂染色体制片技术及核型分析[J].西北植物学报,2005,25(9):1735-1739.
[27] 张红梅,张蜀宁,孔艳娥,等.青花菜染色体制片技术及核型分析[J].南京农业大学学报,2009,32(4):33-36.
[28] Hartvig P.A taxonomic revision of Thymus sect.Teucriodes(Lamiaceae)[J].Plant System Evolution,1987,155:197-213.
