农杆菌不同菌液浓度对柳枝稷种子萌发及幼苗生长发育的影响
2012-08-20徐开杰燕明献柴乖强孙风丽刘曙东奚亚军
徐开杰,燕明献,柴乖强,孙风丽,刘曙东,奚亚军
(西北农林科技大学农学院,陕西 杨凌712100)
柳枝稷(Panicum virgatum),属于禾本科(Gramineae)黍属(Panicum),是起源于北美洛基山脉以东、北纬55°以南大草原的高秆多年生草本C4植物,通常被用于放牧、水土保持以及生态建设等[1,2]。近几年来随着社会的发展,人类对能源的需求日益剧增,而全球化石原料的不可再生性以及其对环境造成的严重污染,使寻找一种新的可再生清洁能源成为世界各国研究的当务之急。柳枝稷因其适应性强,生物量潜力高和耐旱耐贫瘠能力较强,对环境友好,能够用于生产生物能源等优点引起了国内外的重视[3-5]。
随着分子生物学的发展,农杆菌介导法已成为一种最常用的植物遗传转化方法,在植物遗传改良方面展示出广阔地应用前景,在多数双子叶植物和少数单子叶植物中实现了较为高效的转化[6-8]。与其他转化方法相比,农杆菌介导的遗传转化系统具有转化的外源DNA结构完整、遗传稳定、拷贝数低、转化的DNA片段较大等优点,已成为目前大多数植物遗传转化的首选方法[9-12]。
柳枝稷的遗传转化研究起步较晚,迄今为止国内外对柳枝稷农杆菌转基因研究尚处于体系建立的探索阶段[13-16]。农杆菌常规介导法对组织培养技术依赖性强,对组织培养条件要求严格,农杆菌(Agrobacterium tumefaciens)浸染过的愈伤组织在培养过程中受剩余农杆菌难以抑制、抗生素筛选等因素的影响而长势较弱、缺乏生长点甚至大量死亡等特殊问题,使得传统的农杆菌介导法在柳枝稷上受到了一定限制。
农杆菌浸种法是将萌动种子直接浸泡在农杆菌菌液中,利用农杆菌的浸染特性和植物细胞自身的物质转运系统把外源基因导入受体细胞并整合到基因组中稳定表达,通过种子天然的遗传传递能力,实现遗传转化[17]。这种方法操作简单,避免了常规介导法存在的一系列弊端。1987年,Feldmann和Marks[18]首次报道应用农杆菌浸种法在拟南芥(Arabidopsis thaliana)中取得成功,继而应用该法在小麦(Triticum aestivum)、黄瓜(Cucumis sativus)和番茄(Solanum lycopersicum)等作物中也取得成功[17,19-21]。
本试验以‘西稷1号’、‘西稷2号’和‘西稷3号’3个基因型的柳枝稷种子作为研究对象,通过分析农杆菌浸种后柳枝稷种子萌发和幼苗生长发育的相关指标,确定不同浓度农杆菌对柳枝稷种子萌发和幼苗生长发育的影响,以期为柳枝稷农杆菌浸种法遗传转化体系的建立提供一定参考。
1 材料与方法
1.1 材料
以西北农林科技大学小麦和柳枝稷分子育种实验室选育的3个柳枝稷品系‘西稷1号’、‘西稷2号’和‘西稷3号’为试验材料,农杆菌菌株为本实验室提供的EHA105,试验于2011年4-6月在西北农林科技大学温室进行。
1.2 方法
1.2.1 种子预处理 取成熟饱满的柳枝稷种子,70%的酒精表面消毒,用20%的NaClO灭菌15~20min,无菌水冲洗3~4次,室温无菌水浸种12h,4℃过夜,然后滤干水分24℃暗培养至种子露白。
1.2.2 农杆菌准备 用LB(Luria-Bertani)固体培养基划线接种农杆菌,28℃静置暗培养2~3d。刮出单菌落接入LB液体培养基中,28℃、220r/min振荡培养24h,分光光度计(725N,上海棱光)在波长为600nm的吸光度测定菌液OD600值。
1.2.3 农杆菌浸种 试验采用裂区设计,以柳枝稷不同品系为主区,农杆菌菌液浓度为副区。其中农杆菌菌液浓度梯度设置为CK(以未加农杆菌的LB培养基为对照),0.4,0.8,1.2和1.6OD600共5个水平,将预处理露白的柳枝稷种子利用农杆菌浸种4h后倒掉菌液,用无菌水冲洗干净,于24℃黑暗条件下共培养2d,然后转入光照条件下,1周后待幼苗根长2cm左右,转移到温室盆栽,取大田土过筛装盆,每盆12株,试验温室盆栽管理条件是在25℃,光照强度12 000lx,光照时间14h/d,每隔3d浇1次水,7d施1次肥,试验重复3次。
1.2.4 测定项目与方法 农杆菌浸种后第7天测定发芽率(盆栽前),盆栽第3周幼苗三叶期取其叶片测定其余指标。

幼苗总叶绿素含量用丙酮法测量[22];超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化物酶(peroxidase,POD)活性、过氧化氢酶(catalase,CAT)活性和丙二醛(malondialdehyde,MDA)含量具体参照孙群和胡景江[23]的方法测定,每指标均重复测定3次。
1.3 数据处理
采用DPS裂区设计中的LSD检验进行统计分析,用Origin软件作图。
2 结果与分析
2.1 农杆菌不同菌液浓度对柳枝稷种子发芽率的影响
农杆菌对柳枝稷不同品系发芽率的影响大致相同。在菌液浓度≤1.2OD600时,种子发芽率随菌液浓度的增大呈下降趋势,在1.2OD600时,发芽率达到最低值,此后略有升高(图1)。方差分析表明,品系与浓度间的互作效应不显著。品系间西稷1号与西稷3号的发芽率差异不显著,而两者极显著高于西稷2号(P<0.01)。在一定菌液浓度范围内(≤1.2OD600),柳枝稷种子发芽率随着农杆菌菌液浓度增加而显著降低,各处理与对照间差异均达到极显著水平(P<0.01)。但当菌液浓度高于1.2OD600后,柳枝稷种子发芽率不再降低,且有一定程度回升。
2.2 农杆菌不同菌液浓度对柳枝稷幼苗成苗率的影响
农杆菌浸种不仅能抑制种子的萌发,也影响柳枝稷幼苗的成苗率(图2)。柳枝稷幼苗的成苗率随着菌液浓度的升高总体呈下降趋势。在农杆菌菌液浓度较低时,成苗率较高,当菌液浓度为1.6OD600时,3个材料的幼苗成苗率均达到或接近最小值,分别为22.73%,18.01%和42.15%,其成苗率均低于50%。方差分析表明,品系与浓度间互作效应不显著。品系间表现为西稷3号>西稷1号>西稷2号,各品系间差异均达极显著水平(P<0.01)。在菌液浓度≤0.8OD600时,幼苗成苗率呈下降趋势,且各处理间的幼苗成苗率差异极显著(P<0.01);菌液浓度在0.8~1.2OD600时,幼苗成苗率又极显著升高(P<0.01);此后幼苗成苗率极显著下降(P<0.01),除西稷3号0.8和1.6OD600处理差异不显著外,其余各处理间差异均达极显著水平,说明农杆菌菌液浓度过高对柳枝稷幼苗有毒害作用。
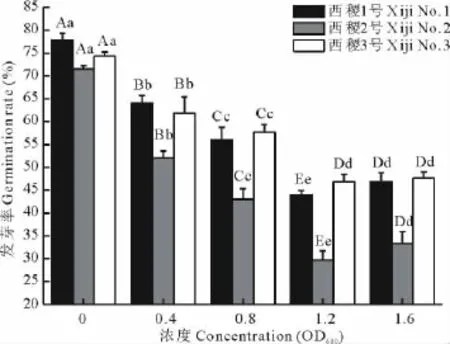
图1 农杆菌不同菌液浓度对柳枝稷种子发芽率的影响Fig.1 Influence of different concentration of A.tumefaciens on seed germination rate of P.virgatum
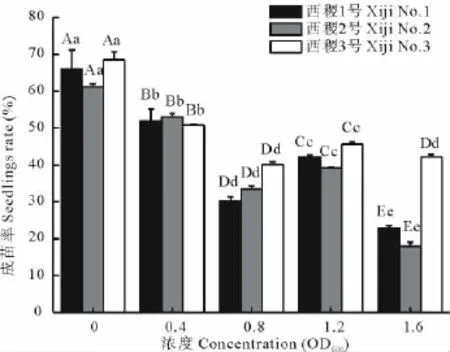
图2 农杆菌不同菌液浓度对柳枝稷幼苗成苗率的影响Fig.2 Influence of different concentration of A.tumefaciens on seedlings rate of P.virgatum
2.3 农杆菌不同菌液浓度对柳枝稷幼苗叶绿素含量的影响
农杆菌对柳枝稷幼苗叶绿素含量的影响是随菌液浓度的升高幼苗叶绿素含量呈极显著下降趋势(P<0.01)(图3)。经方差分析,品系与浓度间互作效应不显著。品系间西稷3号显著高于西稷1号(P<0.05),极显著高于西稷2号(P<0.01),而西稷1号与2号差异不显著。农杆菌对柳枝稷幼苗叶绿素含量的影响随浓度的升高明显增大,不同菌液浓度处理与对照间差异均达极显著水平(P<0.01),这表明农杆菌对幼苗叶绿素的合成具有不利影响,且影响随菌液浓度的增大而增大。
2.4 农杆菌不同菌液浓度对柳枝稷幼苗SOD活性的影响
当植物处于逆境条件下,一方面使活性氧产生加快,另一方面植物本身会促使以超氧化物歧化酶(SOD)为主的保护系统的酶活性升高,以减少细胞膜系统及生物大分子受到的损伤[22,23]。
农杆菌对柳枝稷幼苗SOD活性的影响是随菌液浓度的增大表现出先升后降的趋势,在1.2OD600时达到最大值(图4)。方差分析结果表明,品系与浓度间的互作效应不显著。品系间西稷3号极显著高于西稷1号、2号(P<0.01),而后两者差异不显著。在菌液浓度≤1.2OD600时,不同品系SOD活性极显著上升(P<0.01);而当浓度达到1.6OD600时,SOD活性则极显著降低(P<0.01)。除西稷2号1.6OD600处理与对照间差异显著外(P<0.05),其余各处理间差异均达极显著水平(P<0.01)。这表明农杆菌对柳枝稷幼苗的伤害随菌液浓度的增大而增大。在低浓度(≤1.2OD600)时,农杆菌对幼苗已经造成伤害,但植物本身可能还可以通过自身的保护作用进行修复,而当浓度继续增大,其伤害已经超过幼苗的自身保护作用,植物受到严重伤害,最终影响幼苗的正常生长发育,甚至出现死苗现象。
2.5 农杆菌不同菌液浓度对柳枝稷幼苗CAT活性的影响
过氧化氢酶(CAT)普遍存在于植物组织中,是一种酶类清除剂,又称为触酶。它与超氧化物歧化酶(SOD),过氧化物酶(POD)等协同作用,可促使SOD酶产生的H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一[22,23]。
农杆菌对柳枝稷幼苗CAT活性的影响是随菌液浓度的升高而呈上升趋势(图5),尤其是在浓度超过1.2 OD600时上升的速率更快。经方差分析,品系与浓度间互作效应不显著;农杆菌不同菌液浓度对柳枝稷不同品系幼苗CAT活性的影响存在差异,其中西稷1号和2号极显著的高于西稷3号(P<0.01),而前两者差异不显著。在菌液浓度≤0.8OD600时,柳枝稷不同品系幼苗CAT活性均极显著上升(P<0.01);在0.8~1.2OD600间,西稷3号极显著升高(P<0.01),西稷1号上升趋势不再显著,而西稷2号则极显著下降(P<0.01);此后幼苗CAT活性又均极显著升高(P<0.01)。这也证实农杆菌对柳枝稷幼苗的伤害是随菌液浓度的升高而增大,尤其是在浓度超过1.2OD600时伤害更明显。
2.6 农杆菌不同菌液浓度对柳枝稷幼苗POD活性的影响
过氧化物酶(POD)是植物体内普遍存在且活性较高的一种酶,主要存在于植物细胞的过氧化物酶体中,可催化过氧化氢、氧化酚类和胺类化合物,具有消除氧代谢中产生的过氧化氢和酚类、胺类等毒性物质的作用,是植物体内的保护酶之一[22]。
农杆菌对柳枝稷幼苗POD活性的影响与CAT活性的影响相似,随菌液浓度的升高而升高,尤其是在浓度超过0.8OD600时上升的更快(图6)。经方差分析,品系与菌液浓度的互作效应不显著。而农杆菌对不同柳枝稷品系POD活性的影响存在差异,其中表现趋势为西稷2号>西稷3号>西稷1号。农杆菌不同菌液浓度与对照间差异均达极显著水平(P<0.01)。再次说明农杆菌对柳枝稷具有伤害作用,且伤害程度随菌液浓度的增大而增大。
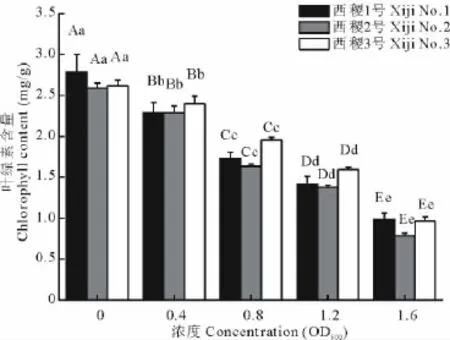
图3 农杆菌不同菌液浓度对柳枝稷幼苗叶绿素含量的影响Fig.3 Influence of different concentration of A.tumefaciens on seedlings chlorophyll content of P.virgatum
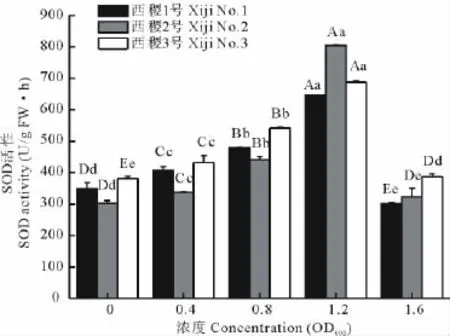
图4 农杆菌不同菌液浓度对柳枝稷幼苗SOD活性的影响Fig.4 Influence of different concentration of A.tumefaciens on seedlings SOD activity of P.virgatum
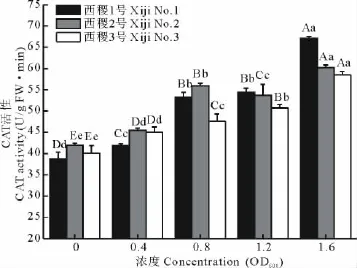
图5 农杆菌不同菌液浓度对柳枝稷幼苗CAT活性的影响Fig.5 Influence of different concentration of A.tumefaciens on seedlings CAT activity of P.virgatum
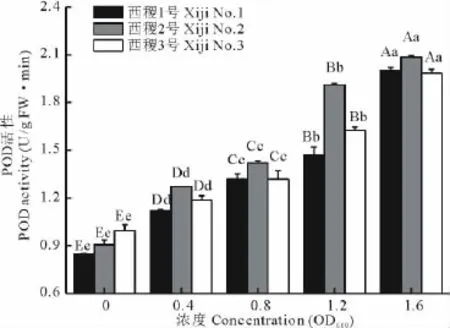
图6 农杆菌不同菌液浓度对柳枝稷幼苗POD活性的影响Fig.6 Influence of different concentration of A.tumefaciens on seedlings POD activity of P.virgatum
2.7 农杆菌不同菌液浓度对柳枝稷幼苗MDA含量的影响
植物在逆境下遭受伤害与活性氧积累诱发的膜脂过氧化作用密切有关,丙二醛(MDA)是膜脂过氧化作用最重要的产物之一,通过测定MDA可以间接测定膜系统受损伤的程度[23]。
农杆菌对柳枝稷幼苗MDA含量的影响是随菌液浓度的升高而呈上升趋势,尤其是在浓度超过0.8 OD600时,其上升速率变得更大(图7)。经方差分析,品系与浓度间的互作效应不显著。农杆菌对不同柳枝稷品系MDA含量的影响存在差异,其表现为西稷1、2号极显著高于西稷3号(P<0.01),而前两者的差异不显著。不同菌液浓度处理与对照间差异均达极显著水平(P<0.01),同一品种不同浓度处理间除西稷2号中1.2与1.6OD600处理差异不显著外,其余均达极显著水平(P<0.01)。同样反映了农杆菌对柳枝稷具有不利影响,且其影响随农杆菌浓度的增加而增大。
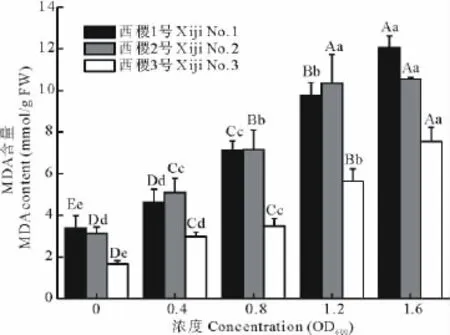
图7 农杆菌不同菌液浓度对柳枝稷幼苗MDA含量的影响Fig.7 Influence of different concentration of A.tumefaciens on seedlings MDA content of P.virgatum
3 结论与讨论
在逆境条件下,植物通常会表现出衰老加速的趋势,即叶绿素含量降低,叶色变黄,蛋白质、核酸等大分子水解加速,原生质膜以及内膜系统发生过氧化,细胞膜透性和膜脂过氧化产物MDA含量增加,SOD、CAT和POD酶促防御系统活性下降[23,24]。蔡建一等[25]认为SOD、CAT和POD三种酶在活性氧清除过程中具有较强的协调能力。在本试验过程中发现,SOD活性是呈先升后降的趋势,而CAT和POD则是呈上升趋势,每种酶在不同程度的胁迫中所起的作用大小有所不同,在低浓度的农杆菌侵染胁迫下,SOD的活性较高起主要作用,而当浓度超过1.2OD600时,SOD活性降低,CAT和POD起主要作用。
不同基因型的植物对农杆菌的侵染敏感程度也不同[26]。本试验对柳枝稷不同品系的种子发芽率、幼苗成苗率、叶绿素含量、SOD活性、CAT活性、POD活性以及MDA含量等指标测定结果表明,农杆菌对不同基因型柳枝稷的影响存在差异,西稷1号、西稷2号和西稷3号对农杆菌的敏感程度有所不同,西稷3号种子发芽率、幼苗成苗率、叶绿素含量和SOD活性都较西稷1号、西稷2号明显偏高,而幼苗MDA含量明显偏低,这表明西稷1、2号相比西稷3号对农杆菌的伤害更敏感,因此在进行农杆菌遗传转化时,可适当提高对西稷3号的侵染浓度。
在植物遗传转化体系的构建过程中,转化效率和获得转基因植株的规模是评价转化体系成功与否的两大关键因素。陈明利等[27]认为农杆菌浓度OD600值小于0.5时,即使采用长时间侵染,转化效率也不高。同时,农杆菌浓度也不宜过大,否则会造成农杆菌污染,伤害受体的正常生理活动和分化,最终难以提高转化效率。在农杆菌遗传转化试验中,不同作物对农杆菌菌液浓度的敏感程度也不同。奚亚军等[20]在转化小麦的试验中农杆菌采用的1.5OD600,雷江丽等[28]在做中华结缕草(Zoysia sinica)转化时农杆菌浓度却采用0.9OD600,而关于柳枝稷农杆菌浸种浓度的文章还未见报道。本试验通过设置不同浓度的农杆菌对柳枝稷种子萌发及幼苗生长发育的影响结果表明,农杆菌浸种对柳枝稷产生不利影响,且其不利影响随农杆菌浓度的增大而增大,尤其是浓度超过1.2 OD600时,胁迫作用更为明显。此时对柳枝稷种子及幼苗都产生了较为严重的伤害,柳枝稷种子发芽率显著降低,幼苗出现生长缓慢、停止甚至出现死苗的现象。因此在充分考虑转基因效率的同时,更要注意提高幼苗的成苗率,本试验最终结果显示在利用农杆菌浸种法进行柳枝稷遗传转化中农杆菌菌液浓度不应超过1.2OD600。
农杆菌侵染浓度、侵染时间和共培养条件是影响农杆菌转化效率的最主要因素,本试验主要针对农杆菌浓度进行研究,而未涉及侵染时间和共培养条件等其他的影响因素。因此在后面试验中应对侵染时间和共培养条件以及它们之间的互作效应进行深入研究。
[1] 徐炳成,山仑,黄瑾,等.柳枝稷和白羊草苗期水分利用与根冠比的比较[J].草业学报,2003,12(4):73-77.
[2] 黄黔.我国的生态建设与生态现代化[J].草业学报,2008,17(2):1-8.
[3] Shen H,Fu C X,Xiao X R,et al.Developmental control of lignification in stems of lowland switchgrass variety Alamo and the effects on saccharification efficiency[J].Bioenergy Research,2009,2(4):233-245.
[4] Srivastava A C,Palanichelvam K,Ma J,et al.Collection and analysis of expressed sequence tags derived from laser capture microdissected switchgrass(Panicum virgatumL.Alamo)vascular tissues[J].Bioenergy Research,2010,3(3):278-294.
[5] 刘吉利,朱万斌,谢光辉,等.能源作物柳枝稷研究进展[J].草业学报,2009,18(3):232-240.
[6] Nadolska-Orczk A,Orczvk W,Ptvetakiewicz A.Agrobacterium-mediated transformation of cereals from technique development to its application[J].Acta Physiologiae Plantarum,2000,22(1):77-88.
[7] Cheng M,Lowe B A,Spencer T M,et al.Factors influencing Agrobacterium-mediated transformation of monocotyledonous species[J].In Vitro Cellular and Development Biology-Plant,2004,40(1):31-45.
[8] 张佳星,何聪芬,叶兴国,等.农杆菌介导的单子叶植物转基因研究进展[J].生物技术通报,2007,2:23-26.
[9] Vogel J,Hill T.High-efficiency Agrobacterium-mediated transformation of Brachypodium distachyoninbred line Bd21-3[J].Plant Cell Reports,2008,27(3):471-478.
[10] 张芳,王舟,宗俊勤,等.农杆菌介导的假俭草遗传转化体系的建立[J].草业学报,2011,20(2):184-192.
[11] 徐春波,王勇,赵海霞,等.农杆菌介导的紫花苜蓿高效遗传转化体系的研究[J].生物技术通报,2011,4:93-97.
[12] 吴雪莉,刘金星,Klaus K N,等.二穗短柄草幼胚再生体系及农杆菌介导转化的初步研究[J].草业学报,2010,19(5):9-16.
[13] Somleva M N,Tomaszewski Z,Conger B V.Agrobacterium-mediated genetic transformation of switchgrass[J].Crop Science,2002,42(6):2080-2087.
[14] Xi Y J,Fu C X,Ge Y X,et al.Agrobacterium-mediated transformation of switchgrass and inheritance of the transgenes[J].Bioenerg Resarch,2009,2(4):275-283.
[15] Xi Y J,Ge Y X,Wang Z Y.Genetic transformation of switchgrass[J].Methods in Molecular Biology,2009,581(5):53-59.
[16] Li R Y,Qu R D.High throughput Agrobacterium-mediated switchgrass transformation[J].Biomass and Bioenergy,2011,35(3):1046-1054.
[17] 许耀,王艇,李宝健.根癌农杆菌介导的外源基因转化植物萌动种胚的研究[J].实验生物学报,1991,24(2):109-117.
[18] Feldmann K A,Marks M D.Agrobacteriummediated transformation of germinating seeds of Arabidopsis thaliana:a nontissue culture approach[J].Molecular & General Genetics,1987,208:1-9.
[19] 林拥军.农杆菌介导的水稻高效遗传转化体系的研究[D].武汉:华中农业大学,2001.
[20] 奚亚军,张启发,林拥军,等.利用农杆菌浸种法将叶片衰老抑制基因PSAG12-IPT导入普通小麦的研究[J].中国农业科学,2004,37(8):1235-1238.
[21] 王丹,吴燕民,刘水,等.利用农杆菌浸种法建立白三叶草遗传转化体系的研究[J].中国农业科技导报,2009,11(1):96-101.
[22] 高俊凤.植物生理学实验技术[M].北京:高等教育出版社,2006.
[23] 孙群,胡景江.植物生理研究技术[M].杨凌:西北农林科技大学出版社,2006.
[24] 邹丽娜,周志宇,颜淑云,等.盐分胁迫对紫穗槐幼苗生理生化特性的影响[J].草业学报,2011,20(3):84-90.
[25] 蔡建一,马清,周向睿,等.Na+在霸王适应渗透胁迫中的生理作用[J].草业学报,2011,20(1):89-95.
[26] 郭志江,丁在松,王金明,等.农杆菌介导遗传转化敏感基因型小麦的筛选鉴定[J].华北农学报,2008,23(4):81-84.
[27] 陈明利,刘香利,唐广立,等.农杆菌侵染小麦的优化方案[J].分子植物育种,2007,5(4):577-582.
[28] 雷江丽,王丹,吴燕民,等.农杆菌浸种法介导中华结缕草遗传转化体系的建立[J].农业生物技术学报,2009,17(5):865-871.
