东方山羊豆脱水蛋白基因的克隆及初步分析
2012-08-20李玉坤王学敏王赞李俊VladimirNikolay孙桂枝高洪文
李玉坤,王学敏,王赞,李俊,Vladimir C,Nikolay D,孙桂枝,高洪文*
(1.中国农业科学院北京畜牧兽医研究所,北京100193;2.俄罗斯瓦维洛夫全俄植物栽培研究所,圣彼得堡190000)
干旱、高盐、低温等非生物胁迫严重影响了植物的生存和产量,它们均可造成植物细胞缺水,产生干旱信号,诱导植物的抗旱反应。晚期胚胎发生丰富蛋白(late embryogenesis abundant protein,LEA)是一种脱水保护剂,能够在水分胁迫下保护生物大分子。LEA蛋白可分为许多不同的家族[1,2],脱水蛋白(dehydrin,DHN)属于LEAⅡ或LEA D-11蛋白家族[2]。DHN可在胚胎发生晚期或者在干旱、低温、盐胁迫和ABA的诱导下表达[3]。脱水蛋白一级结构保守性强,具有K,S和Y等3个高度保守区域,通常以YSK的顺序结合在一起[3]。Y片段为(V/T)DEYGNP,位于N末端。K片段(EKKGIMDKIKEKLPG)由15个氨基酸组成。S片段是一个可磷酸化的丝氨酸簇,一般位于K片段之间,或紧跟K片段。高度极性的φ片段的存在增加了极性氨基酸片段的比例,加强了脱水蛋白结构的亲水性。由于K片段和φ片段的存在,脱水蛋白能够通过形成一个保护层而保护变性的高分子,在各种组织中都起到稳定细胞结构的作用[3,4]。
Koag等[5]从玉米(Zea mays)中分离纯化得到DHN1,证实在受到胁迫的植物中,脱水蛋白在稳定液泡和细胞膜的结构中起到非常重要的作用。在水稻(Oryza sativa)中,已报道了多个胁迫诱导的脱水蛋白,其中RAB21/16A,RAB16B,16C,16D,RAB25和 WSI724已经证实是渗透胁迫诱导的[6-9]。此外,LEA 蛋白在植物和酵母中超表达可以提高对渗透胁迫的抵抗力[10-12]。
东方山羊豆(Galega orientalis)作为一种新型优良豆科牧草,在我国主要种植在西北地区。东方山羊豆品质好、产量高、抗病抗逆性强、使用年限长[13],与其他牧草资源相比,东方山羊豆目前的相关研究较少[14]。中国农业科学院北京畜牧兽医研究所牧草资源研究室自2007年以来对引进东方山羊豆的抗逆基因开展了研究,目前已经取得一定进展。李鑫等[15]从东方山羊豆中分离得到液泡膜Na+/H+逆向转运蛋白基因,推测该基因在转录水平的调节可能是决定东方山羊豆耐盐能力的重要因子。Chen等[16]克隆了东方山羊豆的RAV基因,实时荧光定量PCR(real-time PCR)分析表明,GoRAV 基因受外源脱落酸(abscisic acid,ABA)、干旱、低温和盐胁迫诱导,证明该基因在依赖ABA信号途径的抗逆性调控中起到一定的作用。
目前,抗逆基因工程主要集中在逆境条件下表达的某些基因和抗逆代谢过程中某些酶的研究[17]。随着生物技术的发展和广泛应用,克隆植物抗逆相关基因并利用转基因技术将一些与抗性密切相关的外源目的基因导入目标植物中来提高其抗逆性是解决逆境胁迫的一条有效途径[18]。本研究首次从东方山羊豆中克隆DHN基因,初步探索了DHN基因在东方山羊豆抗逆性方面的作用,为深入研究该种牧草的抗逆机理,进行抗逆性改良奠定了一定基础。
1 材料与方法
1.1 实验材料
1.1.1 植物材料 东方山羊豆为中国农业科学院北京畜牧兽医研究所牧草资源研究室提供。
1.1.2 药品与试剂 Trizol试剂为Invitrogen公司产品,cDNA Synthesis Kit为Promega公司产品,SMARTTMRACE cDNA Amplification Kit为 Clontech公司产品,克隆载体pMD18T、Taq酶、限制性内切酶、Alkaline Phosphatase、T4DNA连接酶均为TaKaRa公司产品。
1.2 实验方法
1.2.1 材料的处理与总RNA的提取 于2009年7月开始植物材料的处理,首先将东方山羊豆的种子用氯气消毒24h,播种于铺有滤纸的培养皿中,在光照培养箱(温度为24℃,光照时间为12h/d)中培养至种子发芽。然后将发芽后的种子移至蛭石与珍珠岩比例为3∶1的花盆中继续培养30d。幼苗用0.25mol/L NaCl溶液处理2,6,10h,Trizol法提取总RNA后用于克隆DHN 基因的全长cDNA序列[19]。再用0.25mol/L NaCl溶液、20%PEG(聚乙二醇)溶液、0.1×10-3mol/L ABA溶液分别处理幼苗0,2,4,8,12和24h,分别提取总 RNA,用于 Real-time PCR分析。
1.2.2 DHN 基因3′末端序列、5′末端序列和全长cDNA序列的克隆 用Trizol法分别提取0.25mol/L NaCl溶液处理2,6,10h后的幼叶总RNA后,按照质量比为1∶1∶1混合,用混合RNA为模板反转录成cDNA。根据中国农业科学院北京畜牧兽医研究所牧草资源研究室通过构建SSH cDNA文库得到的DHN基因的EST序列,用Primer Premier 5.0引物设计软件分别设计3′RACE和5′RACE特异性引物,3′RACE:GGTTATGGAACAACTGGGTATGGTGG;5′RACE:CCAGTGCTTCCAGTTCCACCATACCC。根据 SMARTTMRACE cDNA Amplification Kit说明书分别PCR扩增出3′末端和5′末端序列,分别测序后,结合EST序列用DNAMAN 5.0软件拼接出全长cDNA序列,找到开放阅读框ORF,在ORF两端分别设计全长引物,DHN-ORF-F:CAATGTCTCAGTATAATCAAGGTCA;DHN-ORF-R:AGAGATACTATATGATCTAGTGTCCAG。经 PCR 扩增,测序后得到DHN基因全长cDNA序列。
核酸及氨基酸序列分析、开放阅读框ORF的查找和翻译用DNAStar 6.13软件进行分析,利用ScanProsite服务器(http://www.expasy.org/tools/scanprosite/)对 DHN蛋白进行功能预测。从 GeneBank上下载其他植物中的18种DHN蛋白,利用MEGA4软件Neighbor-Joining法构建系统进化树。
1.2.3 Real-time PCR检测DHN基因的组织表达特异性 分别提取东方山羊豆的根、茎、叶总RNA,反转录为cDNA。根据东方山羊豆DHN基因全长cDNA序列设计特异性引物(预期扩增片段大小为270bp),DHNRT-F:GGTCAATACGGTCAACAAACACG;DHN-RT-R:CACCTGTACCTGTCTGGGTTCC。以 Actin 基因做内参,设计特异性引物(预期扩增片段大小为200bp),Actin-RT-F:GGACAAGTTATCACCATCGG;Actin-RT-R:TCAGGAATACCTGGAAACATAG。参考TaKaRa公司的SYBR Premix Ex TaqTM试剂盒说明书,使用 ABI PRISM 7500Real-time PCR System(ABI,USA),采用两步法进行 Real-time PCR扩增,第1步:95℃预变性30s;第2步:95℃5s,60℃34s,40个循环。每个cDNA样品做3次重复。
根据得到的Ct值,利用Kenneth和Thomas[20]报道的2-△△Ct方法,分别计算DHN基因在根、茎、叶中的表达量。把根中表达量设为对照,茎、叶分别设为2个不同处理,利用公式:

分别计算出根、茎、叶的2-△△Ct(表达水平)值,式中,CtTarget为目标基因达到设定阈值所经历的循环数;CtActin为内参基因达到设定阈值所经历的循环数;(CtTarget-CtActin)处理为处理样品中目标基因经Actin校正后的循环数;(CtTarget-CtActin)对照为对照样品中目标基因经Actin校正后的循环数;△△Ct为处理样品中目标基因与对照样品中目标基因循环数的差值。利用Excel绘出柱形图。
1.2.4 Real-time PCR检测DHN 基因在不同逆境胁迫下的表达量 按照1.2.1中用于Real-time PCR分析的材料处理方法处理东方山羊豆幼苗,分别提取叶片总RNA,反转录为cDNA。同1.2.3的方法,进行不同逆境胁迫下的表达量分析。每个cDNA样品做3次重复。
将0h设为对照,2,4,8,12和24h分别设为5个不同处理,按照1.2.3的方法,分别计算出2-△△Ct值,利用Excel绘出柱形图。
1.2.5 构建植物表达载体 设计带有BglII酶切位点的引物,DHN-F:GAAGATCTAATGTCTCAGTATAATCAAGGTC;DHN-R:GAAGATCTGTGTCCAGTACAAGATCCAG。以pMD18T-DHN重组质粒为模板,扩增出带有酶切位点的DHN基因的ORF。用BglII限制性内切酶酶切扩增产物和pCAMBIA1302植物表达载体,对酶切后的p1302载体进行去磷酸化后,用T4DNA连接酶4℃连接过夜,转化大肠杆菌,涂布含有卡那霉素的LB(Luria-Bertani培养基)平板,经抗生素筛选后挑菌,摇菌,抽提质粒,经BglII酶切鉴定为阳性克隆的,送北京三博远志公司测序。
2 结果与分析
2.1 DHN基因全长cDNA的克隆与分析
以东方山羊豆盐胁迫cDNA为模板,分别利用3′RACE和5′RACE特异性引物扩增出3′末端和5′末端片段,其中3′末端片段经测序为397bp(图1A),5′末端片段经测序为813bp(图1B)。利用DNAMAN 5.0软件拼接后的全长cDNA为1 169bp。利用DHN-ORF特异性引物,扩增出全长cDNA的ORF经测序为843bp(图1C)。将该基因命名为GoDHN,NCBI登录号为HM777019。

图1 DHN基因的3′末端片段、5′末端片段和全长ORF扩增结果Fig.1 Amplification results of 3′RACE,5′RACE and full-length ORF of DHNgene

图2 DHN基因的核苷酸序列和氨基酸序列Fig.2 The nucleotide sequence and amino acid sequence of DHNgene
利用DNAStar 6.13软件对DHN基因cDNA序列进行分析,开放阅读框编码281个氨基酸,所编码的蛋白质分子量为28.71kDa。通过ScanProsite服务器对DHN蛋白的氨基酸序列分析,该氨基酸序列包含1个Y片段,3个K片段(图2)。
用MEGA 4软件构建系统进化树(图3),分析结果显示,GoDHN蛋白与豆科植物亲缘关系较近,与禾本科和十字花科等的亲缘关系较远。其中与豌豆PsDHN蛋白亲缘关系最近,其次是大豆GmMAT1和GmDHN5蛋白,均属于YKn亚型,但与豆科植物紫花苜蓿MsCAS15A蛋白和大豆GmSRC1蛋白亲缘关系较远,这2个蛋白属于KnS亚型。
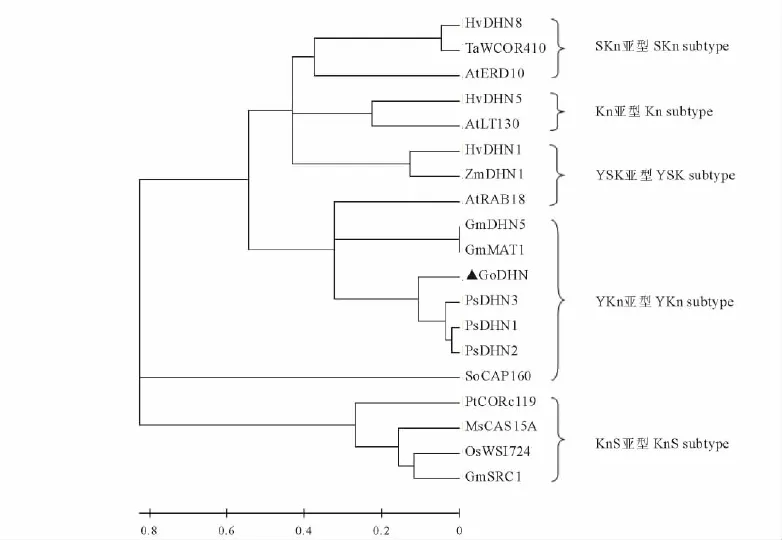
图3 东方山羊豆DHN蛋白与其他植物中18种DHN蛋白的系统进化树Fig.3 The phylogenetic tree of dehydrins in G.orientalis and another eighteen plants
2.2 DHN基因的组织特异性表达分析
根据1.2.3中的公式,计算DHN基因在东方山羊豆不同组织中的相对表达量(图4)。结果表明,GoDHN在根中表达量最少,茎中最多,叶中次之。以东方山羊豆根中DHN基因的表达量为对照,茎中的表达量为根中的6倍,叶中表达量为根中的5.5倍。
2.3 DHN基因在不同逆境胁迫下的表达分析
根据1.2.4中的公式,计算了DHN基因在分别受到ABA、NaCl和PEG胁迫0,2,4,8,12和24 h的相对表达量(图5)。结果显示,DHN基因在ABA胁迫诱导下,4h时表达量达到一个小高峰,然后下降,在24h诱导后表达量猛增到4h表达量的2倍(图5A)。在NaCl的胁迫诱导下,DHN基因的表达量逐步增加,在24h达到最高峰,为对照(0 h)的6 500倍(图5B)。在PEG诱导12h后,DHN基因的表达量达到一个最高峰,为对照(0h)的42 000倍,诱导24h后,表达量相对12h时有所下降,但仍然是对照(0h)的35 000倍(图5C)。
2.4 植物表达载体的构建及鉴定
用BglII限制性内切酶分别酶切带有BglII酶切位点的DHN基因ORF和pCAMBIA1302载体后,经过连接、转化,挑取菌落,抽提质粒,经BglII酶切鉴定,得到与预期大小一致的目的片段(图6)。鉴定为阳性的质粒经测序序列完全正确,表明植物表达载体pCAMBIA1302-DHN构建成功。
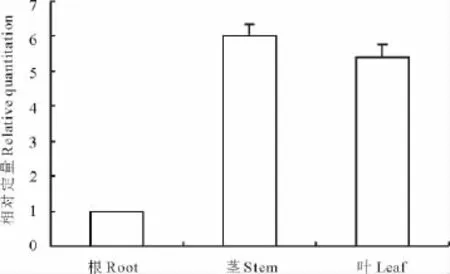
图4 DHN基因在东方山羊豆的不同组织中的相对表达量Fig.4 The relative expression of DHNgene in different tissues of G.orientalis
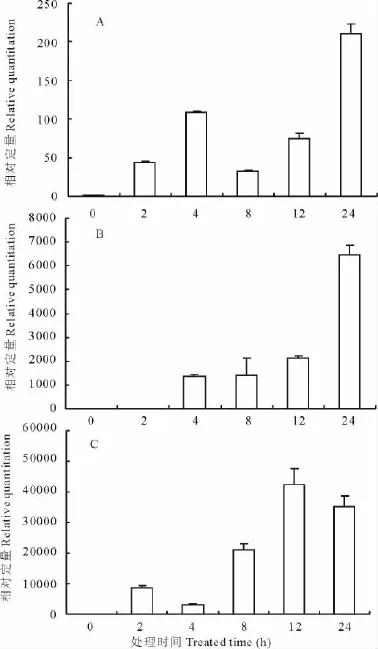
图5 DHN基因在受到ABA、NaCl和PEG诱导后的相对表达量Fig.5 The relative expression of DHNgene induced by ABA,NaCl and PEG
3 讨论
本研究得到的GoDHN基因的氨基酸序列中(图2),在 N末端有一个 Y片段(VDQYGNP),Close[3]认为该片段的存在与DHN基因在植物和细菌中的核定位有关。在该氨基酸序列的中间部位和C末端包含有3个 K片段(EE/D/KKGIMDKIKEKIPG),Soulages等[19]通过二级结构预测证明K片段可能形成α螺旋结构,参与脱水蛋白的亲水或疏水作用。纯化的玉米脱水蛋白G50中15%的氨基酸形成了α螺旋结构,但G50中没有任何疏水位点,却能参与疏水作用,推测K片段形成的α螺旋结构,赋予了G50参与疏水相互作用的潜力[21]。脱水蛋白通过K片段可能参与部分变性蛋白质及膜的疏水相互作用来防止蛋白质和膜进一步变性[19]。在某些植物的脱水蛋白中,如拟南芥(Arabidopsisthaliana)RAB18,还含有一个 S保守片段,S片段是一个可磷酸化的丝氨酸簇,该片段的磷酸化可能也与核定位信号有关,可以参与脱水蛋白的入核过程[3]。
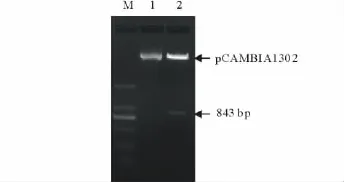
图6 酶切鉴定Fig.6 Indentification of enzyme digestion
通过构建系统进化树(图3),将脱水蛋白分为5类[4]。结果表明,属于同一亚型的脱水蛋白亲缘关系有的近有的远,如GoDHN蛋白与菠菜(Spinacia oleracea)SoCAP160蛋白虽然同属于YKn亚型,但是亲缘关系较远;与豌豆(Pisum sativum)PsDHN蛋白亲缘关系最近,而且同属于YKn亚型。与拟南芥At-RAB18蛋白亲缘关系虽然较近却不属于同一亚型。说明在脱水蛋白的进化过程中,分离较晚的蛋白有可能进化为不同的亚型,而较早分离的蛋白可能源于同一亚型,并且在进化过程中,一直保持不变。
YKn亚型脱水蛋白是一类酸性蛋白,对这一类蛋白的抗性研究主要集中在干旱和冷害环境胁迫下,如大豆(Glycine max)Mat1编码一个Y2K型脱水蛋白,主要由干旱脱水诱导产生,而在ABA诱导下并无明显表达[22]。菠菜CAP160编码一个YK型脱水蛋白,主要受低温诱导,在转基因烟草中的高效表达可以提高其抗寒性[23]。桃树 (Prunus persica)PpDhn1编码一个Y2K2型脱水蛋白,也在低温诱导时大量表达[24]。以上结果表明大部分YK型脱水蛋白在抗旱和耐寒方面可能发挥重要作用。本实验增加了盐胁迫方面的研究,通过模拟逆境处理后(图5),GoDHN基因在NaCl、PEG和ABA胁迫条件下表达均上调,其中NaCl和PEG模拟的盐胁迫和干旱环境,诱导GoDHN基因表达量成千上万倍的提高,暗示GoDHN脱水蛋白与植物的抗盐和抗旱性密切相关。ABA诱导GoDHN基因的表达量虽然低于NaCl和PEG,但是与对照相比仍然提高了200倍,表明外源激素ABA的存在也可以诱导脱水蛋白的表达量上调。
脱水蛋白参与细胞的渗透调节过程,可以提高植物的抗旱和抗盐性[25]。向日葵(Helianthus annuus)脱水蛋白基因HaDhn1和HaDhn2在干旱胁迫下的转录活性显著高于供水条件的转录活性,耐旱品种累积的转录物明显高于敏感品种,并且其累积量与耐旱品种芽细胞膨压的维持和干旱的适应性呈正相关[26]。桦树(Betula platyphylla)脱水蛋白Peudhn1,在未胁迫的植株中仅有少量表达,而在PEG6000和NaCl处理后,该蛋白在根和叶中大量积累,并在复水后持续积累[27]。在模拟盐胁迫下诱导24h后,GoDHN基因的表达量是对照的6 500倍,显著高于对照;在模拟干旱胁迫下诱导12h后,GoDHN基因的表达量是对照的42 000倍,诱导24h后,表达量虽然有所下降,但仍然显著高于对照(图5)。GoDHN可能通过参与细胞内的渗透调节过程,来提高东方山羊豆的抗旱耐盐能力。而高强度的诱导表达可能暗示着东方山羊豆具有非常强的抗旱耐盐能力。
构建植物表达载体是有一定策略的,构建载体时目的基因与载体的连接可分为同源粘末端的连接、平末端的连接、定向克隆、接头连接和同聚物加尾连接等[28]。本研究中,为了消除载体自身连接,采用碱性磷酸酶(alkaline phosphatase,CIAP)对载体进行去磷酸化。最后得到植物表达载体的重组质粒及菌株并通过酶切鉴定,确定连接正确。
目前对脱水蛋白的基因表达、结构和功能的研究已取得了很大的进展,但其具体的分子保护机制大多数只限于推测。例如,在逆境下脱水蛋白具有稳定细胞膜和保护蛋白质的作用虽然已被普遍认同,但其在植物体内具体是怎样发挥作用的并不清楚。尤其是在牧草领域,对于脱水蛋白的研究很少。本实验为进一步研究东方山羊豆脱水蛋白在逆境条件下的表达调控规律和生理生化机制奠定了一定理论基础,也为牧草抗逆性改良提供了候选基因。
[1] Allagulova C R,Gimalov F R,Shakirova F M,et al.The plant dehydrins:Structure and putative functions[J].Biochemistry(Moscow),2003,68(9):945-951.
[2] Dure L III,Crouch M,Harada J,et al.Common amino acid sequence domains among the LEA polypeptides of higher plants[J].Plant Molecular Biology,1989,12:475-486.
[3] Close T J.Dehydrins:emergence of a biochemical role of a family of plant dehydration proteins[J].Physiologia Plantarum,1996,97(4):795-803.
[4] Close T J.Dehydrins:A commonalty in the response of plants to dehydration and low temperature[J].Physiologia Plantarum,1997,100(2):291-296.
[5] Koag M,Fenton R D,Wilkens S,et al.The binding of maize DHN1to lipid vesicles.Gain of structure and lipid specificity[J].Plant Physiology,2003,131:309-316.
[6] Kusano T,Aguan K,Abe M,et al.Nucleotide sequence of a rice rab16homologue gene[J].Plant Molecular Biology,1992,18:127-129.
[7] Mundy J,Chua N H.Abscisic acid and water-stress induce the expression of a novel rice gene[J].Embo Journal,1988,7(8):2279-2286.
[8] Takahashi R,Joshee N,Kitagawa Y.Induction of chilling resistance by water stress,and cDNA sequence analysis and expression of water stress-regulated genes in rice[J].Plant Molecular Biology,1994,26(1):339-352.
[9] Yamaguchi-Shinozaki K,Mundy J,Chua N H.Four tightly linked rab genes are differentially expressed in rice[J].Plant Molecular Biology,1990,14(1):29-39.
[10] Duan X,Wang B,Hong B,et al.Expression of a late embryogenesis abundant protein gene,HVA1,from barely confers tolerance to water deficit and salt stress in transgenic rice[J].Plant Physiology,1996,110:249-257.
[11] Imai R,Chang L,Ohta A,et al.A LEA-class gene of tomato confers salt and freezing tolerance when expressed in Saccharomyces cerevisiae[J].Gene,1996,170(2):243-248.
[12] Zhang L,Ohta A,Takagi M,et al.Expression of plant group 2and group 3lea genes in Saccharomyces cerevisiae revealed functional divergence among LEA proteins[J].Journal of Biochemistry,2000,127(4):611-616.
[13] 张清斌,杨志忠,贾纳提,等.东方山羊豆引种研究初报[J].中国草地,2001,23(4):17-20.
[14] 沈禹颖,张自和,谢田玲.优良豆科牧草——东方山羊豆的研究与利用[J].草业学报,2003,12(6):105-109.
[15] 李鑫,王赞,王学敏,等.东方山羊豆液泡膜Na+/H+逆向转运蛋白基因的克隆与分析[J].植物生理学通讯,2009,45(5):444-448.
[16] Chen X F,Wang Z,Wang X M,et al.Isolation and characterization of GoRAV,a novel gene encoding a RAV-type protein in Galegae orientalis[J].Genes & Genetic Systems,2009,84(2):101-109.
[17] 梁哲,姜三杰,未丽,等.三叶草基因工程研究进展[J].草业学报,2009,18(2):205-211.
[18] 周玲玲,缪建锟,祝建波,等.大叶补血草Na+/H+逆向转运蛋白基因的克隆及序列分析[J].草业学报,2009,18(5):176-183.
[19] Soulages J L,Kim K,Arrese E L.Conformation of a group 2late embryogenesis abundant protein fromsoybean.Evidence of Poly(L-Proline)-typeⅡstructure[J].Plant Physiology,2003,131(3):963-975.
[20] Kenneth J K,Thomas D S.Analysis of relative gene expression data using real-time quantitutive PCR and the 2-ΔΔCtmethod[J].Methods,2001,25:402-408.
[21] Close T J,Kortt A A,Chandler P M.A cDNA-based comparison of dehydration-induced proteins(dehydrins)in barley and corn[J].Plant Molecular Biology,1989,13(1):95-108.
[22] Whitsitt M S,Collins R G,Mullet J E.Modulation of dehydration tolerance in soybean seedlings[J].Plant Physiology,1997,114(3):917-925.
[23] Kaye C,Neven L,Hofig A,et al.Characterization of a gene for spinach CAP160and expression of two spinach cold-acclimation proteins in tobacco[J].Plant Physiology,1998,116(4):1367-1377.
[24] Artlip T S,Callahan A M,Bassett C L,et al.Seasonal expression of a dehydrin gene in sibling deciduous and evergreen genotypes of peach(Prunus persica[L.]Batsch)[J].Plant Molecular Biology,1997,33(1):61-70.
[25] 张玉秀,王梓.脱水蛋白在逆境下的分子作用机制研究进展[J].自然科学进展,2007,17(1):1-10.
[26] Cellier F,Conejero G,Breitler J C,et al.Molecular and physiological responses to water deficit in drought tolerant and drought sensitive lines of sunflower[J].Plant Physiology,1998,116(1):319-328.
[27] Caruso A,Morabito D,Delmotte F,et al.Dehydrin induction during drought and osmotic stress in populus[J].Plant Physiology and Biochemistry,2002,40(12):1033-1042.
[28] 张茹,李金花,柴兆祥,等.Chi基因的克隆及转基因马铃薯植株的获得[J].草业学报,2009,18(6):51-58.
