利用RAPD技术构建四倍体苜蓿遗传连锁图谱
2012-08-20刘曙娜于林清周延林吉仁花陈世茹孙娟娟么婷婷
刘曙娜,于林清,周延林,吉仁花,陈世茹,孙娟娟,么婷婷
(1.内蒙古大学生命科学学院,内蒙古 呼和浩特010021;2.中国农业科学院草原研究所,内蒙古 呼和浩特010010;3.内蒙古农业大学林学院,内蒙古 呼和浩特010019;4.内蒙古农业大学农学院,内蒙古 呼和浩特010019;5.东北师范大学植被生态教育部重点实验室,吉林 长春130024)
苜蓿(Medicago)属豆科多年生草本植物,是世界上分布、栽培面积广,适应性广泛,品质优良的牧草。具有产草量高、品质优良、适口性好的特点,有很高的农业价值和商业价值。由于栽培苜蓿的同源四倍体特性使得其连锁图谱的构建相对困难。目前,公认的已发表四倍体苜蓿连锁图共有3个,Brouwer和Osborn[1]利用2个回交群体各101株个体,以单剂量位点(SDAs)方法将88个RFLP(restriction fragment length polymorphism,限制性内切酶片段长度多态性)标记构成7个连锁群,总遗传距离为443cM,饱和度相对较低。Julier等[2]利用168个F1杂交重组群体构建了遗传距离为2 649cM的父本连锁图谱和遗传距离为3 045cM的母本连锁图谱,同时利用SSR(simple sequence repeat,简单重复序列)标记构建了遗传距离为709cM 的整合图谱。Musical等[3]利用 AFLP(amplified fragment length polymorphism,扩增片段长度多态性)和 RAPD(random amplified polymorphic DNA,随机扩增多态性)标记构建了四倍体苜蓿遗传图谱。Eujayl等[4]于2005年利用来自紫花苜蓿(M.sativa)×黄花苜蓿(M.falcata)的F1回交群体,以EST(expressed sequence tag,表达序列标签)-SSR、SSR(SSR的分子标记代替首例图谱中的88个RFLP)构建了比较饱满的遗传图谱,总遗传距离为624cM。构建苜蓿分子遗传图谱可以进行目的基因的连锁分析、定位重要农艺性状相关基因位点(QTL)及分子标记辅助育种(molecular marker assisted selection,MAS)[5]。由于苜蓿遗传图谱共享机制不完善和我国苜蓿种质资源群体的独特性,构建拥有自主产权的苜蓿遗传图谱成为首要任务。但是,目前国内尚未构建出一套完整的四倍体苜蓿遗传连锁图谱。魏臻武[6]利用SSR、ISSR(inter-simple sequence repeat)和 RAPD技术构建了苜蓿的指纹图谱。
本研究以筛选出的高抗(抗寒——秋眠级为1)黄花苜蓿与高产(每年产量——鲜重6.45kg/m2)[7]紫花苜蓿杂交产生F1代个体,并且由F1代个体自交构建F2群体。对F1的亲本紫花、黄花苜蓿和F2个体DNA样本分别进行RAPD[8]分子标记的遗传作图研究。旨在优化苜蓿分子遗传学实验体系,构建苜蓿遗传连锁框架图,为进一步构建饱和的苜蓿遗传连锁图谱及开展苜蓿分子育种研究奠定基础。
1 材料与方法
1.1 植物材料
2007年选择早期收集的黄花苜蓿与紫花苜蓿的特殊类型遗传材料,包括国内、美国农业部和俄罗斯共计25份材料(均为2代以上选育的四倍体材料)。对所选的18份紫花苜蓿、7份黄花苜蓿进行正、反交产生了大量的F1代。2008年春在中国农业科学院草原研究所呼和浩特市南郊实验场对杂交成功的F1育苗并人工套袋自交,于2009年建立了F2群体。2010年对杂交成功的94个单株杂交子代进行形态与农艺指标的检测。
1.2 DNA提取与纯化
1.2.1 基因组DNA提取 对苜蓿亲本(本研究中均为高产紫花苜蓿、高抗黄花苜蓿)、F1和F2代个体叶片分别进行取样,并存储于-80℃的超低温冰箱中待用。本实验采用植物基因组提取试剂盒(由上海生物工程有限公司提供)进行DNA提取。
1.2.2 基因组DNA检测 紫外分光光度法测定DNA的浓度、纯度,计算样品浓度:DNA浓度(μg/μL)=OD260×N×50/1000[9],式中,OD260为核酸吸光度,N 为样品稀释倍数。
电泳检测DNA:将提取的DNA在0.8%的琼脂糖凝胶(含GoodView核酸染料)上电泳,检测其完整性和片断大小。
1.3 RAPD实验体系
反应在96孔PCR板上进行,总体积为20μL,其中包括模板DNA 1μL(大约20ng);50μmol/L的引物1 μL;2×Taq Master Mix 10μL;ddH2O 8μL。扩增条件为94℃下预变性3min;进入循环,94℃下变性30s;36℃下复性30s;72℃下延伸60s,共40个循环;最后在72℃下延伸10min,结束后于4℃下保存。
扩增结束后,取下样品,在制备好的1.5%琼脂糖胶(含GoodView核酸染料)上点样。在1×TBE电泳缓冲液中电泳,功率为100W。电泳时间为45min。电泳结束后取出胶在UVI凝胶成像系统(英国UVI公司Fire-Reader系列)下观察、拍照记录。
实验用于RAPD的随机引物共192个,购自上海Sangon公司。
1.4 苜蓿RAPD引物筛选
用F1亲本及随机抽取的F2个体的DNA样品筛选在亲本中呈多态性而在子代中呈分离的扩增谱带的引物。
1.5 RAPD扩增作图及数据采集
利用筛选的引物对包括F1的亲本、F1及F2个体共97个样本的DNA进行扩增反应。记录在亲本中存在多态性而在F2代个体中发生分离的谱带,某一谱带出现的个体在该位点的基因型记作“1”;该谱带不出现的个体在该位点的基因型记作“0”;有些带型不易确定连同缺失的个体,一同按缺失数据处理记作“-”。按通用格式将所有数据输入计算机保存成文本文件备用。
1.6 RAPD标记的分离检测、连锁分析与图谱构建
将原始数据文件转换成符合 MAPMAKER 3.0(For PC)作图软件中要求的作图数据文件,然后采用MAPMAKER 3.0软件并结合JionMap 4.0软件在计算机上构建连锁图谱[10]。通过两点连锁分析,计算所有成对座位的重组率和最大LOD值,推测可能的连锁群。根据需要,不同的连锁群可以定义不同的LOD值,以达到最佳的分群效果。然后对每个连锁群中的标记作多点分析,并采用Kosambi函数,将重组率转换成图距单位——厘摩(centimorgan,cM)。分析模型选用自交(F2)类型。经过连锁分析,最后得到连锁框架图。
2 结果与分析
2.1 RAPD引物筛选
用亲本DNA和F2代个体DNA对192个随机引物进行筛选,共获得在亲本中呈多态性,在F2代个体中有分离的随机引物72个,有120个引物(占62.50%)没有检测出多态性标记。引物入选率为37.50%。
2.2 亲本的多态性检测
从随机引物筛选的结果中发现有37.50%的引物揭示了亲本间的遗传多态性,表明两亲本在基因组水平上存在一定的差异。
2.3 RAPD标记分析
用筛选的72个引物对F1双亲、F1及94个F2群体样本DNA进行扩增(图1),共记录了74个RAPD标记的分离。F2中多态分离标记来自母本黄花苜蓿的有29个(占39.19%),来自父本紫花苜蓿的有45个(占60.81%),表明F2群体基本上分别来自双亲的50%,略偏父本。
参与连锁分析的RAPD分子标记共计74个。其中,51个标记位点分别定位在8个连锁群上(表1),覆盖长度为1 261.5cM,平均标记数为6.38个,2个标记间平均图距为24.73cM,另有23个标记未与这8个连锁群连锁。标记位点较多的连锁群为LG1、LG2、LG3和LG8,分别包含18,8,5和5个标记,标记数最少的连锁群只有3个标记。连锁群LG1遗传距离最长,为461.2cM,遗传距离最短的为51.3cM,平均图距最大的连锁群为LG3,间距为38.16cM,平均图距最小的连锁群为LG4,间距为14.23cM。来源于紫花苜蓿的45个多态RAPD标记中有32个标记被分配到8个连锁群上,占43.24%。有13个标记未被连锁到任何一个连锁群上;来源于黄花苜蓿的29个多态RAPD标记中有19个标记被分配到8个连锁群上,占25.68%。有10个标记未被连锁到任何一个连锁群上。
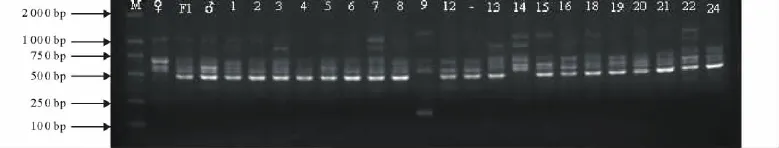
图1 S1013对亲本及个别F2个体DNA电泳图Fig.1 PCR amplification patterns by primer S1013in parents and F2
2.4 连锁分析与图谱构建
通过对每个连锁群中的标记作多点分析,并将重组率转换成图距单位(cM)。经过连锁分析,共得到8条连锁群(图2),其中,每条连锁群左侧给出了2个标记位点间的图距(cM),右侧给出了呈多态性的标记名称。
由于作图软件的局限性和总标记数目太少,本研究所获得的连锁标记不多。随着实验条件的逐步完善,可以预期,随着标记数目的增加,连锁标记会越来越多,遗传图谱越来越密集。
本研究中,定位到图谱上的分离标记共51个,来自于49个RAPD引物(表2)。其中,引物L16、S43均有2个分离标记。
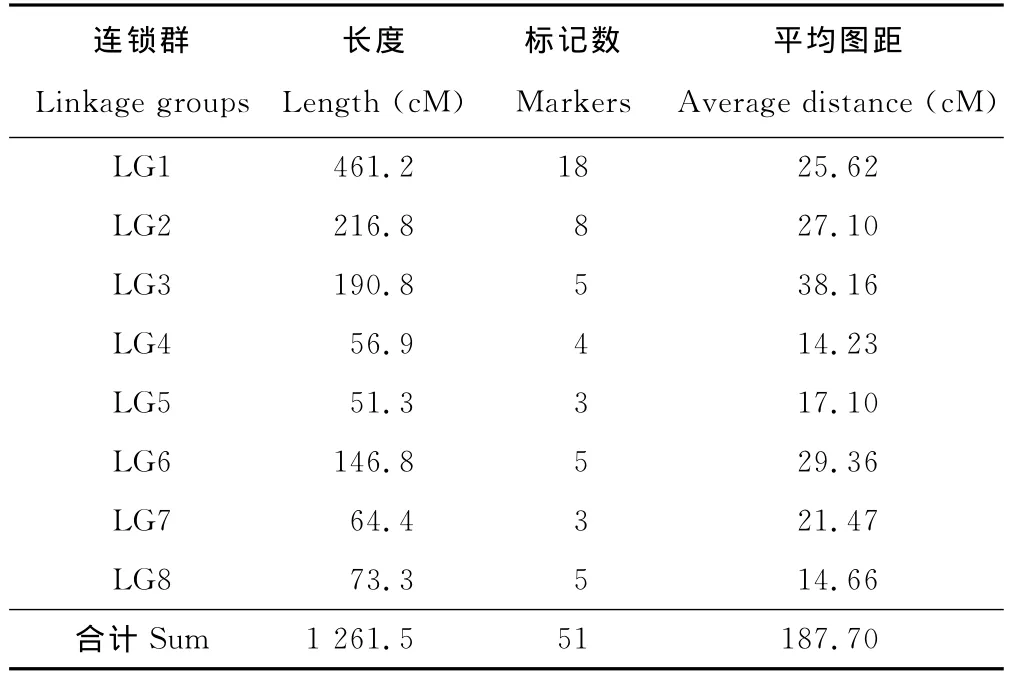
表1 分子标记在各连锁群的分布情况Table 1 Molecular marker in the distribution of a linkage groups
3 讨论
本研究以F2群体作为作图群体,利用RAPD技术构建了四倍体苜蓿的遗传图谱。以期为苜蓿遗传育种工作提供参考与基础材料。
建立一个完善的遗传作图群体直接关系到图谱构建的质量高低。由于苜蓿自身的细胞学特性、遗传研究水平和现有构图技术限制,在短时间内不可能像农作物那样建立高世代作图群体。目前真正比较理想的作图群体比较少,对亲本的一些基本信息还了解不多,在作图中将会带来很多问题[2]。用于苜蓿遗传图谱构建的作图群体,主要有下列几种类型:F2群体、回交群体、F1群体等。在国外,目前公布的3个四倍体苜蓿图谱中的作图群体分别是回交群体(BC1为基础)[1]和F1杂交重组群体[2,4]。在国内,张丽芳[11]以2个差异较大的蒺藜苜蓿亲本W5160和Jemalong进行杂交,获得杂交组合W5160×Jemalong,进而构建了蒺藜苜蓿的F2群体。目前国内还未见关于四倍体栽培苜蓿群体构建的报道,今后有必要加强相关的研究[12]。而在构建遗传图谱中采用的分子标记主要包括RFLP、RAPD、AFLP、STS(sequence tagged sites,序列标志位点)、SSR 等。各种方法均各具优缺点。RAPD技术是建立在PCR基础上的一种可对整个未知序列的基因组进行多态性分析的分子标记技术[13]。相比之下,RAPD技术方法简便、高效、成本低,得到了广泛的应用。目前已被分子遗传学家应用到各个学科、领域,如品种鉴定[14-16]、遗传多样性分析[17-20]、遗传连锁分析和基因定位、分子标记辅助育种[21]等。目前已发表的多个苜蓿图谱由于材料与所选分子标记的不同还不能重合。随着各种遗传标记方法的逐步完善和发展,目前已经进入综合应用各种遗传标记进行基因组研究的新阶段。作图群体的大小直接影响到作图的精度和应用范围。从已发表的图谱来看,大多数所采用的群体样本数在100以内,少数研究者采用300个以上。本研究中采用了94个样本可检测到的重组最小图距为3.2cM,表明在样本数量上可以满足构建连锁框架图的需要。本研究在构建遗传图谱时选择了 MAPMAKER/EXP(3.0)与JionMap 4.0软件来进行分群,MAPMAKER/EXP(3.0)在作物、蔬菜中已被广泛应用,但在牧草中还尚未广泛应用。分群过程中可以根据分群效果选用适宜的LOD值,以期获得最佳分群效果。
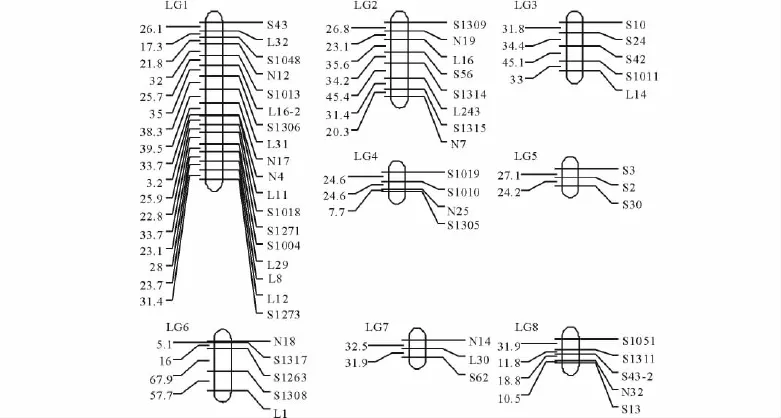
图2 苜蓿连锁框架图Fig.2 RAPD map of tetraploid alfalfa
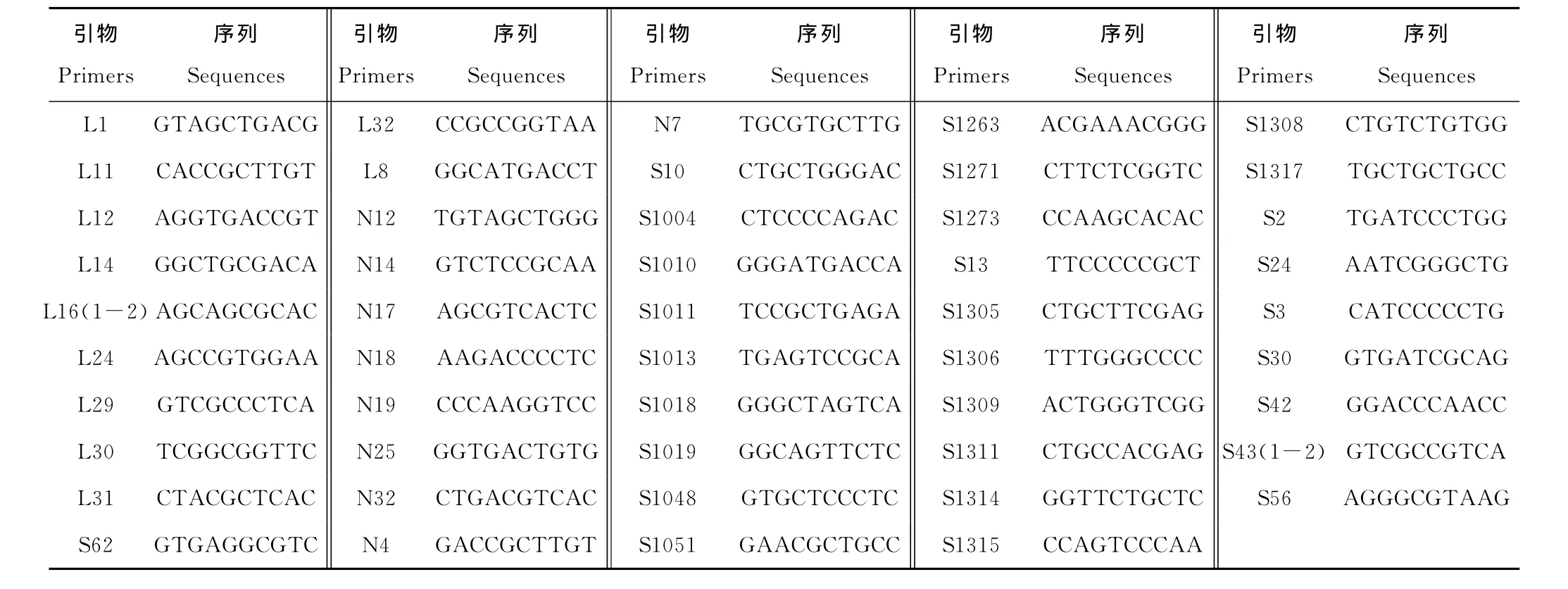
表2 49个RAPD引物序列Table 2 Sequences of 49RAPD primers
由于在过去缺乏对苜蓿经典遗传学和细胞遗传学等方面的研究,目前大多数已构建的遗传连锁图谱仅仅是一个框架图,大都没有和染色体相对应,构建的图谱离应用还有一段距离;因此在今后的一段时间内,在开展分子标记研究的同时必须加强一些基础研究。
[1] Brouwer D J,Osborn T C.A molecular marker linkage map of tetraploid alfalfa(Medicago sativa L.)[J].Theoretical and Applied Genetics,1999,99:1194-1200.
[2] Julier B,Flajoulot S,Barre P.Construction of two genetic linkage maps in cultivated tetraploid alfalfa(Medicago sativa L.)using microsatellite and AFLP markers[J].BMC Plant Biology,2003,3:1-19.
[3] Musical J M,Lowe K F,Mackie J M,et al.DNA maker linked to yield,yield components,and morphological traits in autotetraploid lucerne(Medicago sativa L.)[J].Australian Journal of Agricultural Research,2006,57:801-810.
[4] Eujayl I,Sledge M K,Wang L,et al.Medicago truncatula EST-SSRs reveal cross-species genetic markers for Medicago spp.[J].Theoretical and Applied Genetics,2004,108:414-422.
[5] 王晓娟,孙月华,杨晓莉,等.苜蓿遗传图谱构建及其应用[J].草业学报,2008,17(3):119-127.
[6] 魏臻武.利用SSR、ISSR和RAPD技术构建苜蓿基因组DNA指纹图谱[J].草业学报,2004,13(3):62-67.
[7] 于林清.苜蓿种质资源系统评价与遗传多样性分析[D].呼和浩特:内蒙古农业大学,2009.
[8] Wi1liams J G K,Kubelik A R,Livak K J,et al.DNA poly morphisms amplified by arbitrary primers are useful as genetic markers[J].Nucleic Acids Research,1990,18:6531-6535.
[9] 周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005:4.
[10] 邢光南,赵团结,盖钧镒.关于Mapmaker/Exp遗传作图中标记分群和排序操作技术的讨论[J].作物学报,2008,34(2):217-223.
[11] 张丽芳.蒺藜苜蓿作图群体的构建及其群体遗传分析[D].兰州:甘肃农业大学,2007.
[12] 何庆元,玉永雄.苜蓿作图群体构建研究进展[A].第三届苜蓿发展大会[C].北京:中国畜牧业协会,2010:23-25.
[13] 李惠英,娄燕宏,胡涛,等.中国高羊茅种质资源遗传多样性的RAPD分析[J].草业学报,2010,19(6):208-214.
[14] 林楠,翁频,沈明山.RAPD鉴定远缘杂交牧草蔗新品系94~42[J].厦门大学学报(自然科学版),2003,42(2):238-241.
[15] 高捍东,黄宝龙.板栗主要栽培品种的分子鉴别[J].林业科学,2001,37(1):64-71.
[16] Echt C S,Kidwell K K,Knapp S J,et al.Linkage mapping in diploid alfalfa(Medicago sativa)[J].Genome,1994,37:61-71.
[17] Chrochemore M L,Huyghe C,Ecalle C,et al.Structuration of alfalfa genetic diversity using agronomic and morphological characteristic-Relationship with RAPD markers[J].Agronomie,1998,18:79-94.
[18] 李拥军,苏加楷.苜蓿地方品种遗传多样性的研究:RAPD标记[J].草地学报,1998,6(2):105-114.
[19] 魏臻武,符昕,耿小丽,等.苜蓿遗传多样性和亲缘关系的SSR和ISSR分析[J].草地学报,2007,15(2):118-123.
[20] 梁慧敏.不同居群狗牙根RAPD分析[J].草业学报,2010,19(1):258-262.
[21] 孟亚雄,仲军,马小乐,等.甘肃省小麦条锈病主要流行小种的RAPD分析及Sull-4小种SCAR标记建立[J].草业学报,2010,19(6):180-186.
