苏打碱胁迫对多年生黑麦草的生理影响
2012-08-20郭慧娟胡涛傅金民
郭慧娟,胡涛,傅金民
(中国科学院武汉植物园植物种质创新与特色农业重点实验室,湖北 武汉430074)
土地盐碱化已成为世界性的环境问题。一般在气候干燥的半干旱、干旱地区由于降水量少而蒸发强烈,盐分不断积累于地表;而在农业生产中,长期不合理的施用化肥及用污水灌溉都会造成土壤盐渍化。由于环境变化和土地的不良使用,使得土地盐碱化趋势加剧[1]。据报道,全世界约有4亿公顷的盐渍土,约占灌溉农用地的1/3,在中国6.7×107hm2耕地中就有10%的盐渍化土壤。盐碱胁迫是影响植物生长发育,导致产量和品质下降的主要非生物逆境因素[2]。土壤中的致害盐类除了以NaCl为主的中性盐以外,还有以Na2CO3和NaHCO3为主的碱性盐,目前我国内陆盐碱地苏打盐碱土占的比重也越来越大[3],由于上述碱性盐的存在,这类土壤的pH可以高达9以上。正常情况下,植物在生命活动中产生的活性氧自由基存在着产生和消除的动态平衡。环境胁迫引起的渗透胁迫和离子毒害使植物细胞的叶绿体和线粒体在电子传递中的电子数量增加,活性氧产生与清除的动态平衡遭到破坏[4,5],超氧阴离子和H2O2等活性氧的积累诱发膜脂过氧化,使膜透性增加,从而导致膜系统的氧化和细胞伤害,给植物体造成严重的损伤[6],使植株的光和作用下降,产量降低[7]。活性氧清除系统由酶系统和非酶系统组成。超氧化物歧化酶 (superoxide dismutase,SOD)与过氧化氢酶(catalase,CAT)、过氧化物酶(peroxydase,POD)以及B2胡萝卜素等物质协同作用,可防御活性氧或其他过氧化物自由基对细胞膜系统的伤害。碱胁迫条件下,它们作为氧自由基的清除者,可以减轻逆境对植物细胞的伤害[8]。
迄今为止有关植物抗盐生理的研究仍然以NaC1为主要对象的盐胁迫为主,而自然生境对植物的危害不单有盐胁迫,同时也有碱胁迫,尤其是以Na2CO3和NaHCO3为主的苏打碱对植物的危害较大。盐碱胁迫是植物生长最主要也是最常见的非生物胁迫之一,对于大多数生长在盐碱土生境中的植物来说,它们不仅要遭受Na+毒害,还要忍受高水平pH对生长的影响。本研究选择多年生黑麦草(Lolium perenne)作为研究对象,它是一种重要的禾本科牧草和草坪草,喜温湿、耐瘠薄、耐盐碱,在新平整的生土或新开垦的盐荒地上均可生长,广泛分布于温带地区。作为牧草,黑麦草的草质优良,产量高,叶量丰富,茎叶柔嫩,适口性好,是马、牛、羊、兔草食家畜的优质牧草;也是养鱼的好饲料。做为草坪草,黑麦草具有建坪速度快、覆盖能力和抗病虫害能力以及分蘖能力强等特性。因此多年生黑麦草是一种理想的研究材料[9]。对于多年生黑麦草的碱胁迫效应,国内外极少报道。本试验从多年生黑麦草的生长状况及其光合色素含量和抗氧化作用方面探讨苏打碱对其的胁迫效应,以探讨多年生黑麦草碱胁迫的适应机制,并揭示其耐碱的可能机理,为进一步利用盐碱地(主要是碱土)种植黑麦草提供理论依据。
1 材料与方法
1.1 实验材料
实验于2010年7月7日-8月24日在中国科学院武汉植物园进行,多年生黑麦草quickstarⅡ的种子由中国科学院武汉植物园草坪种质资源学科实验室提供。黑麦草种子在装有沙子的一次性水杯中萌发,每天用半剂量Hoagland营养液少量多次的浇灌,并保证上半层沙子处于湿润的状态,约50d后将幼苗转移到300mL三角瓶中,用半剂量的Hoagland营养液完全水培,培养7d后可进行碱胁迫实验。为防止藻类植物在水培液中生长,三角瓶外面用锡箔纸包裹。
1.2 方法
本实验设置5个不同pH梯度的苏打碱处理液,即去离子水pH=6.5(对照)、pH=8.2、pH=9.1、pH=9.9、pH=10.9。分别配置0.1mol/L的 Na2CO3和0.1mol/L的 NaHCO3溶液,并将上述溶液按照0∶0,0∶10,1∶9,5∶5,9∶1的比例配成相应pH值处理液,每个处理4次重复,温度控制在19~21℃,光照时间为14 h/10h(昼/夜)。处理4d后,分别测定和计算各处理的相对蒸腾速率、含水量、株高、根长、根冠比、叶绿素含量等生长状况指标以及抗氧化酶的活性。
1.2.1 相对蒸腾速率的测定 蒸腾速率是一个与植物的生长密切相关,并且比较容易和快速得到的指标。每隔24h将密封好的三角瓶称重并记录数据,将前一天的数据减去当天的数据得出来的差值就是这24h之内的绝对蒸腾速率。为了纠正正常生长的幼苗长得越快,蒸腾量越大的错误观点,通过计算可以得出相对蒸腾速率(normalized relative transpiration,NRT)。
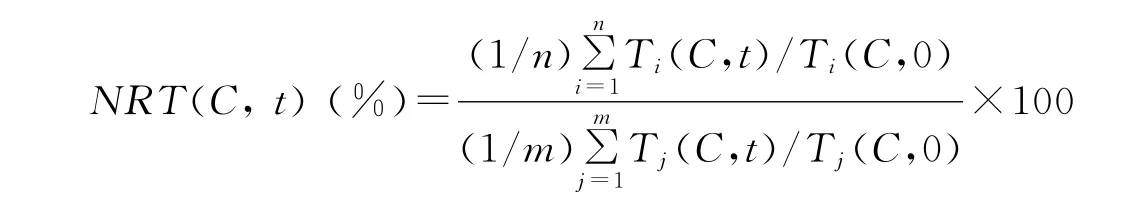
式中,T代表多年生黑麦草幼苗的绝对蒸腾速率(g/h),t代表时间段(0~24h,24~48h,…),C代表溶液浓度(g/L),i代表实验的重复1,2,...,n,j代表对照组实验重复1,2,...,m。
1.2.2 含水量、株高、根长和根冠比的测定 处理结束后,将多年生黑麦草幼苗冲洗干净,并把多余的水吸干,分别用直尺测量一下植株的株高和根长,并记录数据,根冠比用植株的根长比株高得出的商值。然后称量植株的总鲜重,再将叶和根分开,并分别称量鲜重。然后用牛皮纸袋将鲜样包好,于烘箱中110℃杀青30min,后在70℃烘干至恒重并进行干物质重测定。含水量的计算公式为
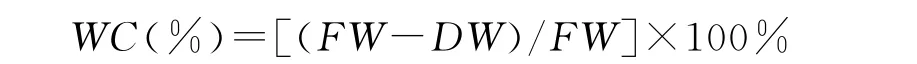
式中,FW为叶和根的鲜重,DW为干物质重。
1.2.3 叶绿素的提取 取处理后的完全展开功能叶片0.1g,放入含10mL二甲亚砜(DMSO)的离心管中,暗中放置2~3d(至叶子失绿),每天混匀1次。吸取1mL萃取液于离心管中,加入DMSO 2mL,混匀。以DMSO为空白对照,使用分光光度计测定OD663、OD645值。并按下式计算叶绿素a和叶绿素b的含量。
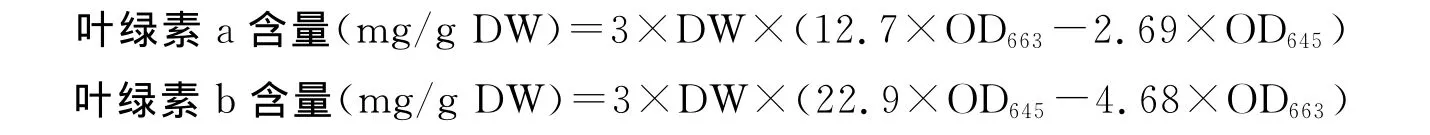
1.2.4 粗酶液的提取 称取0.3g完全展开功能叶片,将叶片置于预冷的研钵中,加入液氮迅速研磨成粉末状,加入4mL 4℃预冷的150mmol/L、pH 7.0的磷酸缓冲溶液(PBS),将匀浆转入10mL离心管中,12 000r/min、4℃离心20min,上清液即为粗酶提取液。
1.2.5 可溶性蛋白含量的测定 参照 Bradford[10]的方法。取0.03mL粗酶液加0.07mL 150mmol/L、pH 7.0的磷酸缓冲溶液,加入Brandford染液(0.01%考马斯亮蓝、4.7%乙醇、8.5%磷酸,用锡箔纸包好避光)后充分振荡,用分光光度计测量OD595,通过由牛血清蛋白溶液绘出的标准曲线,计算出可溶性蛋白含量。
1.2.6 丙二醛(MDA)含量的测定 参照Zhang和 Kirkham[11]的方法。称取100g TCA(三氯乙酸)、2.5g TBA(硫代巴比妥酸),加双蒸水定容至500mL作为反应液。取1mL粗酶液加入到2mL反应液中,混合液在95℃水浴30min后迅速冷却至室温,振荡离心管以消除气泡,在12 000r/min、20℃离心10min,取上清液,以反应液为空白测定OD532、OD600。
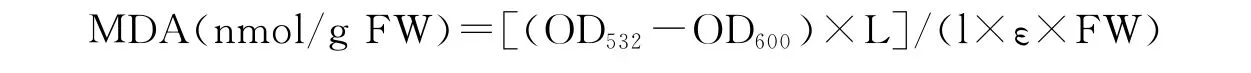
式中,L为提取液体积(mL);l为比色杯厚度(cm);ε为摩尔吸光系数(155L/mmol·cm);FW为样品鲜重。
1.2.7 超氧化物歧化酶(SOD)活性测定 参照 Giannopolitis和 Ries[8]的方法。用双蒸水配制1.125mmol/L氮蓝四唑(NBT)、195mmol/L甲硫氨酸(Met)、0.06mmol/L核黄素、3μmol/L EDTA-Na2溶液。将0.1mL粗酶液与2.2mL pH 7.8的磷酸缓冲液、0.2mL Met溶液、0.2mL NBT 溶液、0.1mL EDTA-Na2溶液、0.2 mL核黄素溶液,以不加粗酶液和NBT溶液的混合液为空白对照,以不加粗酶液的混合液为处理对照,摇匀后将装有混合液的透明玻璃烧杯置于4 000lx荧光灯下显色反应60min,要求各烧杯照光一致,另将一支对照管置于暗中,反应温度控制在25~35℃。反应结束后用黑布遮盖试管终止反应,以暗中对照管作空白调0,测定波长560nm下的吸光度。以抑制光下对照管NBT光还原反应50%的酶量作为1个SOD活性单位。
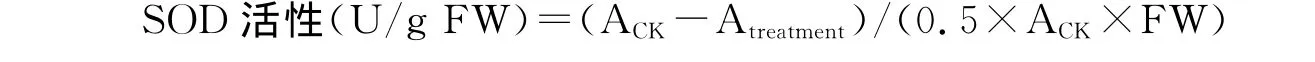
式中,ACK为空白对照在560nm下的吸光度;Atreatment为处理样品在560nm的吸光度;FW为样品鲜重。
1.2.8 过氧化物酶(POD)活性的测定 参照Chance和 Maehly[12]的方法。用50%的乙醇配置0.25%的愈创木酚,用双蒸水配置0.75%的 H2O2溶液、0.1mol/L pH 5.0的醋酸缓冲溶液。取0.05mL粗酶液与1mL愈创木酚溶液、1.85mL醋酸缓冲溶液、0.1mL H2O2混合于离心管中,充分摇匀;以不加酶液管调0,测定波长460nm下的吸光度,于3min内每隔1min读数1次。以1min内A460增加1为1个酶活性单位(U)。
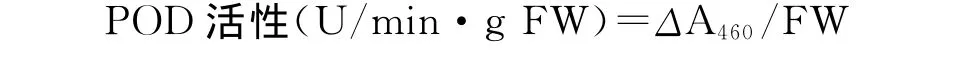
式中,ΔA460为反应时间内样品在460nm下吸光度的变化;FW为样品鲜重。
1.2.9 过氧化氢酶(CAT)活性的测定 参照 Wang和 Huang[13]的方法。取0.1mL粗酶液加1.9mL 50 mmol/L、pH 7.4的磷酸缓冲溶液,1mL 45mmol/L H2O2溶液,充分振荡,测量波长240nm下的吸光度,3min内每镉1min读数1次。以1min内A240降低0.01为1个酶活性单位(U)。
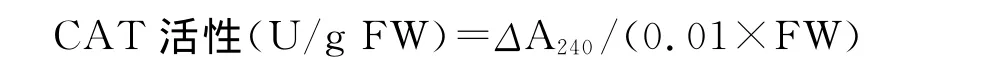
式中,ΔA240为反应时间内样品在240nm下吸光度的变化;FW为样品鲜重。
1.3 数据分析
实验数据用SPSS 17.0软件进行单因素方差分析(ANOVA),以及平均数LSD多重比较检验,差异显著水平为0.05。
2 结果与分析
2.1 盐碱胁迫对多年生黑麦草生长状况和植株含水量的影响
从外观上看,多年生黑麦草的生长受到了严重的抑制。首先,和对照相比,植株的地上部有不同程度的萎蔫失水,叶片皱缩,失绿发黄等,而且根部也出现了缩短、发黑和溃烂的现象,这一系列反应就是人们俗称的“烧苗”。遭受盐碱胁迫的幼苗株高比对照的矮,差异显著,但是随着pH的升高,株高的下降并不明显(表1);与对照相比,根长都显著降低,处理pH=8.2、pH=9.1和pH=9.9之间差异显著,而当pH=10.9时,根长和pH=9.9处理的根长相等;当pH=8.2和pH=9.1时,植株的根冠比与对照相比出现了显著的增大,而其他处理的根冠比与对照无显著差异。
含水量是直接反映盐胁迫对植物造成渗透胁迫大小的指标。植物体内必须维持一定的含水量才能进行各种代谢反应和保持正常生长状态,进行光合作用,维持正常生长发育。不同pH值的盐碱胁迫下,黑麦草幼苗叶片的含水量均显著下降(表1)。但当pH达到9.9,叶片含水量为42.6%,随着pH的增大,叶片含水量下降不显著。对于植株的地下部——根而言,随着pH的增加,含水量的下降幅度较小,pH=8.2时,根的含水量下降的幅度并不显著。而当pH>9.1时,根系含水量显著下降,但是各处理之间的差异并不显著。
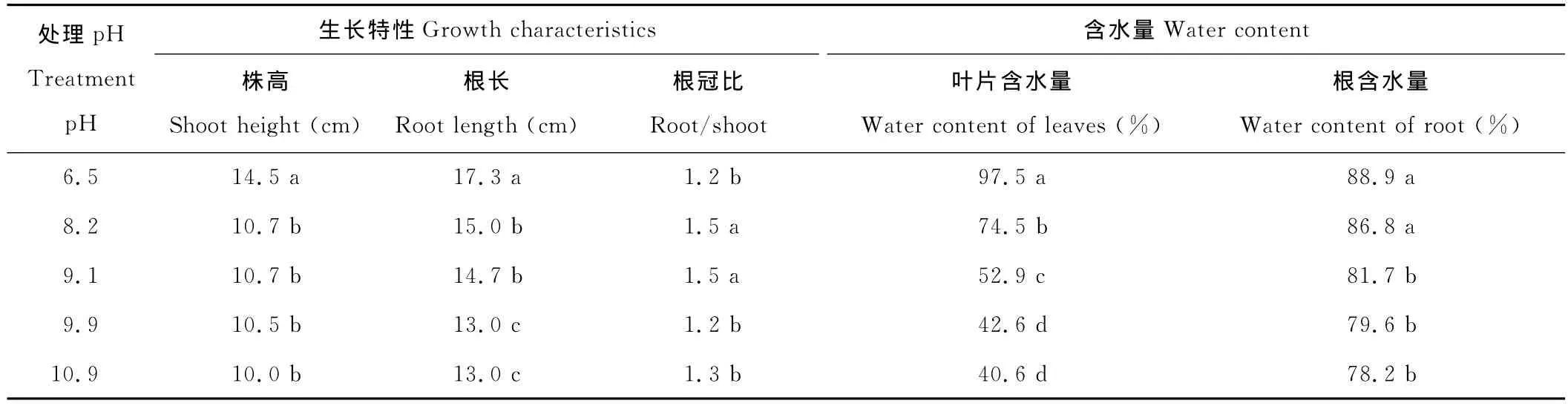
表1 pH值对多年生黑麦草株高、根长、根冠比以及植株含水量的影响Table 1 Effects of pH on the shoot height,root length,the ratio of root to shoot and the water content of ryegrass seedlings
2.2 盐碱胁迫对多年生黑麦草幼苗相对蒸腾速率的影响
蒸腾作用是植株吸收水分的主要动力之一。蒸腾速率直接反应了植株生物量的积累情况。各处理组初始的蒸腾速率都是100%,随着盐碱胁迫处理天数的增加,植株的蒸腾速率出现了急剧地下降,且随着pH的增加,相对蒸腾速率的下降幅度愈大,且各处理组之间有显著地差异(图1)。
2.3 盐碱胁迫对叶片叶绿素含量的影响
叶绿素作为重要的光合色素分子,参与光能的吸收、传递和转化,在光合作用中占有重要地位。植物受到逆境胁迫时,各种生理过程都会受到影响,从而直接或间接地影响到其含量[14]。由于各处理的黑麦草幼苗的叶片出现了很大程度的失水现象,所以数据处理时叶绿素的含量按各处理叶片含水量的大小换算成干重后得来。
与对照相比,各处理的叶绿素a(Chl a)含量显著降低。当pH=9.1,pH=9.9和pH=10.9时,叶片叶绿素b(Chl b)的含量也有显著降低。各处理的叶绿素总量(Chl a+b)显著低于对照的2.0mg/g DW,而后3组处理之间的差异并不显著(表2)。
2.4 盐碱胁迫对抗氧化酶活性和可溶性蛋白含量及丙二醛含量的影响
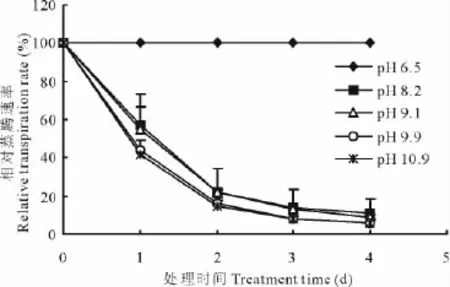
图1 pH值对多年生黑麦草幼苗相对蒸腾速率的影响Fig.1 Effects of pH on the relative transpiration rate of ryegrass seedlings
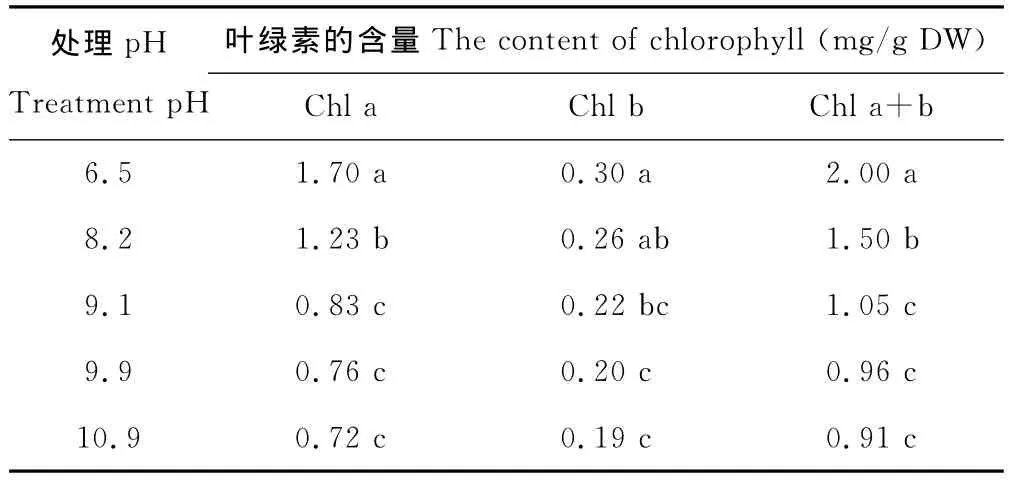
表2 不同pH值下苏打盐碱胁迫对多年生黑麦草幼苗叶绿素含量的影响Table 2 Effects of pH on the content of chlorophyll of ryegrass seedlings
2 4.1 对叶片SOD活性的影响 SOD是植物抗氧化系统的第一道防线,能清除细胞中多余的超氧根阴离子,其活性的高低变化反映了植物对氧化损伤的修复能力[15]。随着碱胁迫pH的递增,SOD的活性呈先上升后下降的现象,当pH<9.1时,SOD的活性逐步升高,当pH=9.1时SOD的活性最高,但与对照差异不显著。当pH>9.1时,SOD的活性又开始下降,当pH=9.9时,基本与对照相等,pH=10.9时,SOD的活性只有5.4U/mg蛋白,与对照相比显著降低(表3)。
2.4.2 对叶片CAT活性的影响 CAT主要分布于过氧化物酶体中,能有效地降低植物体内的过氧化氢对细胞的氧化作用[16]。因此,植物体内存在CAT是其保护自身免受活性氧自由基毒害的关键因素之一。当pH=8.2时,CAT的活性与对照相比虽然有所降低,但是差异并不显著。随着pH的逐步升高,CAT的活性呈现逐步递减的趋势。在pH 8.2~9.1,CAT活性出现了急剧下降,但是差异并不显著;pH=9.9的处理与对照相比,CAT的活性有显著降低,但与pH=9.1和pH=10.9两组处理相比,差异都不显著(表3)。
2.4.3 对叶片POD活性的影响 POD可清除植物体内SOD催化反应的产物H2O2,从而使需氧生物体免受H2O2的毒害[14]。当pH=8.2时,POD活性与对照相比虽然有所升高,但是差异并不显著,其他3组处理与对照组相比都显著升高。随着pH的升高,POD的活性逐渐升高,但是pH=8.2和pH=9.1两组之间的差异不显著,pH=9.1和pH=9.9之间的差异也不显著。最终POD活性增加慢慢趋于平缓以至于不再增加,pH=9.9和pH=10.9两组的POD活性相等(表3)。
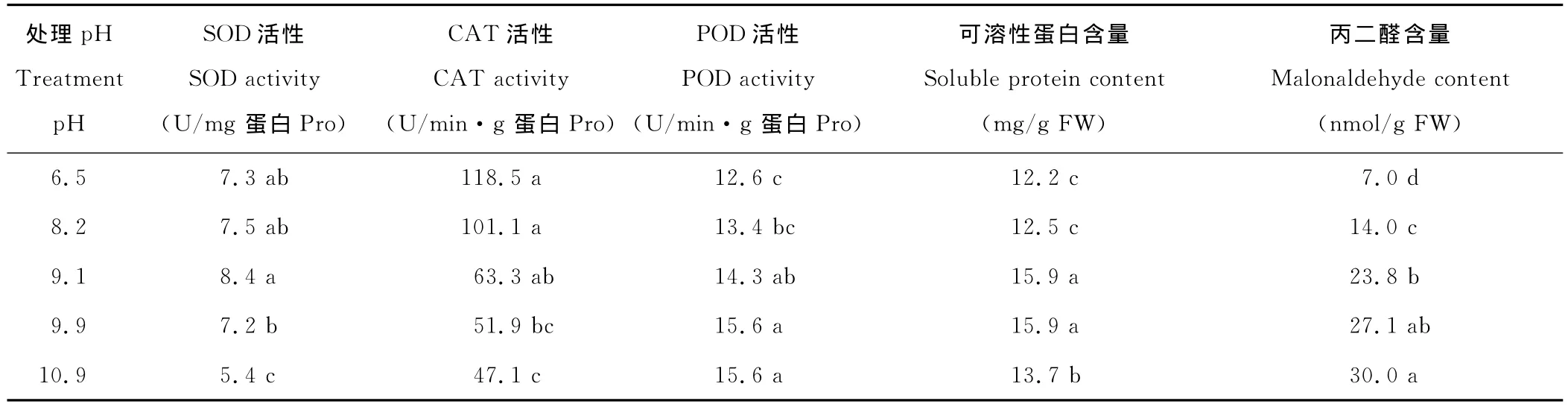
表3 pH值对多年生黑麦草叶片中抗氧化酶活性、可溶性蛋白含量和丙二醛含量的影响Fig.3 Effects of pH on the activities of SOD,POD,CAT,the contents of soluble protein and malonaldehyde in the leaves of ryegrass seedlings
2.4.4 对叶片中可溶性蛋白含量的影响 植物体内的可溶性蛋白质大多数是参与各种代谢的酶类,其含量是了解植物体总代谢水平的一个重要指标[17]。植物体可以通过增加可溶性蛋白的含量,提高渗透调节能力,增强对盐碱胁迫的适应能力[18];高含量的可溶性蛋白可帮助维持植物细胞较低的渗透势,抵抗水分胁迫导致的伤害,抗旱性强的植物种或品种的可溶性蛋白含量较高[19]。随着pH的升高,黑麦草叶片中的可溶性蛋白含量呈现先上升后下降的趋势。当pH≤9.9时,可溶性蛋白的含量逐渐升高至稳定,但是随着碱胁迫程度的进一步加深,可溶性蛋白的含量又显著下降(表3)。
2.4.5 对叶片中MDA含量的影响 正常生长条件下,植物体内活性氧的产生和清除之间保持着一种动态平衡,当植物遭受胁迫时,这种平衡就被破坏,首先影响的是生物膜[20]。往往发生膜脂过氧化作用,丙二醛(malonaldehyde,MDA)是膜脂过氧化作用的主要产物之一,其含量与细胞膜系统的伤害程度密切相关[21]。MDA的含量愈高,脂质过氧化作用愈强。随着pH的升高,盐碱胁迫都可以造成黑麦草细胞中MDA含量的逐步增加。在pH 8.2~9.1时,MDA含量的增长幅度较大,而后,增加又相对平缓(表3)。
3 讨论
3.1 盐碱胁迫对多年生黑麦草生长发育的影响
在苏打碱胁迫下,多年生黑麦草的发育明显迟缓。生长抑制是植物响应盐渍生境最敏感的生理过程,当植物被转移到盐碱逆境中几分钟后,生长速度即有所下降。首先,在碱胁迫下,多年生黑麦草幼苗的相对蒸腾速率的降低,表明植株在生长期全部的生命活动受到了抑制,根系吸水与冠部蒸腾之间的平衡被打破,进而植株体内的各种代谢循环以及物质和能量的传递和转换受到了严重影响,生物量的积累自然而然地下降。直接从外观上看,植株萎蔫失水严重,植物叶片含水量的变化一定程度上反应了植株的耐盐能力和保水能力,含水量变化越小,其保水能力和耐盐能力越强[22]。从实验数据中可以得出,黑麦草幼苗的地上部和地下部的含水量都显著的下降。而且,根和茎长度都有显著的降低,且根冠比随着溶液pH的升高先增后减,反映出碱胁迫对根生长的抑制程度明显大于对茎生长的抑制程度,表明根对生境周围的pH值的变化更加敏感。
3.2 盐碱胁迫对多年生黑麦草幼苗光合作用的抑制
叶绿素是决定植物光合能力的关键指标,其含量的变化可以反映出光合生产的变化和胁迫因子对植物的作用程度。杨福等[23]在水稻(Oryza sativa)上发现非盐碱土和苏打盐碱土中生长的水稻剑叶光合作用日变化的趋势,显示盐碱胁迫使每个时间点的净光合速率、气孔导度和细胞间二氧化碳浓度显著降低,亦表明同一光强下,苏打盐碱胁迫是导致植物光合作用下降的主要原因。随着胁迫强度的增大,作为多年生黑麦草捕获光能、驱使光合固碳的主要物质——叶绿素含量下降(表2)。在正常条件下,叶绿素与叶绿体蛋白结合的松紧取决于细胞内离子含量。这在苏打碱胁迫条件下,黑麦草体内的Na+/K+升高[24],多余的钠离子使叶绿素与叶绿体蛋白结合变松,更多的叶绿素遭到破坏,导致光合作用降低[25],而影响黑麦草的生长。此外,还可能因为胁迫强度的进一步增加,叶片叶绿体数目逐渐减少,类囊体松散扭曲、破裂并逐渐解体,所以导致叶绿素含量下降[26]。叶绿素含量的降低阻碍了叶片对碳的吸收和固定,而作为骨架元素碳的减少,又使黑麦草的生物量降低。
3.3 盐碱胁迫对多年生黑麦草幼苗生理生化反应的影响
因盐胁迫对一系列代谢活性的渗透方面的影响,最终导致缺水,这种缺水会导致氧化胁迫。活性氧做为高渗透和离子胁迫的副产物,能够导致膜功能的丧失和细胞死亡[27]。MDA是膜脂过氧化作用的产物之一,它可与膜蛋白结合引起蛋白质分子内和分子间交联,蛋白质分子发生聚合,类囊体膨胀变形、排列顺序改变,造成基粒消失等叶绿体超微结构变化[28]。MDA还能使膜透性增大,又可与细胞内的各种成分发生反应,使膜系统中多种酶的生理功能严重损伤,因此,可用MDA含量来代表植物膜脂过氧化的水平,反映植物受伤害的程度。活性氧自由基的过量积累直接导致膜脂过氧化,SOD、POD、CAT都可清除细胞内活性氧自由基,也有研究发现超氧化物歧化酶是生物体内最重要的保护酶[29,30]。本研究表明,MDA的含量在pH=8.2时已经有了显著的增加,表明此环境下活性氧离子的积累较多。随着胁迫程度的增强,MDA的含量也随着增加。一方面,为了清除多余的活性氧,植株的抗氧化酶系统发生改变致力于维持活性氧的代谢平衡。SOD和POD活性的升高,可以高效地去除细胞内的一些自由基。另一方面,随着pH的升高和胁迫时间的延长能够诱导活性氧过多积累,生物体内活性氧的大量积累会造成细胞代谢紊乱,细胞质膜严重受损,植株体内MDA水平越来越高,抗氧化酶系统继续被激活,试图通过抗氧化酶活性的升高来清除过多的自由基,但是当自由基积累到一定的量后,膜脂严重受损,机体内许多蛋白合成受阻,SOD的基因表达也受到影响,SOD活性开始降低[31]。
干旱、盐碱、低温等外界逆境因子实质上是一种体外信号,当植物感知体外信号后,可以引发一系列的体内信号,进而诱导相关基因表达调控的改变。在长期进化过程中,植物拥有完整的信号网络用以调节各种环境胁迫引起的响应。所以,黑麦草对苏打碱胁迫的适应性应是一个非常复杂的动态生理生化过程,其生长指标的变化和生理反应的变化等都是紧密联系在一起的,是综合性的反应,其确切的耐盐碱机理还有待进一步的研究。而且黑麦草是一种多年生牧草,它的耐碱能力可以逐渐训练出来。本实验只是从生长和生理指标方面探讨了苏打碱对黑麦草幼苗的影响,还应进一步探讨盐碱对黑麦草不同生长时期的生理影响。
[1] 王学文,蔺彩虹,李小峰,等.NaHCO3胁迫对大叶紫花苜蓿生理特征的影响[J].草业科学,2007,24(2):26-29.
[2] Zhu J K.Plant salt tolerance[J].Trends Plants Science,2001,6(2):66-71.
[3] 元曲刚,赵可夫.氯化钠和碳酸钠对玉米生长和生理胁迫效应的比较研究[J].作物学报,2004,30(4):334-341.
[4] Shalata A,Tal M.The effect of salt stress on lipid peroxidation and antioxidants in the leaf of the cultivated tomato and its wild salt-tolerant relative Lycopersicon pennellii[J].Physiology Plant,1998,104(2):169-174.
[5] Sreenivasulu N,Grimm B,Wobus U,et al.Differential response of antioxidants to salinity stress in salt-tolerant and salt-sensitive seedlings of foxtail millet(Setariaitalica)[J].Physiology Plant,2000,109(4):435-442.
[6] Asish K P,Anath B D.Salt tolerance and salinity effects on plants[J].Eco-toxicology and Environmental Safety,2005,60(3):324-349.
[7] 刘友良,汪良驹.植物对盐胁迫的反应和耐盐性[A].见:余叔文,汤章城.植物生理和分子生物学[M].北京:科学出版社,1998:752-769.
[8] Giannopolitis C N,Ries S K.Superoxide dismutase:I.Occurrence in higher plants[J].Plant Physiology,1977,59(2):309-314.
[9] 张振霞,刘萍,杨中.25个多年生黑麦草品种萌发期对盐胁迫的抗性研究[J].草业科学,2007,24(2):14-18.
[10] Bradford M M.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye Binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[11] Zhang J X,Kirkham M B.Drought-stress-induced changes in activities of superoxide dismutase,catalase,and peroxidase in wheat species[J].Plant Cell Physiology,1994,35(5):785-791.
[12] Chance B,Maehly A C.Assay of catalase and peroxidase[A].In:Colowick S P,Kaplan N O.Methods in Enzymology[M].New York:Academic Press,1955:764-775.
[13] Wang Z L,Huang B R.Physiological recovery of Kentucky bluegrass from simultaneous drought and heat stress[J].Crop Science,2004,44(5):1729-1736.
[14] 吴成龙,尹金来,徐阳春,等.碱胁迫对菊芋幼苗生长及其光和作用和抗氧化作用的影响[J].西北植物学报,2006,26(3):447-454.
[15] 张敏,王较常,严蔚东,等.盐胁迫下转Bt基因棉的K+、Na+转运及SOD活性的变化[J].土壤学报,2005,42(3):460-467.
[16] 刘琛,丁能飞,傅庆林,等.盐胁迫对3种蔬菜幼苗抗氧化酶活性的影响[J].安徽农业学报,2010,38(1):115-116.
[17] 刘惠芬,高玉葆,张强,等.不同种群羊草幼苗对土壤干旱胁迫的生理生态适应[J].南开大学学报(自然科学版),2004,12(4):105-110.
[18] 谭巍巍,李凤山,张玉霞,等.氯化钠和碳酸钠对芦笋的胁迫效应比较[J].中国农学通报,2006,22(7):322-325.
[19] 罗群,唐自慧,李路娥,等.干旱胁迫对9种菊科杂草可溶性蛋白质的影响[J].四川师范大学学报:自然科学版,2006,29(3):356-359.
[20] 冯建永,庞民好,张金林,等.复杂盐碱对黄顶菊种子萌发和幼苗生长的影响及机理初探[J].草业学报,2010,19(5):77-86.
[21] Zhang E P,Zhang S H,Si L T,et al.Effects of NaCl stress on the membranes lipid per oxidation in cotyledon of cucumber seedlings[J].Journal of Shengyang Agricultural University,2001,32(6):446-448.
[22] 孟林,尚春燕,毛培春,等.偃麦草属植物种质材料苗期耐盐性综合评价[J].草业学报,2009,18(4):67-74.
[23] 杨福,梁正伟,王志春,等.苏打盐碱胁迫下水稻净光合速率日变化及其与影响因子的关系[J].中国水稻科学,2007,21(4):386-390.
[24] 黄立华,梁正伟.直播羊草在不同pH土壤环境下的离子吸收特性[J].中国草地学报,2008,30(1):35-39.
[25] 赵可夫.植物抗盐生理[M].北京:中国科学技术出版社,1993:222-223.
[26] 柯玉琴,潘延国.NaCl胁迫下对甘薯叶片叶绿素超微结构及一些酶活性的影响[J].植物生理学报,1999,25(4):229-233.
[27] Bohnert H J,Richard G J.Strategies for engineering water stress tolerance in plants[J].Trends Biotechnology,1996,14(3):89-97.
[28] 张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[29] 龚吉蕊,张新,赵爱芬,等.油蒿抗旱生理生化特性研究初报[J].中国沙漠,2002,22(4):387-392.
[30] 张玉霞,谭巍巍,王树艳,等.盐碱胁迫对芦笋抗氧化酶活性的影响[J].内蒙古民族大学学报(自然科学版),2006,21(2):165-168.
[31] 金美芳,连阳梅,林炎鸿.NaCl胁迫对油菜幼苗膜脂过氧化和抗氧化酶活性的影响[J].福建师范大学福清分校学报,2009,91(2):16-20.
