罗布泊来源胀果甘草根际枯草芽孢杆菌GA21次生代谢产物结构与活性初步研究
2012-08-09靳婧旭格拉哈布丁刘少伟郭琳蒋忠科栾迎春李展先潘臻孙承航
靳婧,旭格拉·哈布丁,刘少伟,郭琳,蒋忠科,栾迎春,李展先,潘臻,孙承航
特殊生态环境,尤其是极端环境是发现新微生物资源及新活性分子的宝库,近年来对这一宝库的资源勘探和新活性分子的发掘,在国际上已成为新的研究热点[1-3],针对这一研究热点,我们对来源于有地球“旱极”之称的罗布泊[4]及周边地区的微生物药用资源开展了勘探和药物筛选的研究工作,其中在以水稻稻瘟菌为检定菌,对沙生植物胀果甘草根际土壤分离出的一批放线菌和芽孢杆菌进行活性筛选过程中发现,枯草芽孢杆菌 GA21 的发酵液具有较强抗真菌活性。本文报道了枯草芽孢杆菌GA21 的培养,GA21-20 和GA21-26 的分离纯化,GA21-20 的谱学数据以及新化合物 GA21-26的抗真菌活性。
1 材料与方法
1.1 材料
1.1.1 菌株 菌株 GA21 经 16S rRNA 测序及NCBI 数据库 BLAST 比对表明 GA21 与菌株Bacillus Subtilis strain 47-B-41 核糖体碱基序列相似性为 100%,鉴定为枯草芽孢杆菌。
1.1.2 植物病原真菌 水稻稻瘟菌(Pyricularia oryzae)由浙江省农业科学院夏湛恩研究员馈赠。
1.1.3 培养基 GA21 的斜面、种子和发酵培养基均为改良高氏一号培养基(可溶性淀粉 20 g,氯化钠 50 g,磷酸氢二钾 0.5 g,硝酸钾 1 g,硫酸镁 1 g,硫酸亚铁 0.02 g,葡萄糖 1 g,蛋白胨 0.5 g,胰蛋白胨 0.3 g,蒸馏水 1000 ml,10% 无水碳酸钠调 pH 8.0)。
水稻稻瘟菌培养基 马铃薯葡萄糖琼脂培养基(PDA 培养基)由广东环凯生物科技有限公司提供。
白色念珠菌培养基 沙堡培养基(SDA 培养基)(麦芽糖 40 g,蛋白胨 20 g,琼脂 20 g,蒸馏水 1000 ml,调 pH 6.0)。
大肠杆菌培养基、金黄色葡萄球菌培养基均为LB 培养基(酵母提取物 5 g,蛋白胨 10 g,NaCl 5 g,蒸馏水 1000 ml,调 pH 7.5)。
1.1.4 试剂 分析纯乙酸乙酯、甲醇等均为北京化工厂生产;色谱级甲醇购于美国 Honeywell Burdick & Jackson 公司;水为屈臣氏蒸馏水。
1.1.5 分离填料 TLC 板、Silica gel 60 F254 铝箔板及玻璃板为德国 Merck 公司产品;高效液相色谱半制备柱 Zorbax SB-C18(9.4 mm × 250 mm,5 μm)和高效液相色谱分析柱 Zorbax SB-C18(9.4 mm × 150 mm,5 μm)均为美国安捷伦公司产品。
1.1.6 仪器 高效液相色谱仪 Agilent 1200 series为美国安捷伦公司产品;Linomat 5 TLC 板半自动点样仪为瑞士卡玛公司产品;Varian VNS-600 核磁共振分析仪为瑞士瓦里安公司产品;Christ RVC 2-18 型离心浓缩机为德国 Christ 公司产品。
1.2 方法
1.2.1 GA21 菌株的发酵 将生长良好的菌株GA21 斜面接种至含 50 ml 种子培养基的 250 ml三角瓶中,置于 28 ℃、180 r/min 摇床上旋转振荡培养 24 h,然后转接于含 1000 ml 发酵培养基的5000 ml 三角瓶中,28 ℃、180 r/min 摇床上旋转振荡培养 48 h,收获发酵液。
1.2.2 活性检测方法
⑴以稻瘟菌为检定菌,其斜面培养基为 PDA琼脂培养基,培养条件为 28 ℃,培养 4 d。用接种环刮取菌苔并转移至消毒后的磨菌器,磨菌器中加入 2 ml 生理盐水,磨菌后获得的稻瘟菌悬液以1% 接种量转移至约 40 ℃ 的 PDA 琼脂培养基中,混匀后,以 10 ml/皿迅速分装于已铺有 10 ml PDA 琼脂培养基的 90 mm 培养皿中,凝固后,将浸有已风干待测样品的 6 mm 圆形纸片贴于检定平板上,置于 28 ℃ 恒温培养箱中培养 4 d,观察结果。
⑵以白色念珠菌为检定菌,其培养基为 SDA培养基,培养条件为:28 ℃,培养 12 h。用接种环在白色念珠菌斜面培养基上刮取少量菌苔到SDA 液体培养基中,白色念珠菌液以 5% 接种量转移至约 40 ℃ 左右的 SDA 培养基中,混匀后,以 10 ml/皿迅速分装于已铺有 10 ml SDA 培养基的 90 mm 培养皿中,凝固后,将浸有已风干待测样品的 6 mm 圆形纸片贴于检定平板上,置于 28 ℃恒温培养箱中培养 12 h,观察结果。
⑶以金黄色葡萄球菌,大肠杆菌为检定菌,培养基均为 LB 培养基,培养条件和活性测定方法同上。
1.2.3 GA21-20 和GA21-26 的分离纯化 GA21菌株发酵液(10 L)经 4000 r/min 离心 15 min,获得发酵产物上清液,以等体积乙酸乙酯萃取上清液,萃取液经无水硫酸钠脱水,减压浓缩,获得粗品。粗品用半自动点样仪点样于硅胶板(10 cm ×10 cm),氯仿∶甲醇 = 4∶1 展开,200 μl/板 × 27 板。取其中一块点样展开后的硅胶铝箔板,按展开方向切下 8 mm 左右条带,在稻瘟菌平板上测活,根据活性点的比移值,在紫外灯下将其余展开后的制备薄层板上同样比移值的条带刮下,并装于小玻璃柱(15 cm × 1.5 cm),用适当体积的甲醇进行洗脱,将洗脱液减压浓缩,浓缩后,用少量甲醇溶解,经0.22 μm 过滤膜过滤后的样品,进一步用反相半制备高效液相柱纯化,制备条件如下:流动相为 55%甲醇水溶液,流速为 2 ml/min,检测波长 254 nm,收集保留时间为 19.8 min 的 GA21-20 和26.6 min的 GA21-26,离心浓缩除去甲醇和水。对样品纯度进行高效液相色谱分析,分析条件如下:流动相为51% 甲醇水溶液,流速为 1 ml/min,检测波长为254 nm。GA21-20 保留时间 7.1 min 纯度为 99%,GA21-26 保留时间为 10.4 min,纯度为 99%。
2 结果
2.1 化合物 GA21-20 和GA21-26 的结构鉴定
以甲醇为溶剂,化合物 GA21-20 和GA21-26紫外吸收光谱均在 248 nm 和312 nm 有最大紫外吸收,推测可能为 3, 4-二氢异香豆素类化合物[5],GA21-20 的高分辨质谱见图 1。HR- ESIMS:[M+H]+实测值为 425.19292,理论值为 425.19184,分子式为 C20H28O8N2,不饱和度 Ω = 8。由GA21-20 的13C-NMR 和DEPT 谱可知该化合物含 6 个季碳,9 个叔碳,3 个仲碳,2 个伯碳,结合1H-NMR、13C-NMR 中的化学位移和1H-1H COSY、13C-1H COSY 可知 GA21-20 有 2 个甲基碳信号,3 个羰基碳信号,其中一个为酯羰基碳信号:1-C(δ = 169.0)、1 个酰胺羰基碳信号 7′-C(δ = 172.7)和1 个羧酸羰基碳信号 12′-C(δ =173.4)。由1H -1H COSY 观察到 5-H(δ = 6.808,1H,d)与 6-H(δ = 7.472,1H,t)相关,7-H(δ = 6.839,1H,d)亦与 6-H 相关,再结合 HMBC谱,5-H 信号与 7-C(δ = 115.2)和8a-C(δ = 108.2)相关,6-H 信号与 4a-C(δ = 140.6)和8-C(δ =160.8)相关,从而可推断出结构式中含有的苯酚结构;1H-1H COSY 谱表明 4′-H(δ = 2.120,1H,t 与δ = 1.326,1H,t)与 5′ -H(δ = 4.193,1H,t)、5′-H与 3-H(δ = 4.672,1H,dt),3-H 与 4-H(δ = 3.044,1H,t 和δ = 2.848,1H,d)相关;3′-H(δ = 1.650,1H,m)与 1′-H(δ = 0.831,3H,d)和2′-H(δ =0.906,3H,d)分别相关;结合 HMBC 可推出与苯环相连的部分结构片段;此外,在1H-1H COSY谱中,出现了 8′-H(δ = 3.615,1H,d)和9′-H(δ = 3.908,1H,q),9′-H 和10′-H(δ = 3.125,1H,t),10′-H 和11′-H(δ = 2.299,1H,d 和δ =2.255,1H,d)相关,结合 HMBC,9′-H 与 7′-C(δ = 172.7),10′-H 与 8′-C(δ = 72.7)相关,从而推出了与 3, 4 -二氢异香豆素母核相连的侧链基团片段。综合上述结构特征以及 1D-NMR 和2D-NMR 的仔细解析,并与文献[6]比较,确定了GA21-20 化学结构与 Amicoumacin B 一致,结构如图 2 所示。GA21-20 的13C 和1H 信号归属如表 1。
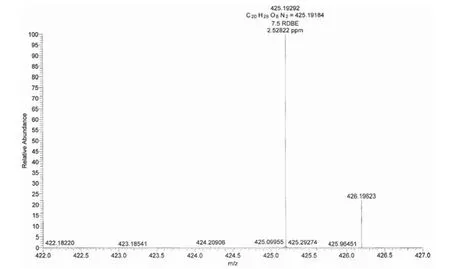
图1 GA21-20 高分辨质谱图Figure 1 HR-ESIMS of GA21-20
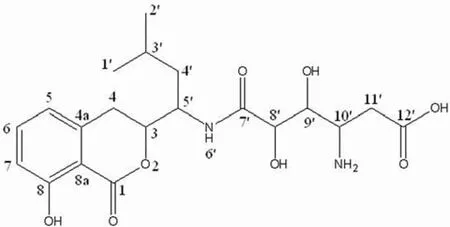
图2 GA21-20 化学结构Figure 2 Chemical structure of GA21-20
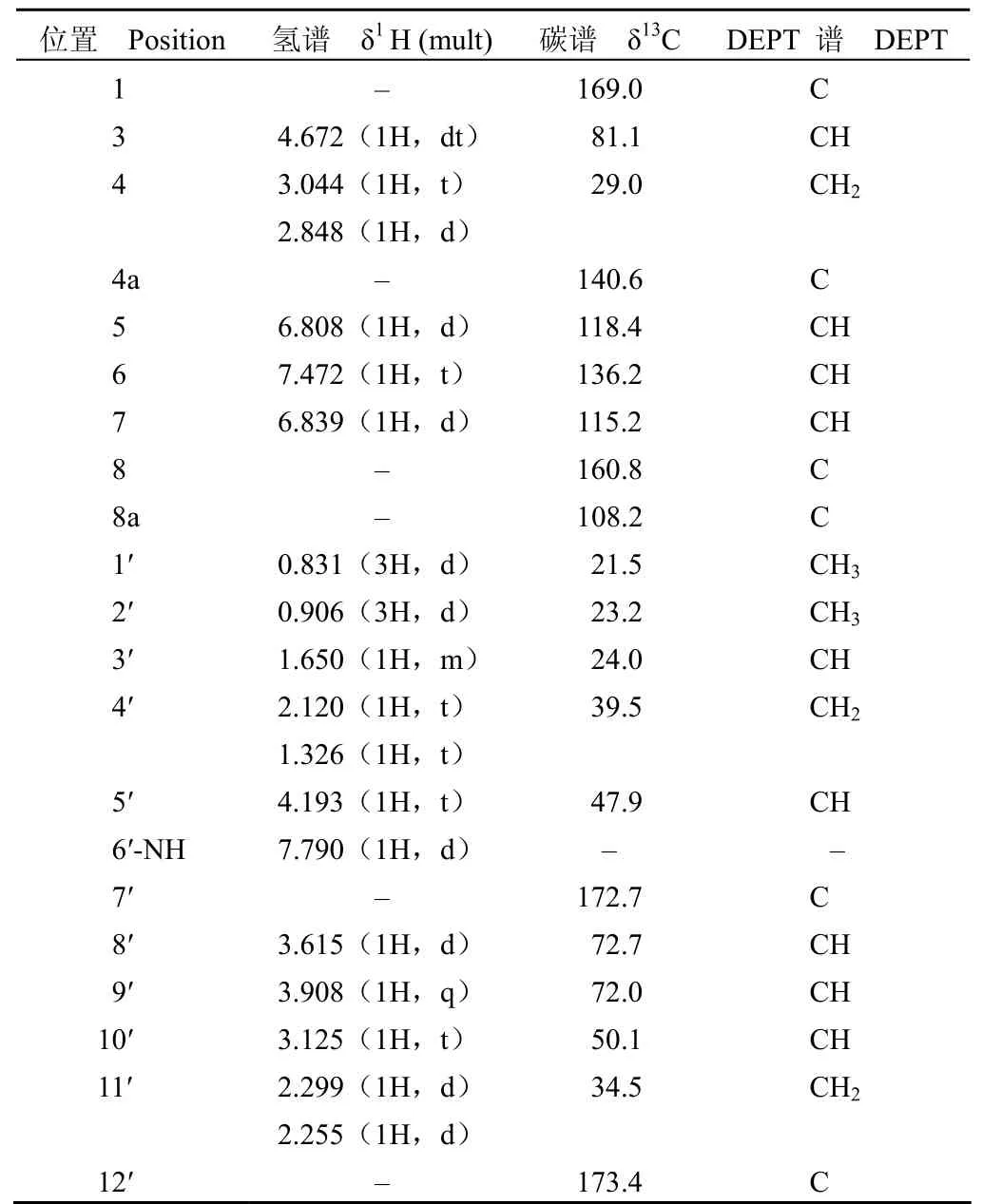
表1 GA21-20 的氢谱数据及其碳谱数据Table 1 1 H-NMR and 13C-NMR data of GA21-20
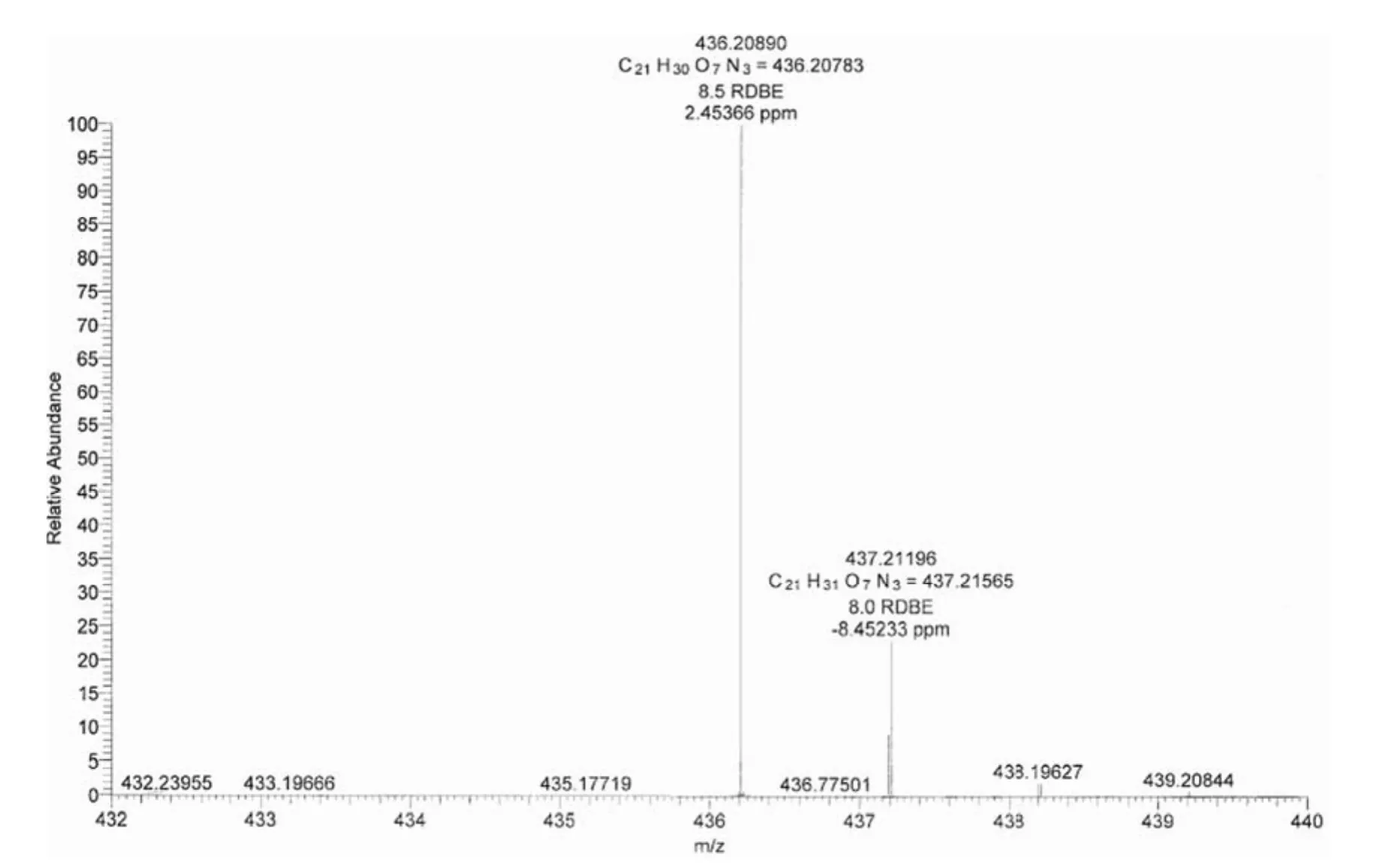
图3 GA21-26 高分辨质谱图Figure 3 HR-ESIMS of GA21-26
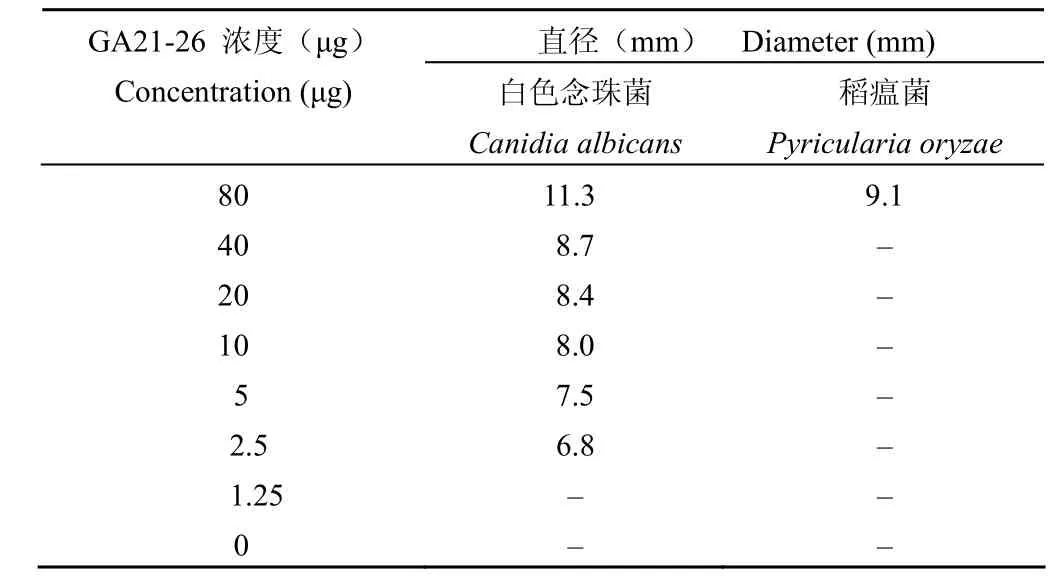
表2 不同浓度 GA21-26 对白色念珠菌和稻瘟菌抑菌圈的直径(mm)Table 2 Inhibitory zone diameter of compounds GA21-26 against Canidia albicans and Py ricularia oryzae (mm)
化合物 GA21-26 的紫外吸收峰与 GA21-20一致,高分辨质谱见图 3。HR-ESIMS:[M+H]+实测值为 436.20890;理论值为 436.20783,分子式为 C21H29O7N3,不饱和度 Ω = 9,目前文献报道的Amicoumacin 类似物中并没有此分子量,因此其为一新的 Amicoumacin 族化合物,GA21-26 的核磁共振数据亦支持这一结论,新化合物 GA21-26 的化学结构、结构解析、理化性质将另文报道。
2.2 GA21 菌株发酵液粗品抗细菌及抗真菌活性
GA21 菌株发酵液粗品 50 ml,经 4000 r/min离心 15 min,获得发酵产物上清液,以等体积乙酸乙酯萃取上清液,减压浓缩,获得粗品。用 1 ml 甲醇溶解样品,取 60 μl 溶解后的样品分别加到直径为 6 mm 的纸片上,待纸片挥干溶剂后贴于金黄色葡萄球菌、大肠杆菌、稻瘟菌、白色念珠菌测活平板上。观察结果表明,发酵液乙酸乙酯萃取物对稻瘟菌、白色念珠菌具有抑制活性,对金黄色葡萄球菌、大肠杆菌无抑制活性。
2.3 化合物 GA21-20 和GA21-26 的抗真菌活性
采用倍半稀释法使化合物 GA21-20 和GA21-26 在直径为 6 mm 的纸片上浓度分别为80、40、20、10、5、2.5、1.25、0 μg。待纸片挥干溶剂后贴于白色念珠菌、稻瘟菌平板上,观察抑菌圈直径,结果如表 2 所示。GA21-26 在 2.5 μg/纸片对白色念珠菌即可显示抑制活性,但在 80 μg/纸片才对水稻稻瘟菌显示抑制活性,表明 GA21-26在拮抗医学条件致病真菌方面有潜在用途。GA21-20对白色念珠菌和稻瘟菌均无抑制活性。
3 讨论
枯草芽孢杆菌属微生物可产生包括肽类、酯肽类、磷脂类、聚酮类、氨基糖类等[7]超过 20 种不同结构类型的抗生素[8],但大部分为肽类抗生素,其中包括核糖体途径合成的肽类抗生素如枯草菌素(subtilin)、Ericin 和Mersacidin 等以及非核糖体途径合成的酯肽类抗生素如表面活性素(surfactin)、伊枯草菌素(iturin)、丰原素(fengycin)等;同时,该属微生物还能产生一些非肽类抗生素[9],如聚酮类(polyketides)、萜类、异香豆素类抗生素等。异香豆素类具有广泛的生物活性,如抗细菌、抗病毒、抗炎、抗肿瘤、胃肠保护等,目前以微生物 Streptoverticillium eurocidicum 次生代谢产物 cytogenin 为模板,经结构修饰的 NM-3 作为口服治疗非小细胞肺癌药物已进入二期临床试验,有望开发成新的抗肿瘤血管生成抑制剂类药物[10-12],可见异香豆素类化合物具有较好潜在的成药性。本研究发现的 GA21-20 和GA21-26 属于异香豆素类抗生素中具有 3, 4-二氢异香豆素母核的Amicoumacin,Amicoumacin 类抗生素 Amicoumacin A, B, C 最早由 Itoh 等[13]在 1981 年报道,其母核为 3, 4-二氢异香豆素,并在 3 位上固定连接甲基丁基氨基侧链,随氨基侧链基团变化,衍生出许多Amicoumacin 类似物。对已发现 Amicoumacins 类化合物及结构类似物的文献调研表明,该类化合物主要来源于芽孢杆菌和真菌,少量来源于致病杆菌属、放线菌属等,目前文献报道的微生物来源Amicoumacin 及其类似物有 16 种。在实验中发现,GA21 菌株除了能产生 GA21-20(Amicoumacin B)及 GA21-26 两个化合物外,还能产生许多紫外吸收与之类似的小组分,如果通过 LC-MS 分析方法,在比对分子量的基础上定向发现并进一步纯化该类新组分,开展生物活性研究,有望能进一步从该菌株的次生代谢产物中发现新的异香豆素类先导化合物。
[1]Wilson ZE, Brimble MA.Molecules derived from the extremes of life.Nat Prod Rep, 2009, 26(1):44-71.
[2]Zeng YX, Chen B, Zou Y, et al.Polar microorganisms, a potential source for new natural medicines.Acta Microbiol Sinica, 2008, 48(5):695-700.(in Chinese)曾胤新, 陈波, 邹扬, 等.极地微生物——新天然药物的潜在来源.微生物学报, 2008, 48(5):695-700.
[3]Li WJ, Xu P, Xu LH, et al.Actinomycetes resources of extreme environment.Microbiology, 2003, 30(4):125-127.(in Chinese)李文均, 徐平, 徐丽华, 等.极端环境中的放线菌资源.微生物学通报, 2003, 30(4):125-127.
[4]Xia XC, Wang FB, Zhao YJ.China Lop Nur.Beijing: Science Press,2007.(in Chinese)夏训诚, 王富葆, 赵元杰.中国罗布泊.北京: 科学出版社, 2007.
[5]Itoh J, Omoto T, Nishizawa N, et al.Chemical structures of amicoumacins produced by Bacillus Pumicus.Agr Biol Chem, 1982,46(4):2659-2665.
[6]Yang ZY, Zhang ZP, Xie YY, et al.Extraction, purification and structure identification of the active component from fermentation broth of Nocardia sp.04-5195.Chin J Antibiot, 2008, 33(6):325-327.(in Chinese)杨兆勇, 张志裴, 谢云英, 等.诺卡菌属菌株 04-5195发酵液中活性成分04-5195A的分离, 纯化与结构鉴定.中国抗生素杂志, 2008,33(6):325-327.
[7]Wang S, Gao SF, Gao XW, et al.Fermentation optimization in lipopeptide productivity of bacillus subtilis G1.Chin J Biolo Control,2007, 23(4):342-347.(in Chinese)王帅, 高圣风, 高学文, 等.枯草芽孢杆菌脂肽类抗生素发酵和提取条件.中国生物防治, 2007, 23(4):342-347.
[8]Wang Q, Peng KS, Yan B, et al.Progress on antibiotics of bacillus subtilis source.Prog Vet Med, 2010, 31(9):97-101.(in Chinese)王强, 彭开松, 严兵, 等.枯草芽孢杆菌源抗生素研究进展.动物医学进展, 2010, 31(9):97-101.
[9]Hamdache A, Lamarti A, Aleu J, et al.Non-peptide metabolites from the genus Bacillus.J Nat Prod, 2011, 74(4):893-899.
[10]Kumagai H, Masuda T, Ohsono M, et al.Cytogenin, a novel antitumor substance.J Antibiot (Tokyo), 1990, 43(11):1505-1507.
[11]Matsumoto N, Nakashima T, Isshiki K, et al.Synthesis and biological evaluation of cytogenin derivatives.J Antibiot (Tokyo), 2001, 54(3):285-296.
[12]Sarbani P, Vijaykumar C, Manojit P.Isocoumarin and its derivatives:an over view on their synthesis and applications.Curr Org Chem,2011, 15(5):782-800.
[13]Itoh J, Omoto S, Shomura T, et al.Amicoumacin-A, a new antibiotic with strong antiinflammatory and antiulcer activity.J Antibiot (Tokyo),1981, 34(5):611-613.
