HPLC法测定大鼠外用盐酸西替利嗪后皮肤组织中的药物含量Δ
2012-08-07刘雪丽孙勇徐丽洒安珂瑶青岛大学医学院药学系山东青岛26602青岛市中心医院药剂科山东青岛266042
刘雪丽,孙勇,徐丽洒,安珂瑶(.青岛大学医学院药学系,山东青岛26602;2.青岛市中心医院药剂科,山东青岛 266042)
盐酸西替利嗪(Cetirizine Hydrochloride),是第2代H1受体拮抗药,可抑制嗜酸粒细胞游走[1],抑制变态反应相关的多种炎症介质的释放,能与人H1受体选择性高亲和力结合[2],同时还具有较广泛的抗炎作用。有研究[3]证实,H1受体存在于真皮成纤维细胞上,盐酸西替利嗪可通过阻滞真皮成纤维细胞上的H1受体抑制中性粒细胞和单核细胞的趋化而发挥抗皮肤过敏作用。药动学研究[4]表明,盐酸西替利嗪具有口服吸收快、起效快、作用持久的优点;临床研究[5,6]表明,其用于治疗荨麻疹和季节性过敏性鼻炎优于常用的第2代抗组胺类药物。目前上市的盐酸西替利嗪制剂多为片剂,口服后有嗜睡等中枢神经系统不良反应;且其通过肝脏细胞色素P450酶代谢,能使肝酶升高,胆红素增加,产生肝脏损害,刺激食欲,引起体重增加,产生肾毒性;此外还可以引起皮疹和心脏毒性等[7]。为了减少药物的首关效应以及口服过程中出现的不良反应,笔者在实验中制备油包水型盐酸西替利嗪搽剂外用于皮肤,用于治疗各种过敏性皮肤反应、蚊虫叮咬等。本研究以盐酸羟嗪为内标,建立了高效液相色谱(HPLC)法测定大鼠背部皮肤外用盐酸西替利嗪后皮肤组织中盐酸西替利嗪含量的方法。
1 仪器与材料
1.1 仪器
LC-10Atvp HPLC仪,包括输液泵、LC-10AD紫外检测器、CTO-10Asvp柱温箱、Lab Solutions色谱数据处理系统(日本Shimadzu公司);BS124S型电子天平(北京赛多利斯仪器系统有限公司);PM180R型高速冷冻离心机(上海易扩仪器有限公司);FSH-2型可调高速匀浆机(江苏省金坛市荣华仪器制造有限公司)。
1.2 试药
盐酸西替利嗪标准品(批号:100659-200401,纯度:100%)、盐酸羟嗪标准品(内标,批号:100266-200201,纯度:98.6%)均由中国食品药品检定研究院提供;盐酸西替利嗪搽剂(青岛大学医学院自制,批号:2010101601,含量:10 g·L-1);乙腈为色谱纯,乙酸乙酯和二氯甲烷均为分析纯,水为纯化水。
1.3 动物
Wistar大鼠,♂,体重180~220 g,华中科技大学同济医学院实验动物学部提供,许可证号:SCXK(鄂)2004-0007。
2 方法与结果
2.1 溶液的制备
2.1.1 标准品溶液。精密称取盐酸西替利嗪标准品20.0 mg,置于100 mL量瓶中,用水溶解并稀释至刻度,摇匀,制备成浓度200 mg·L-1的贮备液;再以水按比例稀释贮备液,制备成0.8、2、10、50、100、120 mg·L-1系列浓度的标准品溶液,置于4℃冰箱内保存待用。
2.1.2 内标溶液。精密称取纯度为98.6%的盐酸羟嗪标准品10.0 mg,置于1 000 mL量瓶中,用水溶解并稀释至刻度,摇匀,制备成浓度9.86 mg·L-1的内标溶液,置于4℃冰箱内保存待用。
2.1.3 枸橼酸缓冲液。制备2.1%枸橼酸水溶液,用50%氢氧化钠溶液调节pH值至5.5,即得。
2.2 色谱条件
色谱柱:ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5µm),预柱:Eclipse XDB-C18保护柱(12.5 mm×4.6 mm,5µm);流动相:乙腈-0.05 mol·L-1磷酸二氢铵水溶液(330∶700,V/V),流速:1.0 mL·min-1;检测波长:229 nm;进样量:20 μL;柱温:30℃。
2.3 皮肤组织样品预处理
取大鼠皮肤组织匀浆200 μL,置于10 mL离心管中,分别加入50 μL内标溶液和200 μL枸橼酸缓冲液,混匀,加乙酸乙酯-二氯甲烷(30∶1,V/V)萃取液萃取2次,每次1.5 mL,涡旋混匀1 min,3 500 r·min-1离心10 min,合并萃取上清液置于另一试管中,以高纯氮气于40℃水浴上吹干,残留物加枸橼酸缓冲液200 μL复溶后,转移至1.5 mL离心管中,10 000 r·min-1离心3 min,吸取20 μL上清液进样分析。
2.4 专属性考察
取6只正常大鼠空白皮肤组织匀浆200 μL,加入50 μL水代替内标,作为空白皮肤组织溶液;取上述空白皮肤组织匀浆200 μL,加50 mg·L-1标准品溶液和内标溶液制成含盐酸西替利嗪15.0 μg·mL-1和盐酸羟嗪3.94 μg·mL-1的皮肤组织匀浆,作为空白皮肤组织+标准品+内标溶液;另取6只大鼠给药后皮肤组织样品匀浆,作为皮肤组织样品溶液。均依法预处理后,进样20 μL,记录色谱。结果表明,盐酸西替利嗪和盐酸羟嗪在此色谱条件下保留时间分别为14.3 min和12.2 min,空白皮肤组织中的内源性物质不干扰盐酸西替利嗪和盐酸羟嗪的测定。色谱见图1。
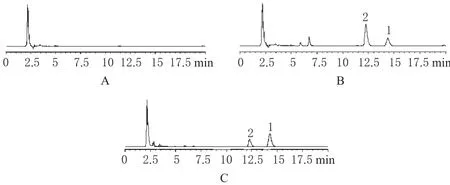
图1 高效液相色谱图A.空白皮肤组织;B.空白皮肤组织+标准品+内标;C.皮肤组织样品;1.盐酸西替利嗪;2.盐酸羟嗪Fig 1 HPLC chromatogramsA.blank skin tissue;B.blank skin tissue+standard+internal standard;C.skin tissue sample;1.cetirizine hydrochloride;2.hydroxyzine hydrochloride
2.5 标准曲线的绘制
取大鼠空白皮肤组织匀浆,置于10 mL离心管中,加入系列标准品溶液,混匀,制备成盐酸西替利嗪浓度分别为0.80、4.0、20.0、40.0、48.0、96.0 μg·mL-1的组织样品,预处理后进样20.0 μL,记录色谱。以待测物浓度(X)为横坐标,待测物与内标的峰面积比值(Y)为纵坐标,进行回归分析。得回归方程为Y=0.076 65X+0.000 72(r=0.999 2),结果表明,盐酸西替利嗪检测浓度的线性范围为0.80~96.0 μg·mL-1。
2.6 定量下限考察
取大鼠空白皮肤组织匀浆,置于10 mL离心管中,加入浓度为0.800 mg·L-1的对照品溶液制备成盐酸西替利嗪浓度为0.320 μg·mL-1的组织样品,预处理后进样20 μL,重复5次,并根据当日标准曲线计算浓度。结果表明,盐酸西替利嗪的定量下限为0.320 μg·mL-1。
2.7 精密度试验
取大鼠空白皮肤组织匀浆,分别加入不同浓度的对照品溶液,制备成盐酸西替利嗪浓度分别为0.800、4.00、40.0 μg·mL-1的组织样品,每种浓度5份,预处理后进样20 μL,并根据当日标准曲线计算浓度,连续测定3 d,求得方法的精密度。结果,日内RSD均小于6.9%,日间RSD均小于8.1%。
2.8 提取回收率试验
取大鼠空白皮肤组织匀浆,分别加入不同浓度的对照品溶液,制备成低、中、高浓度(盐酸西替利嗪浓度分别为0.800、4.00、40.0 μg·mL-1)的组织样品,每种浓度5份,进行预处理;同时另取空白皮肤组织匀浆200 μL,除不加对照品溶液和内标溶液外,按“2.3”项下预处理,进样分析,记录相应峰面积(3次测定的平均值),计算提取回收率,结果见表1。

表1 提取回收率试验结果Tab 1 Results of extraction recovery test
2.9 稳定性试验
取大鼠空白皮肤组织匀浆,分别加入不同浓度的对照品溶液,制备成低、高浓度(盐酸西替利嗪浓度分别为0.800、40.0 μg·mL-1)的皮肤组织样品,每种浓度3份,分别按如下处理考察稳定性:(1)于室温放置0、5 h后预处理,进样测定;(2)预处理后再放置12 h后测定;(3)于-20℃下冷冻24 h以上,然后在室温自然解冻,反复冻融3次,预处理后进样测定;(4)于-20℃保存4、14 d后取出,室温自然解冻,预处理后进样测定。结果表明,盐酸西替利嗪皮肤组织样品含量的RSD均在2.3%~9.7%,表明其稳定性较好。
2.10 样品测定
取大鼠6只,晚间禁食不禁水12 h以上,早晨称量空腹体重,根据空腹体重给药,给药量为20.0 mg·kg-1。将盐酸西替利嗪搽剂均匀地擦拭在3 cm×3 cm用电动剃毛器剃过毛的大鼠正常皮肤背部。给药后4 h脱颈椎处死大鼠,在其脱毛部位立即用600 mL水清洗皮肤,滤纸将水吸干后,用剪刀剪取背部皮肤大约0.500 g,剪碎称重后加4倍量的水,10 000 r·min-1匀浆10 min,制成25.0%的组织匀浆,预处理后进样测定。结果表明,大鼠皮肤组织中盐酸西替利嗪的平均含量为(81.7±2.44)μg·g-1。
3 讨论
本试验取标准品溶液和皮肤组织样品溶液在210~400 nm波长范围内进行扫描,确定了检测波长为229 nm,与2010年版《中国药典》一致。
盐酸羟嗪在本色谱条件下的保留时间与盐酸西替利嗪接近,以其为内标,可有效消除操作误差,以提高测定准确性。
据相关数据[8],成人每日1次口服西替利嗪片10 mg,其达峰浓度为300 ng·mL-1,本实验大鼠盐酸西替利嗪搽剂的给药量为20.0 mg·kg-1;测得大鼠皮肤组织中盐酸西替利嗪的平均含量为(81.7±2.44)μg·g-1,可以在局部达到有效治疗量。结果表明,盐酸西替利嗪搽剂避免了首关效应及对大鼠胃肠的刺激,提高了临床用药的安全性。
笔者曾选用60%甲醇、乙腈、乙酸乙酯萃取皮肤组织中的盐酸西替利嗪,结果表明,乙酸乙酯萃取的效率最高。
综上所述,本方法操作简单、准确、灵敏,可用于大鼠皮肤组织中盐酸西替利嗪的含量测定,为西替利嗪外用制剂的研发提供了参考。
[1]Thomson L,Blaylock MG,Sexton DW,et al.Cetirizine and levocetirizine inhibit eotaxin-induced eosinophil transendothelial migration through human dermal or lung microvascular endothelial cells[J].Clin Exp Allergy,2002,32(8):1 187.
[2]Gillard M,van Der Perren C,Massingham R,et al.Binding characteristics of[3H]levocetirizine to cloned human H1histamine-receptors expressed in CHO cells[J].Inflamm Res,2002,51(Suppl 1):77.
[3]宋洪杰,胡晋红,黄 瑾,等.西替利嗪干预组胺诱导的真皮成纤维细胞IL-8和MCP-1产生[J].中国药理学通报,2005,21(4):457.
[4]Benedetti MS,Plisnier M,Kaise J,et al.Absorption,distribution,metabolism and excretion of[14C]levocetirizine,the R enantiomer of cetirizine,in healthy volunteers[J].Eur J Clin Pharmacol,2001,57(8):571.
[5]赵 鸿,许 娟.西替利嗪治疗荨麻疹的临床疗效观察[J].中国医药指南,2011,26(9):250.
[6]徐学君.国外临床应用西替利嗪的概况[J].中国药师,1999,2(5):238.
[7]李建成,关艳娟,韩培红.抗组胺药及其不良反应[J].现代中西医结合杂志,2009,18(9):1 068.
[8]钟 玲,任先达.西替利嗪的安全性指标测定[J].暨南大学学报(自然科学与医学版),2001,22(6):18.
