羟基喜树碱缓释片在大鼠脑内的释放情况研究
2012-08-07胡婧刘松青第三军医大学西南医院药学部重庆400038
胡婧,刘松青(第三军医大学西南医院药学部,重庆400038)
羟基喜树碱(Hydroxycamptothecin,HCPT)是从我国特有的珙桐科植物喜树中提取并研制开发的抗癌药物,是细胞周期特异性药物,通过抑制DNA拓扑异构酶Ⅰ的活性来达到治疗恶性肿瘤的目的。脑胶质瘤是中枢神经系统的恶性肿瘤,由于其呈浸润性生长,手术不易完全切除,且大多的化疗药物不易通过血脑屏障而难以在脑内达到有效的治疗浓度,术后易复发。如今,以生物可降解材料为载体的缓释制剂的间质内化疗的发展,大大提高了脑瘤患者的生存率[1]。在前期研究中,我院药剂科实验室采用正交设计方法制备了HCPT缓释片[2],并对其自身的稳定性和体外释放情况进行了一系列的考察,在此基础上笔者拟对HCPT缓释片进行体内研究评价,即考察缓释片在大鼠脑内的释放情况,从而为HCPT缓释片的临床应用奠定基础。
1 仪器与材料
1.1 仪器
Alliance2690高效液相色谱系统,包括474荧光检测器和Millennium色谱工作站(美国Waters公司);Milli-Q型超纯水器(美国Millipore公司);BP211D型电子天平(德国Sartorius公司)。
1.2 试药
HCPT缓释片(自制,批号:20090613,规格:每片2.4 mg);HCPT对照品(中国食品药品检定研究院,批号:200301,纯度:99.8%);盐酸氯胺酮注射液(军事医学科学院兽医研究所,批号:070302,规格:每支5 mL);甲醇、乙腈为色谱纯,其他试剂均为分析纯。
1.3 动物
SD大鼠,体重200~250 g,♀♂各半,由第三军医大学实验动物中心提供,合格证号:SCXK(渝)2007-007。
2 HCPT体内测定方法的建立
2.1 样品处理方法
2.1.1 血浆样品的处理。精密吸取100 μL血浆样品,置于1.5 mL离心管中,加入10 μL冰醋酸振荡混匀,避光放置2 h,再加入200 μL甲醇-乙腈(1∶3)混合液,振荡20 s,13 000 r·min-1离心5 min,取上清液进样。
2.1.2 组织样品的处理。取出脑后,生理盐水洗去残血,滤纸吸干并称重。以5 mL·g-1的比例,加入生理盐水,匀浆。13 000 r·min-1离心5 min,取上清液即为脑组织液,备用。精密吸取脑组织液100 μL,置于1.5 mL离心管中,加入10 μL冰醋酸振荡混匀,避光放置2 h,再加入200 μL甲醇-乙腈(1∶3)混合液,振荡20 s,13 000 r·min-1离心5 min,取上清液进样。
2.2 色谱条件与系统适用性试验
色谱柱:Diamonsil C18(250 mm×4.6 mm,5µm);流动相:乙腈-0.1%三乙胺溶液(磷酸调pH至3.0)=25∶75(V/V),流速:1.0 mL·min-1;柱温:30 ℃;激发波长:363 nm;发射波长:550 nm;进样量:10 μL。取HCPT对照品、空白血浆、血浆样品、空白脑组织、脑组织样品进样分析,记录色谱。结果表明,HCPT保留时间约为6.60 min,空白血浆和空白脑组织中其他成分不影响HCPT的测定。色谱见图1。
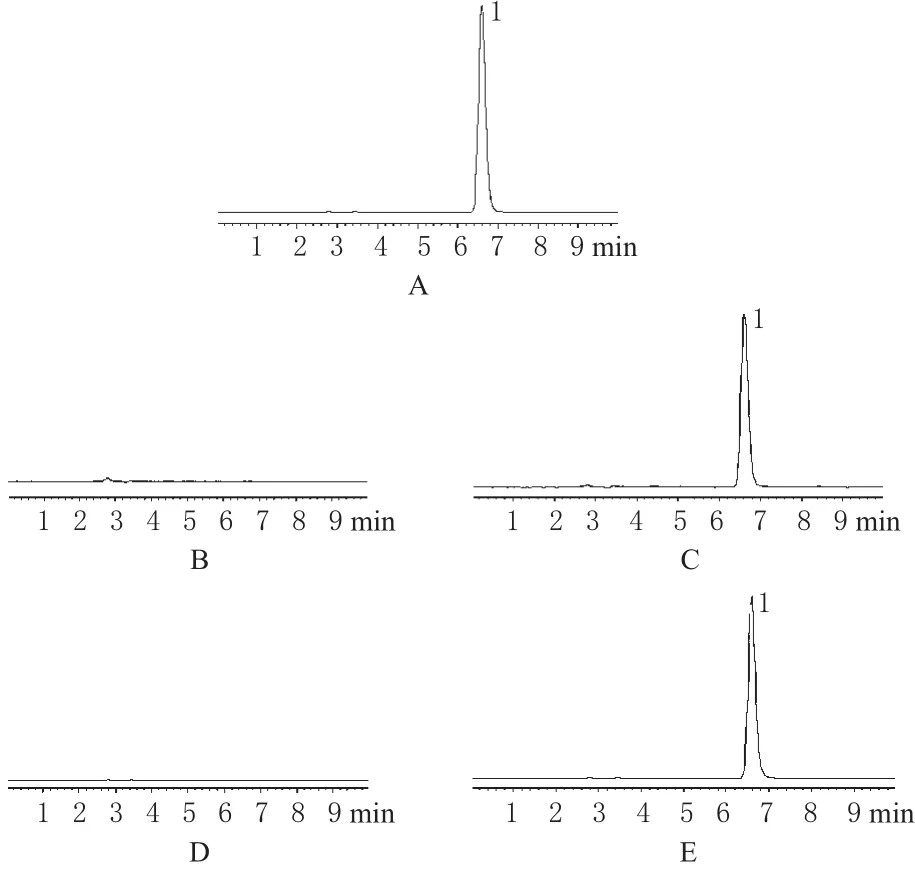
图1 高效液相色谱图A.对照品;B.空白血浆;C.血浆样品;D.空白脑组织;E.脑组织样品;1.HCPTFig 1 HPLC chromatogramsA.reference substance;B.blank plasma;C.plasma sample;D.blank cerebral tissue;E.cerebral tissue sample;1.HCPT
2.3 标准曲线的制备
2.3.1 血浆标准曲线。精密称取HCPT对照品1 mg,用甲醇溶液定容至100 mL容量瓶中,制备成浓度为10 μg·mL-1的贮备液,将贮备液用空白血浆稀释成浓度为1 000、500、250、125、62.5、31.25、15.625 ng·mL-1的标准溶液,按“2.1.1”项下方法处理,进样测定,记录色谱。以血浆药物浓度(X)对峰面积(Y)进行线性回归,得回归方程为Y=2.49×102X+7.52×102(r=0.999 7)。结果表明,血浆HCPT检测浓度在15.625~1 000 ng·mL-1范围内呈良好线性关系。
2.3.2 脑组织标准曲线。取“2.3.1”项下贮备液,用空白脑组织液稀释成浓度为 5 000、2 500、1 250、625、312.5、156.25、78.125、39.062 5 ng·mL-1的标准溶液,按“2.1.2”项下方法处理,进样测定,记录色谱。以脑组织药物浓度(X)对峰面积(Y)进行线性回归,得回归方程为Y=2.50×102X-1.54×102(r=0.998 1)。结果表明,脑组织HCPT检测浓度在39.062 5~5 000 ng·mL-1范围内呈良好线性关系。
2.4 回收率试验
2.4.1 血浆样品。按“2.3.1”项下方法制备含HCPT 31.25、125、500 ng·mL-1的血浆样品,照“2.1.1”项下方法处理,进样测定,记录色谱,并计算回收率,结果见表1。
2.4.2 脑组织样品。按“2.3.2”项下方法制备含HCPT 156.25、625、2 500 ng·mL-1的脑组织样品,照“2.1.2”项下方法处理,进样测定,记录色谱,并计算回收率,结果见表2。

表1 血浆样品回收率试验结果(n=5)Tab 1Results of recovery test in plasma sample(n=5)

表2 脑组织样品回收率试验结果(n=5)Tab 2Results of recovery test in cerebral tissue sample(n=5)
2.5 精密度试验
2.5.1 血浆样品。按“2.3.1”项下方法制备含HCPT 31.25、125、500 ng·mL-1的血浆样品,照“2.1.1”项下方法处理。同日内进样测定5次;另每日测定1次,连续测5 d,计算日内和日间RSD。结果,血浆样品的日内RSD为0.7%~2.0%,日间RSD为2.0%~4.4%。
2.5.2 脑组织样品。按“2.3.2”项下方法制备含HCPT 156.25、625、2 500 ng·mL-1的脑组织样品,照“2.1.2”项下方法处理。同日内进样测定5次;另每日测定1次,连续测5 d,计算日内和日间RSD。结果,脑组织样品的日内RSD为0.2%~0.4%,日间RSD为2.0%~5.0%。
3 HCPT缓释片大鼠脑内释放度的考察
3.1 稳定性试验
将HCPT缓释片通过10 kGy的60Co照射消毒,检测经照射后23 d内缓释片性状、含量、累积释放率有无变化。结果表明,HCPT缓释片经60Co照射消毒后性状、含量、累积释放率均无明显变化,具体结果见表3。
表3 HCPT缓释片经60Co照射后的稳定性试验结果(±s,n=3)Tab 3 Results of stability tests of HCPT sustained-release tablets after exposure to60C(o±s,n=3)

表3 HCPT缓释片经60Co照射后的稳定性试验结果(±s,n=3)Tab 3 Results of stability tests of HCPT sustained-release tablets after exposure to60C(o±s,n=3)
累积释放率/%23 d 73.67±2.3 74.16±3.1时间照射前照射后性状光滑、黄色光滑、黄色含量/%100.43 100.31 3 d 30.37±3.1 31.53±2.7 7 d 42.12±2.9 41.59±3.3 17 d 60.75±3.7 62.08±2.6
3.2 给药方法
取大鼠40只,腹腔给予盐酸赛拉嗪注射液麻醉后,将大鼠头部固定,酒精消毒,于矢状缝右2 mm、冠状缝后3 mm处切开皮肤,钻孔,孔径约3.5 mm,将1片HCPT缓释片植入额叶脑皮质下1 mm处,骨蜡封闭骨孔,缝合皮肤[3~5]。
3.3 样品的采集
将植入前的HCPT缓释片中HCPT的含量质量记为W1,于植入后第1、3、7、10、13、17、21、28天分别处死5只大鼠,完整地暴露大鼠的脑组织,将残留于脑中的缓释片取出置于表面皿中,研磨后加入甲醇-二氯甲烷(1∶1)适量溶解,过滤,将续滤液转移至100 mL容量瓶中,并加入甲醇定容至刻度,13 000 r·min-1离心5 min,取上清液进样测定,测得的HCPT的量为残留在大鼠脑组织中未释放的药量W2。在脑组织中释放的药量为W3=W1-W2。结果,HCPT缓释片在大鼠脑内的累积释放率见表4。
表4 HCPT缓释片在大鼠脑内的累积释放率(±s,n=5)Tab 4 Cumulative release rate of HCPT sustained-release tablets in cerebral tissue of rat(s±s,n=5)
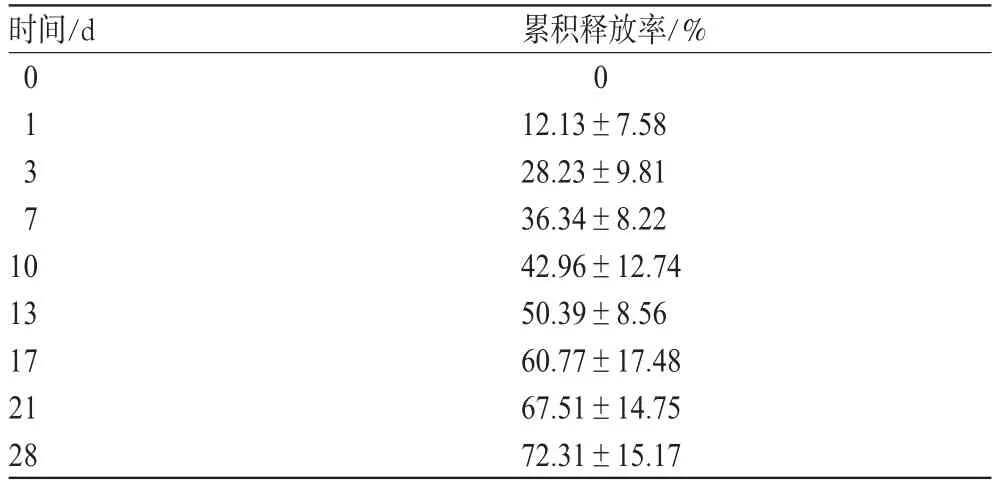
表4 HCPT缓释片在大鼠脑内的累积释放率(±s,n=5)Tab 4 Cumulative release rate of HCPT sustained-release tablets in cerebral tissue of rat(s±s,n=5)
由表4可知,HCPT缓释片在脑内的释放时间达到28 d以上,有较好的缓释效果,且释放较均匀、平稳。
时间/d 累积释放率/%0 12.13±7.58 28.23±9.81 36.34±8.22 42.96±12.74 50.39±8.56 60.77±17.48 67.51±14.75 72.31±15.17 01371 0 13 17 21 28
4 HCPT在脑组织和外周血浆中的浓度比较
4.1 HCPT在血浆中的浓度
在“3.3”项下时间点1、3、7、10、13、17、21、28 d处死大鼠之前,从尾静脉采血0.5 mL,置于已加入肝素钠的抗凝管中,4 000 r·min-1离心5 min,分离血浆,按“2.1.1”项下方法处理,进样测定,记录色谱,计算血浆中HCPT浓度。HCPT缓释片在大鼠血浆中的药物浓度见表5,药-时曲线见图2。
表5 HCPT缓释片在大鼠血浆及脑组织中的药物浓度(x±s,n=5)Tab 5 Concentration of HCPT sustained-release tablets in plasma and cerebral tissue(±s,n=5)
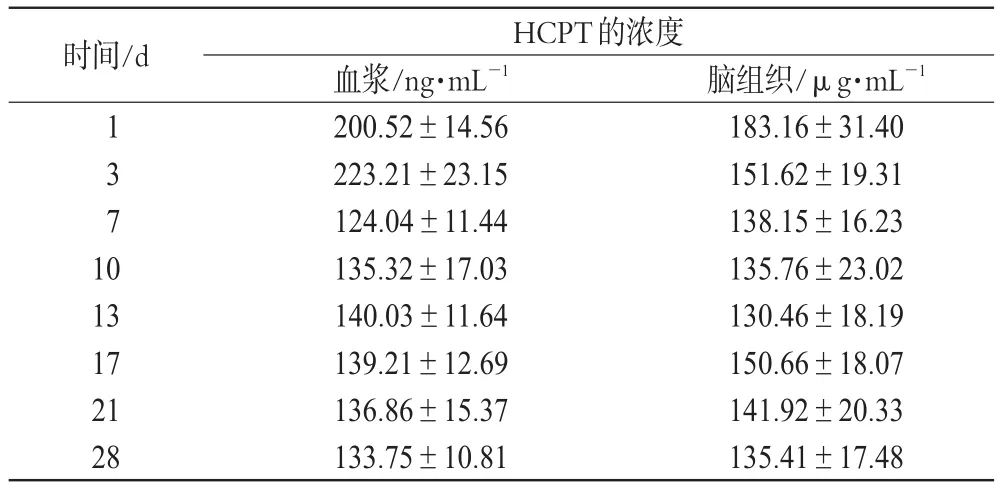
表5 HCPT缓释片在大鼠血浆及脑组织中的药物浓度(x±s,n=5)Tab 5 Concentration of HCPT sustained-release tablets in plasma and cerebral tissue(±s,n=5)
时间/d 1371 0 13 17 21 28 HCPT的浓度血浆/ng·mL-1 200.52±14.56 223.21±23.15 124.04±11.44 135.32±17.03 140.03±11.64 139.21±12.69 136.86±15.37 133.75±10.81脑组织/μg·mL-1 183.16±31.40 151.62±19.31 138.15±16.23 135.76±23.02 130.46±18.19 150.66±18.07 141.92±20.33 135.41±17.48

图2 HCPT缓释片在大鼠脑组织及血浆中的药-时曲线Fig 2 The concentration-time curves of HCPT sustained-release tablets in cerebral tissue and plasma
4.2 HCPT在脑组织中的浓度
在“3.3”项下时间点1、3、7、10、13、17、21、28 d处死大鼠后,将取出残留缓释片后的脑组织用生理盐水冲洗残血,滤纸吸干后称重,匀浆。按“2.1.2”项下方法处理,进样测定,记录色谱,计算脑组织中HCPT浓度。HCPT缓释片在大鼠脑组织中的药物浓度见表5,药-时曲线见图2。
由表5结果表明,HCPT在脑组织中的浓度远高于在血浆中的浓度,在8个时间点测得的HCPT在脑组织中的浓度均高于130 μg·mL-1,最高浓度达到183.16 μg·mL-1,远高于半数有效抑制率(IC50)为135 μg·mL-1时HCPT的浓度,因此,在缓释过程中,脑组织中的HCPT浓度能长时间地保持在IC50以上[6],对脑胶质瘤细胞具有很好的杀灭作用;而HCPT在血浆中的浓度均<223.21 ng·mL-1,远低于在脑组织中的浓度,预示缓释片可降低全身性毒副作用。
5 讨论
本实验对HCPT缓释片的体内释放进行了考察,通过剩余药量法测得HCPT缓释片在大鼠脑内的累积释放率,其结果表明,缓释片在大鼠脑内具有较好的缓释效果,在28 d内,药物从缓释片中平稳、缓慢地释放,累积释放率为72.31%,预示缓释片在脑内的释放时间可达1个月以上;且药物单日内的累积释放率达到12%,脑组织中浓度达(183.16±31.40)μg·mL-1,能够达到首剂有效治疗浓度。
脑内植入缓释片制备的主要目的是使药物能够在脑组织中达到有效治疗浓度而在外周血中的浓度相对较低,以有效提高药物的治疗作用而减小药物的全身性毒副作用。HCPT缓释片植入大鼠脑内后,比较在脑组织中以及外周血中HCPT的浓度,结果表明,HCPT在脑组织中的浓度远高于在外周血中的浓度,预示所制备的HCPT释片能够在大鼠脑内维持有效治疗高浓度,而在外周血浆中浓度较低,从而降低全身性毒副作用,达到脑内植入缓释片的设计目的。
[1]Siepmann J,Siepmann F.Local controlled drug delivery to the brain[J].International Journal ofPharmaceutics,2006,14(3):101.
[2]胡 婧,刘松青.羟基喜树碱缓释片的制备工艺及处方优化研究[J].中国药房,2009,20(22):1 731.
[3]Storm PB,Moriarity JL,Tyler B,et al.Polymer delivery of camptothecin against 9L gliosarcoma:release,distribution,and efficacy[J].Journal of Neuro-oncology,2002,56(3):209.
[4]Beltramini M,Zambenedetti P.The effect of Zn(Ⅱ)and streptozotocin administration in the mouse brain[J].Brain Reserch,2006,11(9):207.
[5]Béduneau A,Saulnier P,Benoit JP.Active targeting of brain tumors using nanocarriers[J].Biomaterials,2007,28(33):4 947.
[6]胡 婧,刘松青.MTT法测定羟基喜树碱对C6胶质瘤细胞增殖的抑制作用[J].中国药房,2008,19(13):982.
