异长春花碱脂质体的制备及其在小鼠体内的组织分布Δ
2012-08-07李学涛赵琳程岚辽宁中医药大学药学院辽宁大连116600
李学涛,赵琳,程岚(辽宁中医药大学药学院,辽宁大连116600)
异长春花碱(Vinorelbine,VRB)是从长春花Catharathus roseus(L)G.Don中提取的一种半合成的长春花生物碱。现代药理研究表明,VRB通过作用于肿瘤细胞微管蛋白而干扰肿瘤细胞代谢,临床主要用于治疗急性淋巴细胞白血病、何杰金病及非何杰金淋巴瘤,也用于乳腺癌、支气管肺癌、软组织肉瘤及神经母细胞瘤等[1]。但由于VRB原料药极难溶于水,而且VRB酒石酸盐注射液在临床应用时具有明显的毒副作用,因此为了提高VRB的水溶性及靶向性,笔者将VRB用脂质体为载体进行包裹。本研究在此基础上采用高效液相色谱法测定了VRB脂质体在小鼠体内的分布,并与普通VRB注射液进行比较。
1 仪器与材料
1.1 仪器
LC-1100液相色谱仪,包括G21771AA-UV检测器、色谱工作站(美国安捷伦科技公司);Mastersizer2000粒径分析仪(英国Malvern Instruments公司);JEM-2000EX透射电子显微镜(日本电子公司);DY89-1型电动玻璃匀浆机(宁波新芝生物科技股份有限公司)。
1.2 试药
VRB对照品(美国Sigma公司,批号:FOC242,纯度:≥99.0%);VRB原料药(海南国栋药业有限公司,批号:20080512,纯度:98.0%);VRB脂质体(辽宁中医药大学自制,批号:091101,规格:0.92 mg·mL-1,包封率:87.5%);VRB酒石酸盐注射液(简称:VRB注射液,法国皮尔法伯制药公司,批号:090802,规格:10 mg·mL-1);盐酸小檗碱对照品(内标,中国食品药品检定研究院,批号:110713-200910,纯度:99%);注射用大豆卵磷脂(上海太伟磷脂有限公司,批号:20080126);胆固醇(上海惠兴生化试剂有限公司,批号:20080113);乙腈为色谱纯,其他试剂均为分析纯。
1.3 动物
Lewis肺癌C57BL/6J荷瘤小鼠,♀♂各半,5~7周龄,体重(20±2)g,购于大连医科大学实验动物中心,合格证号:SCXK(辽)2008-0002。
2 方法与结果
2.1 VRB脂质体的制备
取VRB原料药10 mg、注射用大豆卵磷脂80 mg、胆固醇39 mg溶于10 mL氯仿中,39.5℃下减压旋转蒸发60 min除去氯仿,保持水浴温度39.5℃,将形成的均匀白色薄膜加入10 mL pH7.6磷酸盐缓冲液中,水化30 min,超声20 min(50 kHz),经0.45 μm微孔滤膜滤过,即得[2]。
2.2 VRB脂质体的粒径分布与形态观察
精密移取VRB脂质体0.5 mL,以5%葡萄糖注射液稀释至20 mL,用Mastersizer2000粒径分析仪进行测定,以微粒的个数作为基准,测定其粒径并绘制粒径分布图。结果,所测得微粒的平均粒径为158.3 nm,粒径分布图见图1。采用磷钨酸负染色法观察VRB脂质体微粒的微观形态,移取VRB脂质体0.1 mL,加蒸馏水稀释至5.0 mL,混匀。取稀释后的脂质体溶液1滴,置于特制铜网上,静置5 min,滴加1%磷钨酸负染色,用滤纸吸去多余染色液,在电镜下观察VRB脂质体微粒的形态和大小,并照相,电镜观察照片见图2。
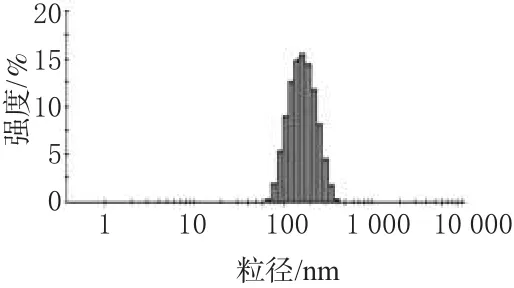
图1 VRB脂质体粒径分布图Fig 1 Particle size distribution of VRB liposomes

图2 VRB脂质体透射电镜图(×20 000)Fig 2 TEMof VRB liposome(×20 000)
2.3 VRB在体内分析方法的建立
2.3.1 色谱条件。色谱柱:C18(250 mm×4.6 mm,5µm);流动相:乙腈-0.06 mol·L-1磷酸二氢钾(用盐酸调pH为3.0)=35∶65,流速:1.0 mL·min-1;检测波长:215 nm;柱温:30 ℃;进样量:20µL;理论板数按VRB色谱峰计算,应不低于3 000[3]。
2.3.2 血浆样品预处理。取小鼠血浆0.5 mL,置于具塞刻度离心管中,加入浓氨水2滴,精密加入内标盐酸小檗碱对照品溶液(0.95 mg·mL-1)30 µL,旋涡振荡10 min,再加入乙醚萃取2次,每次5.0 mL,合并乙醚液,于35℃水浴上N2流下挥干乙醚,残渣加入流动相300 µL超声溶解,4 000 r·min-1离心10 min,精密吸取上清液,即得。
2.3.3 组织样品预处理。小鼠脱颈椎处死后,取小鼠脏器吸干、剔去结缔组织,分别准确称取心、肝、脾、肺、肾、肌肉、脑组织、肿瘤样品约0.1 g(不足者取全部),用高速匀浆器匀浆,用5.0 mL生理盐水分3次冲洗匀浆器,将组织匀浆完全转移至具塞刻度离心管中,按照“2.3.2”项下“加入浓氨水2滴,……精密吸取上清液”操作,即得。
2.3.4 方法专属性考察。取小鼠空白肝脏组织、VRB对照品和加入VRB对照品的肝脏组织,按“2.3.3”项下方法处理后进样测定。结果,组织内源性物质与VRB在“2.3.1”色谱条件下分离良好,内源性杂质无干扰,VRB的保留时间约为16.65 min,色谱见图3。
2.3.5 标准曲线的绘制。分别取小鼠空白组织匀浆1.0 mL或空白血浆0.5 mL于干燥试管中,分别加入不同体积的VRB对照品溶液(1.01 mg·mL-1)于试管中,制备成浓度分别为0.2、0.5、1.0、5.0、10.1、25.3、50.5 µg·g-1或µg·mL-1的不同组织或血浆标准溶液,再按“2.3.2”项下“加入浓氨水2滴,……精密吸取上清液”方法进行操作制成样品,照“2.3.1”项下色谱进样测定。以盐酸小檗碱为内标,计算VRB峰面积和内标峰面积的比值K(AV/AT),以K值与VRB的组织或血浆浓度(c)进行线性回归,得不同组织或血浆的药物标准曲线方程,结果见表1。
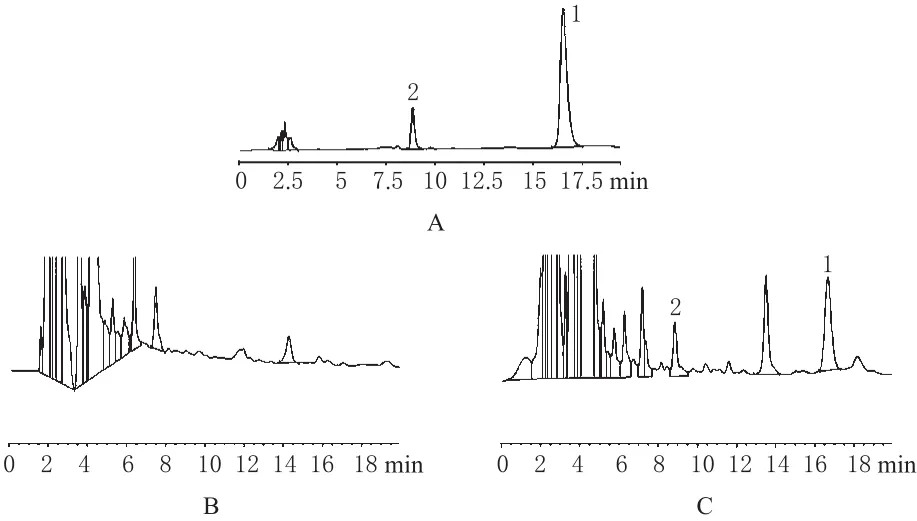
图3 高效液相色谱图A.对照品;B.空白组织;C.给药后肝脏组织;1.VRB;2.盐酸小檗碱Fig 3 HPLC chromatogramsA.reference substance;B.blank tissue;C.liver tissue after medication;1.VRB;2.berberine hydrochloride
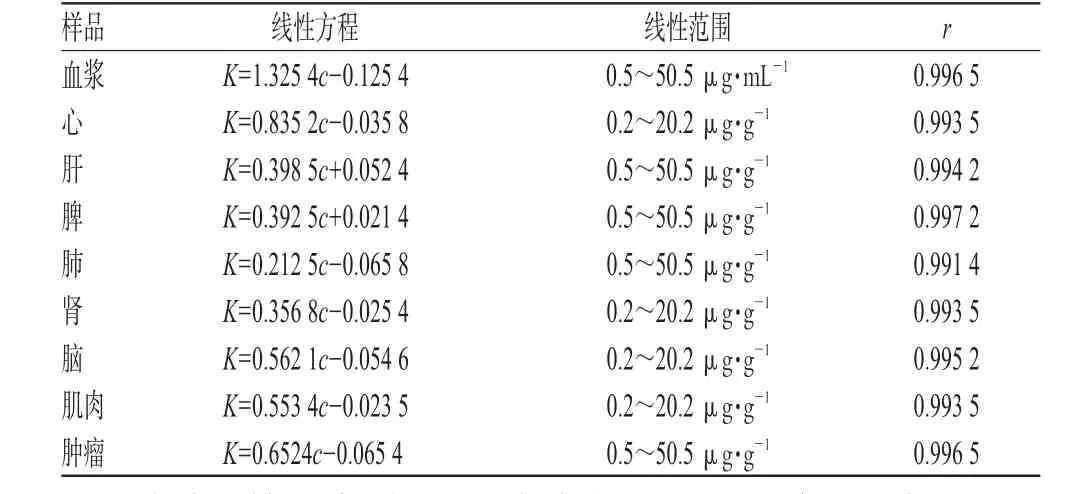
表1 各组织及血浆中VRB的线性方程Tab 1 Regression equation of VRB in different tissues and plasma
由表1结果表明,VRB在小鼠的心、肝、脾、肺、肾、脑、肌肉、肿瘤等组织和血浆中的药物浓度在相应范围内与K值呈良好线性关系。
2.3.6 精密度试验。分别取“2.3.5”项下不同样品,按“2.3.2”和“2.3.3”项下方法处理后,进样测定,同日内测定5次,及每天测定1次、连续测定5 d,计算日内和日间精密度。结果,小鼠不同组织和血浆样品的日内RSD<4.0%,日间RSD<5.0%,满足生物样品的方法学要求。
2.3.7 稳定性试验。分别取“2.3.5”项下不同样品,按“2.3.2”和“2.3.3”项下方法处理后,于0、2、4、6、8 h进样测定,结果RSD<5.0%,表明样品稳定性良好。
2.3.8 提取回收率试验。分别取小鼠空白组织匀浆1.0 mL或空白血浆0.5 mL置于2 mL离心管中,加入VRB对照品溶液并使VRB的组织或血浆浓度为10、5、0.5 µg·g-1或µg·mL-1,按“2.3.2”项下“加入浓氨水2滴,……精密吸取上清液”操作后,进样测定,记录峰面积A1;精密量取VRB对照品溶液(1.01 mg·mL-1),加流动相稀释并制备相应浓度进样测定,记录峰面积A2。以A1/A2×100%计算回收率,结果见表2。
结果表明,各种组织或血浆的3种浓度样品的平均提取回收率均>85.00%,RSD均<5.0%,满足生物样品的方法学要求。

表2 不同浓度VRB脂质体在体外模型小鼠各组织及血浆中的提取回收率试验结果Tab 2 Extraction recoveries of VRB liposomes in different tissues and plasma of model mice in vitro
2.4 药物在小鼠体内组织分布实验
取Lewis肺癌C57BL/6J荷瘤小鼠,♀♂各半,随机分为对照组(VRB注射液)和脂质体组(VRB脂质体),每组24只,尾静脉注射相应药物10 mg·kg-1(根据VRB脂质体的安全性试验结果[4]制订给药剂量)。各组小鼠分别于给药后0.5、2、12 h摘眼球取血,然后处死,立即取心、肝、脾、肺、肾、肌肉、大脑、肿瘤,用生理盐水冲洗干净,滤纸吸干表面水分,准确称取0.1 g,按“2.3.2”和“2.3.3”项下方法处理后测定,检测不同时间组织和血浆中VRB的药物浓度。结果见表3(“-”表示未检出)。
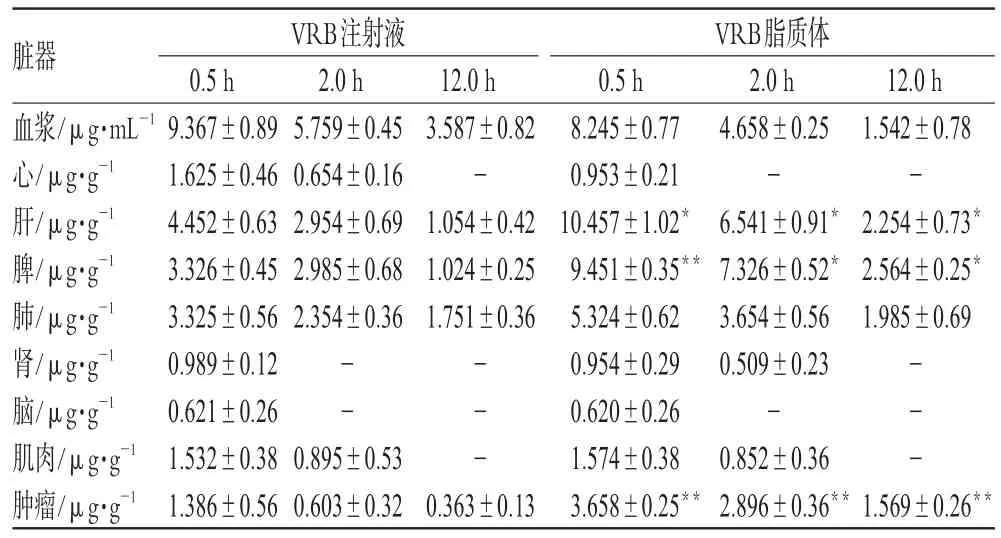
表3 2制剂在模型小鼠体内不同时间的药物组织及血浆分布(n=8)Tab 3 Distribution of VRB preparations in different tissues and plasma of model mice at different time points(n=8)
由表3可知,与同一时间VRB注射液比较,VRB脂质体在肝、脾、肿瘤中的分布均明显增强(P<0.05或P<0.01),其中静脉注射VRB脂质体0.5、2.0、12.0 h后药物主要分布在肝、脾中,并且不同时间点处理样品,药物在各组织中的分布趋势基本一致。该结果可能是由于脂质体微粒激发了机体的免疫系统,单核吞噬细胞系统(MPS)吞噬脂质体微粒,从而使大部分VRB浓集于肝、脾部位。
2.5 靶向性评价
为了更好的阐述VRB脂质体的靶向性,笔者采用靶向性评价参数(cE)来说明。cE=cP(m)/cP(s),式中,cP为药物的浓度,m和s分别表示脂质体和溶液,cE说明该脂质体改变药物分布的效果,cE值越大说明VRB脂质体改变巨噬细胞系统(VEB)分布的效果愈明显[5]。VRB脂质体在模型小鼠体内不同时间的组织靶向性参数比较见表4(“-”表示未检出)。
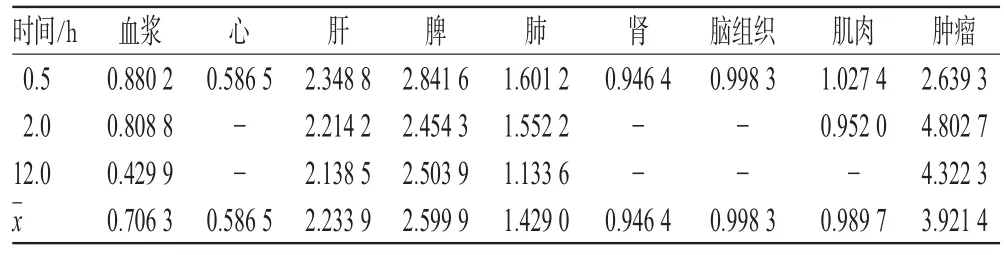
表4 VRB脂质体在模型小鼠体内不同时间的组织靶向性参数比较Tab 4 Drug targeting index of VRB liposomes in model mice at different time points
由表4可知,VRB脂质体在不同时间内对小鼠的肝脏、脾脏组织的靶向性评价参数均大于2.0,表明VRB脂质体在体内具有明显的肝脏、脾脏靶向性,此靶向机制为被动靶向;其中VRB脂质体对肿瘤组织的平均靶向性参数为3.921 4,表明脂质体对小鼠的肿瘤组织有显著的靶向性;VRB脂质体对肺组织的平均靶向性参数为1.429 0,表明脂质体对小鼠的肺组织有一定靶向性;VRB脂质体在其他组织中靶向性参数均小于1.0,说明脂质体制剂可以减少药物在相应组织中的浓度,从而降低药物的毒副作用。
3 讨论
目前,国内外对于VRB含量测定的方法报道较少,仅有少数长春属类生物碱的含量测定。本方法选择盐酸小檗碱作为内标物质,一方面两者均属于生物碱,具有相近的结构;另一方面长春花属的其他生物碱的对照品较难获得,所以本研究选择盐酸小檗碱作为内标物质。结果,该方法操作简便、快捷,精密度和准确度都较好,方法的建立适合于小鼠体内VRB含量的测定。
VRB制成脂质体后,提高了药物在肝、脾、肿瘤组织中的浓度,降低了药物在血、心、大脑、肾、肌肉中的浓度,说明脂质体制剂可以通过减少药物在相应组织中的浓度,从而降低药物的毒副作用。制成脂质体后,VRB在小鼠体内的分布发生了明显变化,脂质体组与注射液组在肝、脾、肿瘤组织中分布具有显著性差异,其中静脉注射脂质体0.5、2.0、12.0 h后药物主要分布在肝、脾和肿瘤组织中。脂质体在肝、脾中的富集可能是由于脂质微粒激发了机体的免疫系统,MPS吞噬脂质体微粒,从而使大部分药物浓集于肝、脾部位;脂质体在肿瘤组织中的富集可能是由于肿瘤细胞所分泌的大量血管生长因子,使肿瘤组织附近形成丰富的血管网,该血管网中的微血管形状构造不规则、膨胀、管壁缺失、内皮细胞排列疏松,增加了血管壁的渗漏性和通透性,故脂质微粒较易渗入肿瘤部位而达到对肿瘤的靶向定位。
[1]祖元刚,罗 猛.长春花生物碱成分及其药理作用研究进展[J].天然产物研究与开发,2006,18:325.
[2]李志浩,李 鹏,郑 芳,等.白术内酯Ⅰ脂质体的制备工艺[J].中国药师,2010,13(4):473.
[3]李学涛,程 怡,时 军.HPLC法测定异长春花碱静脉注射乳剂中主药的含量[J].中国药房,2009,20(34):2 707.
[4]程 岚,李学涛,唐 凌.异长春花碱脂质体的制备及安全性评价[J].中国实验方剂学杂志,2011,20(17):241.
[5]张阳德,张 洋,潘一峰,等.槲皮素脂质体纳米粒在大鼠体内的分布研究[J].中国医学工程,2007,15(4):305.
