通用黏膜免疫佐剂的制备
2012-07-31李志会岳盈盈宋楠楠曹银光
李志会,李 鹏,岳盈盈,宋楠楠,纪 璇,曹银光,孟 红
(1山东省医学科学院基础医学研究所,山东省罕少见病重点实验室,济南 250062;2聊城市人民医院)
研究表明黏膜接种是敏感、有效、简便、安全的免疫途径,但黏膜途径用药存在免疫原性差、在低pH和肠道酶作用下会发生降解、口服吸收率低,单独使用无法产生有效的免疫保护反应等缺点,因此寻找高效、安全、适宜的黏膜佐剂成为黏膜疫苗研发中的关键问题。2010年5月至2011年7月,我们采用同源重组技术制备通用黏膜免疫佐剂,旨在解决当前黏膜途径免疫缺乏安全有效免疫佐剂的问题。
1 材料与方法
1.1 材料 质粒pDG1662和枯草芽胞杆菌1A771购自Ohio公司,pET30a-SPA质粒由山东省罕少见病重点实验室构建并保存[1],克隆载体pMD18-T和pfu DNA聚合酶购自大连宝生物工程有限公司,DNA凝胶回收试剂盒与质粒提取试剂盒购自北京天根生化科技有限公司,限制性内切酶购自立陶宛Fermentas公司,人源免疫球蛋白IgG购自北京索莱宝科技有限公司,异硫氰酸酯荧光素标记兔抗人IgG购自武汉博士德生物工程有限公司,化学试剂均购自国药集团化学试剂有限公司。
1.2 通用黏膜免疫佐剂制备方法
1.2.1 AB融合基因构建 根据葡萄球菌A蛋白(SPA)A功能域基因序列用Primer Premier 5.0软件设计引物:A1:5'AAGCTTGGTGAAGCTCAAAAACTTAATGACT-3';A2:5'CTCGAGTAAAACGTTAGTGCTTTGGCTT-3'(目的片段长189 bp,斜体为酶切位点)。链球菌G蛋白(StreptococcalProteinG,SPG)B2功能域全长178 bp,由上海博亚生物有限公司合成,前后分别引入XhoⅠ/BamHⅠ酶切位点,PCR鉴定SPG引物序列:G1:5'ACTTACAAACTTGTTATTAATGGTCT-3';G2:5'TTCA GTTACCGTAAAGGTCTTAGT-3'。引物均由上海博亚生物有限公司合成。以pET30a-SPA质粒[2]为模板,A1/A2为引物调取A功能域,1.0%琼脂糖凝胶电泳后回收目的片段,测序正确后提取质粒双酶切与SPG B2功能域连接并测序。
1.2.2 pDG1662-CotB质粒构建 根据枯草芽胞杆菌芽胞衣蛋白CotB基因序列,用Primer Premier 5.0软件设计引物如下:B1:5'-GAATTCGAATCCGAGTTTCGCAAGTCCT-3';B2:5'-AAGCTTGATGATT GATCATCTGAAGAT-3'(目的片段长1 305 bp,包含CotB的启动子及部分编码序列,斜体为酶切位点),由上海博亚生物有限公司合成。以枯草芽胞杆菌1A771基因组为模板调取目的基因。扩增产物进行1.0%琼脂糖凝胶电泳,DNA凝胶回收目的片段,将上述目的片段连接到pMD18-T载体得到质粒pMD18-CotB进行测序,测序正确后EcoRⅠ/HindⅢ双酶切连接到同样双酶切的pDG1662质粒。
1.2.3 pDG1662-CotB-AB 质粒构建 测序正确的质粒 pUC57-AB、pDG1662-CotB分别用 HindⅢ/BamHⅠ双酶切,回收目的片段并连接得到质粒pDG1662-CotB-AB,将所得质粒分别用BamHⅠ/XhoⅠ、XhoⅠ/HindⅢ、EcoRⅠ/HindⅢ、HindⅢ/BamHⅠ及EcoRⅠ/BamHⅠ双酶切鉴定。
1.2.4 质粒转化 挑取一环菌液接种于5 mL生长培养基中,过夜培养种子液。将种子接种于80 mL生长培养基中,37℃摇床震荡培养3 h。冰水浴冷却培养物10 min,4℃、5 000 g,离心5 min收集菌体。反复用冰冷的电击缓冲液洗涤细胞4次。用2 mL的电击缓冲液重新悬浮细胞收集物,即为枯草芽胞杆菌感受态细胞。将提取的质粒pDG1662-CotBAB用NdeⅠ酶切线性化后加入到感受态细胞混匀并转移到冰冷的电转化杯中,冰浴1.5 min。1 800 V电击2次后,立即加入1 mL复苏培养基。37℃摇床震荡培养3 h后,将复苏物涂布在氯霉素抗LB平板上,37℃培养。
1.2.5 重组菌筛选 于转化后的氯霉素抗性LB平板上挑取单菌落,氯霉素抗性LB培养基37℃摇床震荡培养过夜,将菌液1∶100接种于红霉素抗性LB培养基中,37℃摇床震荡培养过夜。对红霉素敏感而抗氯霉素的菌株为正确重组菌株。
1.2.6 重组菌鉴定 ①PCR法:取一环菌液接种到10 mL氯霉素抗性LB液体培养基中,37℃摇床震荡培养过夜,8 000 g离心5 min收集菌体,用pH 7.0的PBS缓冲液重悬菌体后加入终浓度1 mg/mL的溶菌酶,混匀37℃孵育40 min,8 000 g离心5 min收集菌体,TE缓冲液重悬后加终浓度50 mg/mL蛋白酶K及1%SDS,37℃水浴2 h,加等体积的中性酚/氯仿,振荡30 s,12 000 g离心5 min,上清加1/10体积的3M醋酸钠溶液和等体积的异丙醇,混匀。室温放置5 min,12 000 g离心5 min,沉淀物用70%乙醇洗2遍,干燥后溶于TE缓冲液即为基因组溶液,野生菌株做同样处理。以基因组为模版,以 B1-B2、A1-G2、B1-G2为引物,PCR扩增产物1.0%琼脂糖凝胶电泳观察结果。②免疫荧光法:重组菌置于氯霉素抗性LB液体培养基中37℃摇床震荡培养48 h后于室温静置24 h使芽胞充分生成,12 000 g离心5 min收集芽胞,将收集的芽胞用PBS洗3次,与人源免疫球蛋白IgG于37℃摇床轻微震荡共孵育1 h,PBST洗芽胞3次,PBS重悬芽胞与FITC标记兔抗人IgG,37℃摇床轻微震荡共孵育1 h,PBST洗芽胞3次后涂玻片,野生菌株做同样处理,于荧光显微镜下观察结果。
2 结果
2.1 AB融合基因构建 PCR产物电泳显示大小约为189 bp处有阳性条带(图1),与预期一致,表明成功调取SPA的A功能域。将目的片段与连接到合成的SPG的B2功能域上游后测序正确,从而得到质粒pUC-AB。
2.2 CotB目的基因调取 PCR产物电泳显示大小约为1 305 bp(图2)处出现阳性条带,与预期一致,表明成功调取CotB基因,将目的片段连接到pMD18-T载体后测序正确,从而得到质粒pMD18-CotB。
2.3 重组质粒构建 质粒pMD18-CotB和pUC57-AB分别用EcoRⅠ/HindⅢ及HindⅢ/BamHⅠ双酶切得到目的片段CotB及AB,顺序插入pDG1662中得到pDG1662-CotB-AB质粒。pDG1662-CotB-AB质粒用 BamHⅠ/XhoⅠ、XhoⅠ/HindⅢ、EcoRⅠ/HindⅢ、HindⅢ/BamHⅠ及EcoRⅠ/BamHⅠ双酶切产物电泳在 189 bp、178 bp、1 305 bp、367 bp、1 672 bp大小出现目的条带(图3),与预期一致,表明已成功将CotB和AB基因融合构建到质粒pDG1662中。
2.4 重组菌鉴定 PCR法结果显示,电泳出现约1 305 bp、367 bp、1 672 bp 大小的目的片段(图 4),表明AB融合基因成功重组到枯草芽胞杆菌基因组中。免疫荧光法显示人、小鼠源IgG组重组菌出现强荧光信号,而对照菌无绿色荧光出现,表明IBP功能域成功展示在芽胞表面,并且能与人源免疫球蛋白特异结合,具有良好的生物活性。

图1 SPA的A片段调取电泳图
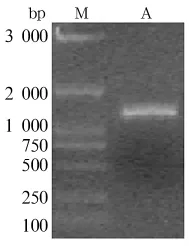
图2 CotB片段调取电泳图

图3 重组质粒双酶切电泳图
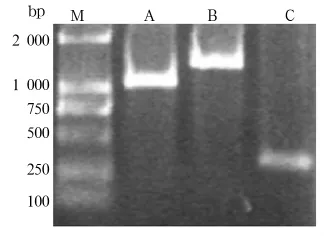
图4 pDG1662-CotB-AB质粒PCR鉴定电泳图
3 讨论
疫苗接种在感染性疾病的防控中发挥着举足轻重的作用,而黏膜途径接种疫苗具有无创伤、无毒副作用等优点,成为当前的研究热点。Mauriello等[3]采用CotC为融合表达载体蛋白展示了TTFC及LT,用黏膜途径免疫小鼠诱导了全身及黏膜特异性抗体;Duc等[4]对枯草芽胞杆菌芽胞的免疫特性以及在细胞内的归宿研究显示,芽胞可诱导机体产生局部免疫和系统免疫反应,该课题组以CotB-TTFc重组芽胞口服、鼻腔免疫小鼠,证实小鼠能产生特异性抗体,可抵抗致死剂量破伤风毒素的攻击。有学者采用痢疾菌苗经滴鼻途径免疫小鼠,发现能有效激发鼻黏膜局部分泌抗原特异性IgA、IgG升高,可诱发远离免疫诱导部位的胃肠黏膜和生殖道黏膜分泌抗原特异性IgA、IgG升高及血清中抗原特异性IgA、IgG升高,表明共同黏膜免疫系统的存在[5],同时说明鼻黏膜是敏感有效、简便安全的免疫途径。大量研究发现枯草芽胞杆菌芽胞能诱导机体产生特异性局部免疫和系统免疫反应,表明枯草芽胞杆菌芽胞是黏膜免疫的一个有效载体;另有研究显示,芽胞表面展示抗原比芽胞萌时展示的抗原诱导能力更加有效[6]。
本研究从前期构建的pET30a-SPA质粒中调取A功能域,全序列合成SPG B2功能域,并将两者连接后与枯草芽胞杆菌芽胞衣蛋白CotB基因连接插入整合质粒pDG1662,通过同源重组将CotB-AB基因整合入枯草芽胞杆菌基因组,进而将免疫球蛋白结合蛋白(IBP)功能域展示在枯草芽胞杆菌芽胞表面,经抗生素抗性筛选后提取基因组,以基因组为模板经PCR鉴定表明AB融合基因成功重组到枯草芽胞杆菌基因组中。免疫荧光试验中人源免疫球蛋白IgG组具有明显的荧光信号,而对照组无荧光,说明该IBP融合功能域成功在芽胞表面表达,且具有与人源免疫球蛋白IgG的亲和活性。本研究成功制备了通用黏膜免疫佐剂奠定了基础,且在IgG纯化中具有一定的应用前景及价值。
[1]岳盈盈,李志会,李鹏,等.肠道病毒71型结构蛋白VP1的原核表达及初步鉴定[J].山东医药,2011,51(7):22-24.
[2]李志会,岳盈盈,李鹏,等.金黄色葡萄球菌蛋白A的原核表达及生物亲和特性的研究[J].山东大学学报(医学版),2009,47(10):28-31.
[3]Mauriello EM,Duc lH,Isticato R,et al.Display of heterologous antigens on the Bacillus subtilis spore coat using CotC as a fusion partner[J].Vaccine,2004,22(9-10):1177-1187.
[4]Due LH,Hong HA,Uyen NQ,et al.Intracellular fate and immunogenicity of B.subtilis spores[J].Vaccine,2004,22(15-16):1873-1885.
[5]舒翠莉,彭虹,王华,等.滴鼻免疫有效的诱导粘膜及系统免疫反应[J].微生物学免疫学进展,2001,29(4):40-44.
[6]Uyen NQ,Hong HA,Cutting SM.Enhanced immunisation and expression strategies using bacterial spores as heat-stable vaccine delivery vehicles[J].Vaccine,2007,25(2):356-365.
