NF-κB与Caspase-9在胃癌组织中的表达及临床意义
2012-07-31程善光季万胜
王 敏,程善光,季万胜
(潍坊医学院附属医院,山东潍坊 261031)
核因子-κB(NF-κB)是一种具有多向性转录调节功能的蛋白,在许多恶性肿瘤中均有高表达[1,2],与肿瘤细胞的增殖、分化、侵袭和转移等密切相关。Caspase-9是一种促凋亡因子,是内源性细胞凋亡传导通路中最重要的凋亡启动因子,其活化能启动级联激活反应而促进细胞凋亡[3]。2010年1月~2010年11月,我们采用免疫组化法检测了NF-κB与Caspase-9在胃癌组织中的表达,并分析其与临床病理特征的关系,旨在探讨其在胃癌发生发展中的作用。
1 材料与方法
1.1 材料 同期行手术切除并经病理证实的胃癌组织标本68份(胃癌组),患者男48例,女20例,年龄20~79岁,中位年龄59.5岁。根据WHO分类标准,低分化/Ⅲ级胃癌23例,高、中分化/Ⅰ、Ⅱ级胃癌45例;有淋巴结转移38例,有浆膜浸润40例。患者术前均未行化疗、放疗和免疫治疗。另取距离癌灶5 cm以上癌周正常组织作为癌旁组。
1.2 NF-κB、Caspase-9表达检测 所有组织标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,制备4 μm厚连续切片,采用免疫组化法检测NF-κB和Caspase-9表达。兔抗人Caspase-9抗体、兔抗人NF-κBp65抗体均购于武汉博士德公司,PV-9000二步法所用免疫组化检测试剂及DAB显色试剂盒购于北京中杉生物科技有限公司,严格按说明书操作,用已知的阳性片做阳性对照,以PBS代替一抗作为阴性对照。结果判定:NF-κB、Caspase-9阳性表达为细胞质和/或胞核染成棕褐色或棕黄色。随机抽取有代表性的10个连续的高倍视野(×400倍),每个视野计数100个细胞,均值为该切片的积分值。根据染色强度及阳性细胞比例进行综合评分。染色强度评分:无色为0分,浅黄为1分,棕黄为2分,棕褐为3分;阳性细胞百分比评分:<5%为0分,5% ~25%为1分,26% ~50%为2分,>50%为3分。染色强度与阳性细胞百分比的乘积≤1分为阴性,≥2分者为阳性[4]。分析 NF-κB、Caspase-9 表达与胃癌临床病理特征的关系及二者表达的相关性。
1.3 统计学方法 采用SPSS11.5统计软件包进行数据处理,采用 Fisher确切概率法和 χ2检验及Spearman等级相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 NF-κB及 Caspase-9表达 胃癌组及癌旁组NF-κB 阳性率分别为 63.2%(43/68)、33.3%(23/68);Caspase-9阳性率分别为 36.8%(25/68)、80.9%(55/68),P 均 <0.05。
2.2 NF-κB和Caspase-9表达与胃癌临床病理特征的关系 见表1。
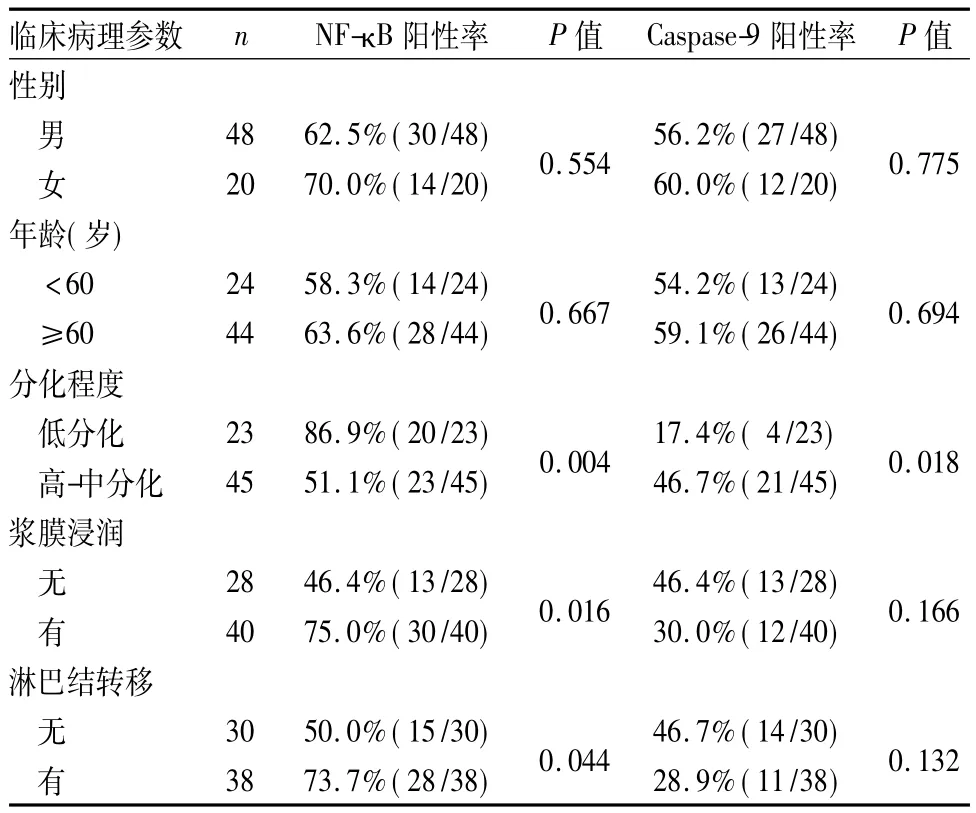
表1 NF-κB和Caspase-9表达与胃癌临床病理参数的关系
2.3 NF-κB、Caspase-9在胃癌组织中表达的相关性胃癌组NF-κB表达阳性的43例组织中Caspase-9蛋白表达阳性11例,25例阴性表达NF-κB的组织中14例Caspase-9蛋白表达阳性,经Spearman等级相关分析,NF-κB和Caspase-9的表达呈负相关(r=-0.304,P=0.025)。
3 讨论
NF-κB是调节细胞基因转录的关键因子,参与多种凋亡相关基因的转录调控,在肿瘤的发展过程中发挥重要作用[5]。其激活最常见的形式为p50和p65组成的二聚体,在非激活条件下,NF-κB与抑制因子IκB相结合而处于无活性状态。当细胞受到细胞因子、肿瘤坏死因子(TNF)等多种刺激时,IκB发生磷酸化和泛素化并随后降解,NF-κB被激活并与IκB分离,活化的NF-κB从胞质转移至胞核,定位于细胞核而不能返回胞质,与靶基因上启动子或增强子的κB基因序列发生特异性结合,调控一系列肿瘤相关基因的转录表达,抑制肿瘤细胞凋亡、促进血管生成与局部浸润[6]。通常认为,NF-κB在癌症的早期事件中通过刺激恶性细胞生长参与细胞恶性转化而促进癌症的发生;在癌症晚期发展中,NF-κB作为调节因子也发挥一定作用,如NF-κB可上调 COX-2、MMP-7表达,促进肿瘤血管生成和转移[7]。Sasaki等[8]对胃癌组织及癌旁组织进行免疫组化和RT-PCR分析,发现NF-κB的活性与淋巴结转移、浸润深度、腹膜转移、肿瘤体积等临床病理特点有关,与胃癌患者的存活时间呈负相关。本研究结果表明,NF-κB在胃癌组织中的表达率显著高于癌旁组织,其表达与胃癌的组织学分型、浸润深度及淋巴结转移密切相关,即随着分化减低、浸润深度的增加体积,淋巴结转移,NF-κB的表达明显升高,此与Sasaki等报道的结果相符,说明NF-κB能够促进胃癌的发生、发展、侵袭及转移,并可以对胃癌的预后进行预测。
Caspase是一个半胱氨酸蛋白酶家族,是执行细胞凋亡的主要酶类,通常情况下以无活性的酶原形式存在于细胞中,在细胞线粒体依赖的凋亡传导途径中,Caspase-9属于启动型Caspase,位于细胞凋亡传导通路的上游,当凋亡起始信号作用于线粒体后,引起线粒体释放细胞色素C,与凋亡蛋白酶活化因子(Apaf-1)结合并使其构象改变形成活性复合体,后者与Caspase-9结合并诱导其发生自身活化,活化后又能激活下游的Caspase因子,启动细胞凋亡级联反应,从而导致细胞凋亡。由于Caspase可以自我活化并能够相互激活,因此凋亡过程一旦触发,即呈级联放大效应。Park等[9]研究 MMC介导的SUN-16人胃癌细胞株凋亡时发现,Caspase-9在肿瘤细胞的凋亡过程中发挥了重要作用。Caspase-9蛋白低表达时细胞凋亡受到抑制的机制可能是Caspase-9蛋白表达下降,其激活下游Caspase因子的能力降低,从而使细胞凋亡减少,细胞凋亡和增殖平衡被打破,胃癌则可能发生。本研究结果表明,Caspase-9在胃癌组织中的表达率明显低于癌旁组,且分化程度越差其表达率越低,但与浸润深度和有无淋巴结转移无明显关系。表明Caspase-9表达与胃癌的恶性程度有关,Caspase-9是正常分化细胞所具有的,正常细胞向癌细胞转化的过程中易失去某些表型,因而我们认为Caspase-9随着分化降低而表达减少,是肿瘤异常分化的结果。
本研究还发现NF-κB和Caspase-9在胃癌组织中表达呈负相关。说明NF-κB能够通过某种途径抑制Caspase 9的表达,从而抑制细胞凋亡。可以认为胃癌细胞在NF-κB的作用下增殖、分化乃至转移,在此过程中,Caspase-9作为影响细胞凋亡的过程因子,也起着不可或缺的作用。
总之,胃癌组织中存在 NF-κB高表达及Caspase-9低表达,且 NF-κB对 Caspase-9具有负性调节作用,可以进一步抑制细胞凋亡,共同促进胃癌的发生发展。进一步深入研究两种因子与胃癌的关系,可为揭示胃癌的发病机制提供新的思路。
[1]Sethi G,Sung B,Aggarwal BB.Nuclear factor-kappa B activation:from bench to bed side[J].Exp Biol Med(Maywood),2008,233(1):21-31.
[2]Ng CS,Novick AC,Tannenbaum CS,et al.Mechanisms of immune evasion by renal cell carcinoma:tumor-induced T-lymphocyte apoptosis and NF kappaB suppression[J].Urology,2002,59(1):9-14.
[3]Green DR,Reed JC,Mitochondria and apoptosis[J].Science,1998,281(5381):1309-1312.
[4]Romieu-Mourez R,Landesman-Bollag E,Seldin DC,et al.Roles IKK kinases and protein kinase CK2 in activation of nuclear factorκB in breast cancer[J].Cancer Res,2001,61(9):3810-3818.
[5]Loercher A,Lee TL,Ricker JL,et al.Nuclear factor-kappa B is an important modulator of the altered gene expression profile and malignant phenotype in squamous cell carcinoma[J].Cancer Res,2004,64(18):6511-6523.
[6]Bharti AC,Aggarwal BB.Nuclear factor-kappa B and cancer:its role in prevention and therapy[J].Biochem Pharmacol,2002,64(5-6):883-888.
[7]Yu HG,Zhong X,Yang YN.Increased expression of nuelear factorkappaB is correlated with tumor angiogenesis in human colorectal cancer[J].int J Colorectal Dis,2004,19(l):18-22.
[8]Sasaki N,Morisaki T,Hashizume K,et al.Nuclear factor-kappa B p65(RelA)translation factor is constitutively activated in human gastric carcinoma tissue[J].Clin Cancer Res,2001,7(12):4136-4142.
[9]Park JC,Park MJ,Hwang CS,et al.Mitomycin C induces apoptosis in a caspases-dependent and Fas/CD95-independent manner in human gastric adenocarcinoma cells[J].Cancer Lett,2000,158(2):125-132.
