秦皮乙素对人肝癌HepG2细胞体外增殖的影响及机制探讨
2012-07-31
(辽宁医学院附属第一医院,辽宁锦州 121000)
秦皮是具有很大开发利用价值的地道中药材,其主要成分为香豆素类化合物,其中秦皮乙素在秦皮中含量为0.126% ~1.738%[1]。研究发现,秦皮乙秦在体外对A549肺癌细胞、黑色素瘤细胞、人T淋巴细胞性白血病细胞以及人胃癌细胞等均有抑制作用,可促进HL-60细胞凋亡;其在体内外对鼠类的巨噬细胞和淋巴细胞的免疫调节作用可能是其体内抗肿瘤的作用机制之一[2]。我们前期研究发现,秦皮乙素对人肝癌细胞SMMC-7721有促凋亡作用,但其对人肝癌HepG2细胞体外增殖的作用鲜见报道。2010~2011年,我们观察了秦皮乙素对人肝癌细胞HepG2体外增殖的影响,旨在为该药进一步的开发研究提供理论基础。
1 材料与方法
1.1 材料 人肝癌HepG2细胞(辽宁医学院科学实验中心)。秦皮乙素(中国药品生物制品鉴定所,批号:110741-200506),5-氟脲嘧啶(5-Fu,天津金耀氨基酸药业,10 mL:0.25 g,批号:20101205)。兔抗人Bax抗体(SANTA CRUZ公司,型号:SC-526),兔抗人 Bcl-2抗体(SANTA CRUZ公司,型号:SC-429)。兔抗人Caspase-9抗体(博奥森公司,型号:BS-0049R)。兔抗人Caspase-3抗体(博奥森公司,型号:BS-0081R)。Caspase 3、Caspase 8、Caspase 9活性检测试剂盒(碧云天生物技术研究所);线粒体膜电位检测试剂盒(JC-1,碧云天生物技术研究所);Annexin V-FITC凋亡试剂盒(北京宝赛生物公司);胰蛋白酶(Hyclone公司);小牛血清(杭州四季清生物制品公司);DMEM培养基干粉(GIBCO公司);四甲基偶氮唑蓝(Amresco公司)。其他试剂为国产分析纯。荧光显微镜(LEICACTR4000,德国),XD-101型倒置显微镜(OLYMPUS TOKYO JAPAN),流式细胞仪(BD FACSCaLibur),YG-875B无菌超净工作台(上海医疗器械厂),CO2培养箱(Sheldon Manufacturing IncUSA),酶标仪(9602A,北京普朗),IBO X600活体成像系统(USA)。
1.2 实验方法
1.2.1 细胞培养 人肝癌细胞 HepG2培养于含15%小牛血清的DMEM高糖培养液中,37℃,5%CO2传代培养,每2~3天换液1次,取对数生长期细胞按每孔1×104个接种于96孔板,分为对照组、5-Fu组及秦皮乙素组。
1.2.2 细胞干预及细胞增殖抑制率检测对照组不干预,5-Fu组予0.77 mmol/L的5-Fu干预,秦皮乙素组分别予 0.56 、1.12、2.24、4.48、8.96 mmol/L 的秦皮乙素干预[3],每组5个平行复孔。干预后培养24 h。细胞增殖抑制率检测采用MTT比色法,测定490 nm波长处吸光度值(OD值)。细胞增殖抑制率=(1-实验组OD值/阴性对照组OD值)×100%。
1.2.3 细胞干预及细胞凋亡率检测 对照组不干预,5-Fu组予浓度为0.77 mmol/L的5-Fu干预,秦皮乙素组分别予2.24、4.48 mmol/L的秦皮乙素干预。干预后培养24 h,0.25%胰酶消化、收集细胞后1 000 g离心5 min,加入195 μL Annexinv-FITC 结合液重悬细胞,加入10 μL碘化丙啶染色液轻轻混匀,冰浴避光放置。流式细胞仪Bioconsort专用软件处理计算细胞凋亡率[3]。
1.2.4 细胞干预及线粒体膜电位检测 对照组不干预,5-Fu组予浓度为0.77 mmol/L的5-Fu干预,秦皮乙素组分别用 1.12、2.24、4.48 mmol/L 的秦皮乙素干预。干预后培养24 h,流式细胞仪绿色荧光法测定细胞百分率,即线粒体膜电位[4]。
1.2.5 细胞干预及Caspase酶活性检测 细胞干预同1.2.4,分光光度法检测Caspase酶活性。收集细胞后600 g、4℃离心5 min,小心吸除上清,PBS洗涤1次。冰浴裂解细胞15 min。96孔板中每孔加入检测缓冲液 60 μL,待测样品30 μL,底物 Ac-IETD-ρNA10 6 mL,37 ℃孵育 3 h,405 nm 处测定样品吸光值,样品吸光值减去对照组吸光值即为样品中Caspase催化产生ρNA的吸光度值。通过标准曲线计算 Caspase 3、Caspase 8,Caspase 9 活性[5]。ρNA标准曲线制定:按照40 μL裂解液加入60 μL检测缓冲液的比例配制标准品稀释液,将标准品稀释为 0、10、20、50、100、200 μmol/L,每个浓度取 100 μL用酶标仪进行检测,每个标准品的A405减去不含ρNA的空白对照的A405,计算出实际因ρNA而导致的吸光度,并制作出ρNA浓度相当于A405的标准曲线。
1.2.6 细胞干预及 Bax、Bcl-2、Caspase-9 蛋白表达测定 盖玻片先行防脱片处理(二甲苯12 h,丙酮3 h,无水乙醇24 h,70%乙醇30 min,双蒸水煮1 h);载玻片事先泡酸24 h;六孔板做细胞爬片。细胞分组及干预同1.2.3。干预后培养48 h,10%福尔马林固定30 min,PBS洗3次,30%H2O2和甲醇混合,室温浸泡15 min,蒸馏水洗3次,滴加3%BSA封闭液25 min,加入1∶500稀释的一抗,4℃过夜。加入1∶200稀释的二抗,37℃避光孵育20 min,封片。免疫荧光法检测Bax、Bcl-2、Caspase-9蛋白表达:采用Image Pro Plus软件进行处理分析,自动计算出平均荧光强度。计算公式:图片的像素面积(像素)×图片平均光密度(光强度/像素)/AOI像素面积(像素)。
1.3 统计学方法 采用SPSS17.0统计软件行统计学处理。计量资料以±s表示,行t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 细胞增殖抑制率 各组细胞增殖抑制率比较见表1。
表1 各组细胞增殖抑制率比较(n=5,±s)

表1 各组细胞增殖抑制率比较(n=5,±s)
注:与对照组比较,★P <0.05,△P <0.01
组别 OD值 抑制率(%)5-Fu 组 0.512 ±0.09★37秦皮乙素组0.56 mmol/L 0.715 ±0.11★ 12 1.12 mmol/L 0.577 ±0.04★ 29 2.24 mmol/L 0.463 ±0.18△ 43 4.48 mmol/L 0.358 ±0.12△ 56 8.96 mmol/L 0.252 ±0.06△ 69对照组0.813 ±0.16 0
2.2 细胞凋亡率 各组细胞凋亡率比较见表2。
2.3 线粒体膜电位 各组细胞膜电位比较见表3。由表3可见,随秦皮乙素作用浓度增加,HepG2细胞线粒体膜电位下降,呈浓度依赖性。
2.4 Caspase酶活性 不同浓度秦皮乙素处理24 h后,Caspase 3、Caspase 9活性增高,Caspase 8活性无明显变化。ρNA浓度相当于 A405的标准曲线:Caspase 3:Y=0.0051X+0.0484,R2=0.9948;Caspase 8:Y=0.0034X+0.0374,R2=0.99434;Caspase 9:Y=0.0037X+0.03,R2=0.9905。
表2 各组细胞凋亡率比较(n=5,%,±s)

表2 各组细胞凋亡率比较(n=5,%,±s)
注:与对照组比较,★P <0.01
组别 凋亡率5-Fu 组 15.24 ±0.41★秦皮乙素组2.24 mmol/L 17.39 ±0.67★4.48 mmol/L 26.12 ±0.59★对照组1.15 ±0.052
表3 各组细胞膜电位比较(n=5,%,±s)
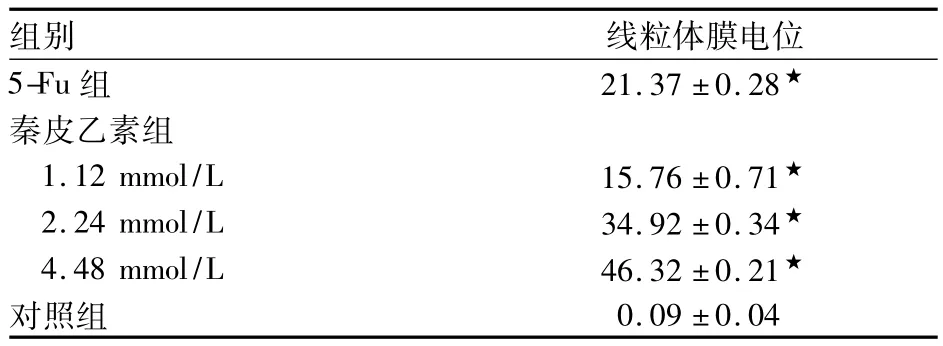
表3 各组细胞膜电位比较(n=5,%,±s)
注:与对照组比较,★P <0.01
组别 线粒体膜电位5-Fu 组 21.37 ±0.28★秦皮乙素组1.12 mmol/L 15.76 ±0.71★2.24 mmol/L 34.92 ±0.34★4.48 mmol/L 46.32 ±0.21★对照组0.09 ±0.04
2.5 Bax、Bcl-2、Caspase-9蛋白表达 见表4。
表 4 各组 Bax、Bcl-2、Caspase-9 蛋白表达(n=5, ±s)

表 4 各组 Bax、Bcl-2、Caspase-9 蛋白表达(n=5, ±s)
注:与对照组比较,★P <0.01;与2.24 mmol/L 比较,△P <0.05
组别Bax Bcl-2 Caspase-9 5-Fu 组 117.62 ±5.16★ 96.15 ±3.86★ 100.67 ±2.48★秦皮乙素组2.24 mmol/L 139.71 ±10.52★ 110.9 ±8.76★ 124.57 ±6.14★4.48 mmol/L 165.67 ±3.74★△ 98.27 ±3.94★△ 145.61 ±3.95★△对照组83.14 ±3.25 159.21 ±5.48 63.01 ±5.14
3 讨论
中药诱导肝癌细胞凋亡是一个新兴的课题,揭示其作用机制、筛选抗肿瘤新药为当前研究热点。
细胞凋亡(程序性细胞死亡)途径有膜受体通路和线粒体通路,它们之间既相互联系又相对独立,Caspase等蛋白酶水解系统是凋亡过程的核心。膜受体通路可形成凋亡诱导复合物,引起Caspase-8聚集,再作用于Caspase-3引起细胞凋亡;线粒体通路为线粒体膜电位改变,可释放细胞色素C,激活Caspase-9及Caspase-3引起细胞凋亡。线粒体膜电位降低是细胞凋亡过程中的首要事件,一旦线粒体跨膜电位发生变化,细胞凋亡将不可逆转。在线粒体凋亡通路中,线粒体是细胞凋亡的关键元件,线粒体膜的完整性由线粒体跨膜电位来维持,跨膜电位降低时,膜的通透性改变,引起细胞凋亡。本研究结果证实,秦皮乙素可抑制人肝癌HepG2细胞增殖,导致线粒体膜电位下降,呈剂量依赖性;表明秦皮乙素可能通过线粒体途径诱导人肝癌 HepG2 细胞凋亡[6~8]。
Caspase-9和Caspase-3是线粒体凋亡通路中两个重要的Caspase分子。Caspase-9是线粒体凋亡通路中上游凋亡起始的重要信号分子,活化的Caspase-9激活其下游的Caspase-3,而对Caspase-8无激活作用。Caspase-3活性增高继而引起Caspase级联反应,启动线粒体途径诱导细胞凋亡。本研究分光光度法检测结果显示,秦皮乙素作用24 h后,Caspase-9和Caspase-3活性增高,而Caspase-8的活性无明显变化;免疫荧光法结果显示,Caspase-9表达增强。进一步证实秦皮乙素可能通过线粒体途径诱导人肝癌HepG2细胞凋亡[9]。
Bax和Bcl-2是细胞凋亡过程中两个重要的凋亡调控因子。Bax主要分布于线粒体外膜上,其过表达可诱导细胞凋亡;Bcl-2是抗凋亡因子,当Bax表达量高时,形成同源二聚体Bax/Bax,抑制Bcl-2的抗凋亡作用从而诱导细胞凋亡。本研究结果显示,Bax表达增强的同时 Bcl-2的表达明显减弱[10,11]。
分析本研究结果,秦皮乙素可能通过线粒体途径诱导人肝癌HepG2细胞凋亡。但尚需通过进一步研究验证下述问题:在 Caspase-9抑制剂或Caspase-3抑制剂的作用下细胞是否仍然会发生凋亡;秦皮乙素诱导细胞凋亡是否还有其它途径;秦皮乙素对其它信号通路和癌基因、抑癌基因是否有影响等。
[1]汪国松,杨亚滨,李璠等.秦皮的研究进展[J].国外医药.植物药分册,2007,22(3):108-111.
[2]方莲花,吕扬,杜冠华.秦皮的药理作用研究进展[J].中国中药杂志,2008,33(23):2732-2736.
[3]王晶,王洪新,李红玉.秦皮乙素的制备及对人肝癌细胞SMMC-7721体外增殖的影响[J].中国现代应用药学,2009,26(6):439-442.
[4]叶艳清,李国平,蒲泽锦,等.腺苷通过内质网应激途径诱导HepG2细胞凋亡的研究[J]中国药理学通报,2010,26(5):596-601.
[5]林箐,彭华毅.黄葵素.诱导小鼠黑色素瘤B-16细胞凋亡的研究[J],中国药理学通报,2010,26(12):1630-1634.
[6]张琼,刘德育.蛇葡萄素改变Bcl-2/Bax表达和激活Caspase-3诱导人肝癌细胞 Bel-7402凋亡[J].中国药理学通报,2009,25(11):1502-1506.
[7]曲佳,郭坤元,吴秉毅等.冬凌草甲素诱导人多发性骨髓瘤ARH-77凋亡及其可能机制[J].中国肿瘤生物治疗杂志,2010,17(2):134-138.
[8]史海岭,刘芬,郭晓军,等.黄连素对肺腺癌A549细胞增殖、迁移与黏附的影响[J].中国癌症杂志,2009,19(12):910-914.
[9]宋少华,郭闻渊,傅志仁,等.丹参多酚酸盐通过线粒体途径诱导人肝癌SMMC-7721细胞的凋亡[J].中国肿瘤生物治疗杂志,2010,17(1):62-66.
[10]贾永清,滕熔,胡慧仙.亚硒酸钠对HL-60细胞增殖、凋亡影响及作用机制探讨[J].交通医学,2011,25(2):121-125.
[11]李泽良,刘同才,孙志熙,等.MMP2,MMP9在肾癌中的表达及意义[J].中国医科大学学报,2001,30(4):299-306.
