磷酸二酯酶4抑制剂咯利普兰逆转慢性束缚应激诱导的大鼠抑郁和焦虑样行为*
2012-07-31张俊芳张忠敏刘爱明郭洁洁沈璐艳王钦文
张俊芳,张忠敏,赵 鑫,刘爱明,郭洁洁,沈璐艳,王钦文,王 闯△
(1宁波大学医学院,浙江 宁波 315211;2牡丹江医学院红旗医院,黑龙江 牡丹江 157011)
抑郁症与焦虑症作为神经精神领域两大心境障碍性疾病,严重威胁着患者的生活及工作。抑郁症以持续性心境障碍及兴趣降低为主,并伴随其它心理及躯体症状,以其高患病率、复发率及自杀率成为神经精神科学界研究的重点。焦虑症又称焦虑性神经症,是一种以焦虑情绪为主的神经症,主要表现为发作性或持续性的焦虑、紧张、惊恐不安等焦虑情绪,并伴有自主神经紊乱、肌肉紧张与运动不安等症状。大量研究发现抑郁症与焦虑症具有较高的共患率,彼此“如影随形”。据WHO和美国Michigan大学流行病学调查显示,两者共患率达 50%[1],并且85%的抑郁症患者伴有焦虑症状[2]。因此,寻找两种疾病的共同药物作用靶标具有重要的研究意义。单胺神经系统在人和动物的抑郁症及焦虑症发病中起着重要作用。现存的抗抑郁及抗焦虑药物能够迅速改善脑内单胺类递质的改变,但是其药效的发挥却延迟到持续给药3~8周后。这表明单胺能神经系统作为抗抑郁及抗焦虑药物作用靶标有待证实[3]。
近年来研究发现,糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)与精神疾病具有较强的相关性。其作为高度保守的丝氨酸/苏氨酸蛋白激酶在中枢神经系统大量表达且具有重要调控作用。GSK3有2种高度同源(84%序列同源)的亚型:GSK3α和GSK3β。情感稳定剂锂盐对GSK3抑制作用的发现[4],使其在情感障碍病理生理机制中的作用受到重视,其中GSK3β的研究较为深入,本文将对GSK3α和GSK3β在抑郁和焦虑样行为中的调节作用及其机制进行深入研究。大量研究发现GSK3α和GSK3β的活性可受磷酸化调节:丝氨酸残基Ser21-GSK3α和Ser9-GSK3β被磷酸化后分别介导GSK3α和GSK3β的活性抑制;酪氨酸残基Tyr279-GSK3α和Tyr216-GSK3β被磷酸化后分别介导GSK3α和GSK3β的活性增强。GSK3在中枢神经系统主要介导胰岛素样受体、生长因子、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、cAMP反应元件结合蛋白(cAMP response elementbinding protein,CREB)等多条信号转导通路,通过干扰信号分子的表达及下游基因表达、神经可塑性调节、炎症及凋亡过程等,最终诱导多种神经精神症状[5-6]。因此,GSK3有望成为调控抑郁样及焦虑样行为症状的有效药物作用靶标。事实上,选择GSK3作为情绪障碍(mood disorders)治疗的药物作用靶标起源于1996年报道发现锂可以作为GSK3的抑制剂,通过增强GSK3的抑制性丝氨酸残基磷酸化直接抑制GSK3和介导蛋白激酶 B(protein kinase B,PKB)信号通路间接抑制GSK3的活性而发挥作用[7-8]。然而 GSK3 尤其是 Ser21-GSK3α、Ser9-GSK3β、Tyr279-GSK3α 和 Tyr216-GSK3β 在慢性应激诱导的抑郁样行为中的调节作用及机制仍不清楚,需要进一步研究。
研究发现,cAMP和cGMP作为第二信使参与的信号转导通路在抑郁症的调节中发挥关键作用。磷酸二酯酶(phosphodiesterase,PDE)是催化 cAMP和cGMP水解酶超级家族。PDE目前有11个家族成员(PDE1~11)。其中,PDE4、PDE7和 PDE8为 cAMP特异性的水解酶,PDE5、PDE6和PDE9为cGMP特异性的水解酶,其它PDE则以这2种第二信使为底物,对cAMP和cGMP均可水解[9]。cAMP作为体内重要的第二信使,对众多的细胞功能发挥重要调节作用,包括细胞信号转导和中枢神经系统的多巴胺、去甲肾上腺素、5-羟色胺以及谷氨酸的突触传递。因此,通过有效调节PDE4水平,从而上调cAMP,有望在抑郁症及焦虑症治疗中发挥重要作用。但是,PDE4具有A、B、C及D四种亚型,且研究发现PDE4 A、B及D亚型在中枢神经系统均有较高表达,PDE4 C亚型仅在外周系统表达。因此,阐明何种亚型在情绪障碍中的调节作用将为发现新型抗抑郁及抗焦虑药物新靶标提供希望。目前最新研究表明,PDE4D在海马内高度分布且作为cAMP的主要水解亚型有望成为新型抗抑郁及抗焦虑药物新靶标。因此,探讨慢性应激动物模型脑内PDE4的表达,尤其在水解cAMP及抑郁症、焦虑症的调节中发挥重要作用的PDE4D的表达,值得进一步关注。
咯利普兰(rolipram)是一种高效的PDE4特异性抑制剂,一直以来作为抑郁症研究领域的一个重要工具药被大量研究。尽管rolipram由于致呕吐等不良反应在进入临床试验后很快退市,但是临床前研究显示rolipram等PDE4抑制剂可能是通过cAMP/蛋白激酶(protein pinase A,PKA)/CREB/BDNF信号通路在抗抑郁症中发挥了重要调节作用[10],并且也显示出良好的抗焦虑样作用。还有研究显示BDNF可能通过介导PKB等信号转导通路对GSK3的磷酸化过程发挥调节作用。因此,有理由相信rolipram可能会通过BDNF进一步介导GSK3信号转导通路而发挥作用。但是,rolipram的抗抑郁及抗焦虑作用是否单纯通过CREB介导的信号转导通路发挥作用?rolipram能否介导GSK3这个在情绪调节中发挥关键作用的调节因子?CREB介导的信号转导通路能否对GSK3介导的信号转导通路发挥作用?这一系列问题本研究将予以重点阐明。
材料和方法
1 动物
成年Sprague-Dawley(SD)大鼠,体重(150~180)g(宁波大学实验动物中心),饲养环境温度维持在(23±2)℃,湿度保持在(55±15)%,光/暗周期为12 h/12 h(光照时间6:00~18:00)。自由饮食,饲养1周以适应环境后开始实验流程。每天给药前记录动物体重,分析实验周期内动物体重变化情况。动物实验经宁波大学实验动物伦理委员会批准,遵照美国国立卫生研究院实验动物操作规程(NIH Publications No.80~23)进行。
2 主要试剂
氯化锂(LiCl;Sigma-Aldrich)及rolipram(Sigma-Aldrich)分别溶于含有1%DMSO(Sigma-Aldrich)的生理盐水,置于4℃冰箱中备用。LiCl(100 mg/kg)及 rolipram(1 mg/kg)按照 10 mL·kg-1·d-1每日固定时间腹腔注射给药,空白对照组与模型组给予等量的空白溶剂。H89(PKA拮抗剂;Sigma-Aldrich)由人工脑脊液配制溶解(6×106μg/L),每次使用前现配现用。
3 主要方法
3.1 实验分组 (1)40只SD大鼠(150~180 g)随机分为4组:空白对照组、模型组、阳性对照药LiCl组及rolipram组。所有动物适应环境1周后在不给予任何处理因素前提下第0 d进行1次旷场实验,第1 d开始模型组、LiCl组及rolipram组每日固定时间分别腹腔注射空白溶剂、LiCl(100 mg/kg)及rolipram(1 mg/kg),1 h后进行慢性束缚应激,每天束缚6 h。空白对照组不进行束缚应激,但每天固定时间在同一实验环境饲养,并腹腔注射等量空白溶剂。第22 d,4组动物给药后1 h,进行强迫游泳实验的适应训练,每只动物自由游泳15 min。24 h后,即第23 d进行检测,每只动物游泳5 min,并记录分析每只动物的逃避行为(攀爬、游泳)及不动时间。第24 d进行高架十字迷宫测试,以检测动物的焦虑样行为。第25 d再次进行旷场实验,以分析应激及药物对动物的影响。此项实验结束后,立即处死动物并取双侧海马组织,免疫印迹法检测海马内分子指标的变化,流程见图1A。(2)30只SD大鼠(180~200 g)平均分为6组,双侧海马CA1区手术埋管并恢复7 d后进行慢性应激处理21 d,并在应激前微量注射H89,腹腔注射LiCl和rolipram。每次实验前将H89(6×106μg/L)生理盐水以1 μL/min的速度缓慢注射至CA1区,每侧分别注射1 μL,注射完毕后留针5 min以防液体返流。双侧海马用于检测PDE4D、PKA、p-CREB及磷酸化丝氨酸残基9糖原合成酶激酶3β(p-Ser9-GSK3β)的表达,流程见图1B。

Figure 1.Schedules of drug treatments and behavioral tests.A:the first open field test(OFT)was conducted on day 0 before drug treatments and stress.Behavioral tests was carried out on days 22~25(1 h after the injection of drugs or vehicle).B:seven days after the surgery,chronic restraint stress was conducted for 21 d after microinjection of PKA antagonist(H89)and intraperitoneal(ip)injection of lithium chloride(LiCl)and rolipram everyday.FST:forced swimming test;EPM:elevated plus-maze图1 实验给药及行为学流程
3.2 大鼠海马CA1区手术埋管 将大鼠用水合氯醛10 mg/kg腹腔注射麻醉后,固定于立体定位仪。消毒、切开头部皮肤(以两眼连线的中点为起点,两耳后缘连线的中点为终点),暴露手术视野,用棉签蘸少许50%H2O2涂于颅骨表面使前囟清晰暴露,以前囟为坐标原点,后退3.5 mm,旁开2.5 mm处钻孔,为左右两侧海马的进入点。以软脑膜为起始点将定做好的定位管进针3.0 mm,进入海马CA1区,用牙科牙托粉固定,并使动物术后恢复1周时间。
3.3 慢性束缚应激(chronic restrain stress) 由透明钢化玻璃统一制作的长度22 cm、直径8 cm的束缚器,前端有通气孔用于动物呼吸外界空气,尾端为设计一可关闭的圆形门。动物面朝顶端被轻柔放置入束缚器后迅速关闭尾端的门,并开始计时。每天同一时间进行束缚应激,每次每只动物进行6 h。
3.4 旷场实验(open field test) 旷场实验是以实验动物在新奇环境之中某些行为的发生频率和持续时间等,评价实验动物在陌生环境中自主行为、探究行为与紧张度的一种方法。实验装置由旷场反应箱和数据自动采集和处理系统两部分组成。大鼠旷场反应箱高30~40 cm,底边长100 cm,内壁涂黑,底面平均分为25个4 cm×4 cm小方格,正上方2 m处架一数码摄像头,其视野可覆盖整个旷场内部。旷场光照为全人工照明,可人为设定“白天”和“黑夜”,白天由两侧墙壁的4只节能灯发出约200 Lux照度来模拟,夜晚由一侧墙壁的红外光源提供照明。实验人员和计算机等设备位于另一房间以减小对动物的干扰,实验室背景噪音控制在65 dB以下。将动物放入箱内底面中心,同时进行摄像和计时,观察时间设定为5 min。每只动物检测后清洗方箱内壁及底面,以免上次动物余留的信息(如动物的大/小便、气味)影响下次测试结果。根据计算机软件记录并分析动物肢体越过的格子数即水平得分(crossing)、后肢站立次数即垂直得分(rearing)和修饰次数(grooming)。
3.5 强迫游泳实验(forced swimming test) 该实验方法是一种行为绝望实验法,其基本原理是将大鼠放进一个有限的空间(直径20 cm,水面高度30 cm,高度50 cm的圆筒状塑胶玻璃器皿内)使之游泳,开始时拼命游泳力图逃脱,很快就变成漂浮不动状态,仅露出鼻孔保持呼吸,四肢偶尔划动以保持身体不至于沉下去,实际是动物放弃逃脱的希望,属于行为绝望,反映了动物的抑郁样行为。实验包括训练阶段及测试阶段:第22 d各组动物依次游泳15 min,以适用环境;第23 d进行测试,每只动物游泳5 min,并记录动物在5 min内的攀爬时间(climbing)、游泳时间(swimming time)及不动时间(immobility)。攀爬行为定义为:动物在游泳过程中前肢顺着器皿方向主动向上运动;游泳时间定义为:动物在器皿内主动地游泳运动的时间;不动时间定义为:动物在器皿内不表现任何逃避行为的时间。整个实验中,水温保持在(23±2)℃。每只动物实验后更换器皿内的水以保持水的清洁,消除动物粪便及气味的干扰。
3.6 高架十字迷宫实验(elevated plus-maze) 高架十字迷宫是利用动物对新异环境的探究特性和对高悬敞开臂的恐惧形成矛盾冲突行为来考察动物的焦虑状态。实验仪器由黑色塑胶玻璃做成,包括开臂区(长50 cm,宽10 cm),闭臂(长50 cm,宽10 cm,高20 cm)及中央区(10 cm×10 cm),相同类型的臂通过中央区相对连接。整个仪器置于距离地面50 cm的位置。每只动物实验时面对闭臂置于中央区位置,并使动物自由探索5 min,记录:(1)进入开臂及闭臂的次数;(2)在开臂及闭臂内的停留时间(动物的四肢全部进入一个臂内方可认为有效)。每只动物实验结束后采用10%乙醇进行清洗实验仪器以消除动物气味的干扰。
(1)土地及植被破坏面积估计。工程建设过程中,地面设施的兴建、开挖、填筑等都不同程度、不同形式地扰动了原地貌形态,损坏了地表土体结构和地面林草植被。根据对主体工程报告的分析及现场勘察,工程建设占压土地、扰动原地表面积共37.06hm2。
3.7 免疫印迹实验 100 mg脑组织加入含有蛋白酶抑制剂的1 mL裂解液中,尽量保持低温并快速匀浆(13000 r/min,4℃),离心30 min,取少量上清进行蛋白浓度定量;将所有组织蛋白浓度定量至4×106μg/L,并与2倍的上样缓冲液1∶1混合后100℃沸水浴5 min,将所有样本冷却后保存至-20℃冰箱中备用。每组上样50 μg,10%聚丙烯酰胺凝胶电泳,60 V稳定电压转膜3 h至PVDF膜,并用封闭液封闭2 h,TBST清洗5 min后分别加入Ⅰ抗[家兔来源抗 PDE4D(1∶800)、PKA(1∶1000)、p-CREB(1∶1500)、BDNF(1 ∶500)、p-Ser21-GSK3α(1∶1000)、p-Ser9-GSK3β(1∶1000)、p-Tyr279-GSK3α(1∶1000)、p-Tyr216-GSK3β(1∶1000)、total GSK3α(1∶2000)、total GSK3β (1∶2000)和小鼠来源抗GAPDH(1∶5000);Millopore]后置于4℃冷库振荡过夜。TBST清洗I抗后常温孵育II抗[山羊抗兔IgG(1∶10000)及山羊抗小鼠 IgG(1∶10000);Cell Signal]1 h,TBST清洗后曝光照相。并采用软件BandScan分析结果,以GAPDH为内参照。
4 统计学处理
结 果
1 Rolipram对慢性束缚应激诱导的体重丢失的影响
各组动物在第0 d体重(即初始体重)无显著差异。重复测量数据的方差分析显示时间效应(day)[F(3,108)=900.500,P <0.01],处理效应(treatment)[F(3,108)=6.685,P <0.01]以及时间效应与处理效应的交互作用(day×treatment)[F(9,108)=10.750,P<0.01]均有显著差异。随着慢性应激的持续进行,应激组动物与空白对照组相比体重逐渐丢失,比较显示第14 d(P<0.01)及21 d(P<0.01)体重下降显著,而LiCl及rolipram与应激组相比在第14 h(LiCl,P<0.05;rolipram,P<0.01)及21 h(LiCl,P<0.01;rolipram,P<0.01)均显示出明显逆转了体重下降效应,见图2。
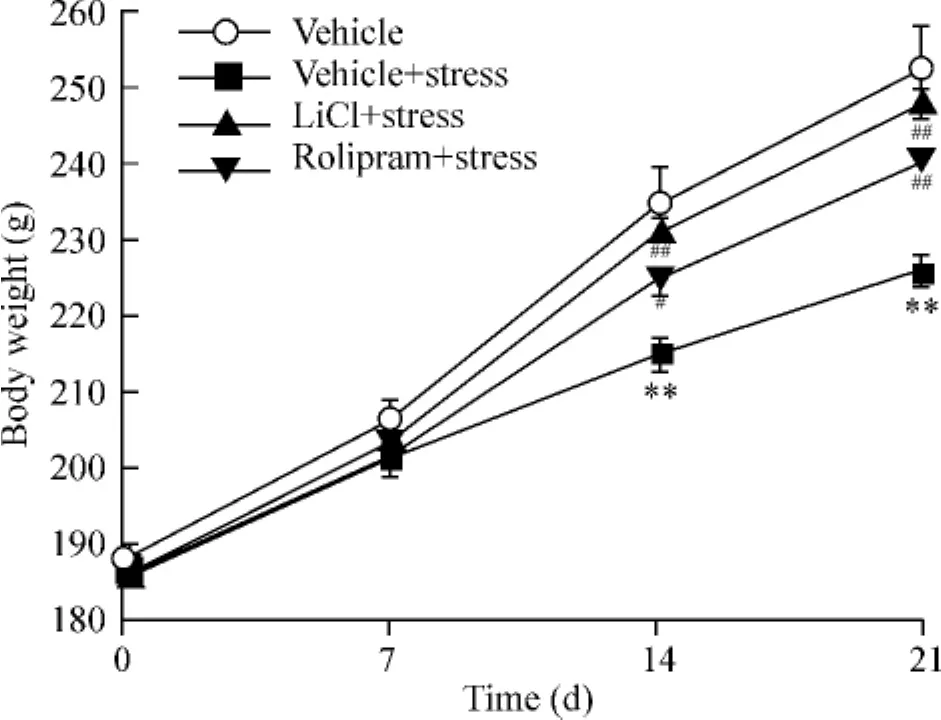
Figure 2.Effects of chronic restraint stress and rolipram administration on body weight in 21 days.Data were analyzed using repeated measures ANOVA followed by Bonferroni post test.E.n=10.**P<0.01 vs vehicle group;#P<0.05,##P<0.01 vs vehicle+stress group.图2 慢性束缚应激及rolipram对21 d内动物体重的影响
2 Rolipram对慢性束缚应激诱导的抑郁样行为的影响
接受23 d慢性束缚应激的应激组大鼠与空白对照组相比,在强迫游泳实验中表现出不动时间显著延长,表现出抑郁样行为特征。各组不动时间的总体比较差异显著[F(3,36)=18.100,P <0.01],两两比较显示应激组动物与空白对照组相比不动时间显著延长(P<0.01),而LiCl(P<0.01)与rolipram(P<0.01)均显著逆转了这一效应,见图3A。进一步分析动物的攀爬次数表明,应激组与空白对照组相比显著降低了动物的攀爬次数(P<0.01),而LiCl(P<0.05)与rolipram(P<0.01)均显著逆转了这一效应,表明rolipram显著逆转了抑郁样行为效应,见图3B。然而,各组动物游泳时间的比较均未见显著差异[F(3,36)=0.447,P > 0.05],表明各组动物运动行为能力无显著差异,见图3C。

Figure 3.Effect of rolipram on depression-like behavior induced by chronic restraint stress,including immobility time(A),climbing behavior(B),and swimming behavior(C)in forced swimming test.Data were analyzed using one-way ANOVA followed by Bonferroni post test.E.n=10.**P<0.01 vs vehicle group;#P<0.05,##P<0.01 vs vehicle+stress group.图3 Rolipram对慢性束缚应激诱导的抑郁样行为的影响
3 Rolipram对慢性束缚应激诱导的焦虑样行为的影响
高架十字迷宫实验显示,各组动物在开臂内时间比[F(3,36)=11.450,P <0.01](图4A)及穿越开臂次数[F(3,36)=5.101,P <0.01](图4B)的总体比较差异显著,两两比较显示应激组动物与空白对照组相比在开臂内时间比(P<0.01)及穿越开臂次数均显著降低(P<0.01),而LiCl(P<0.01;P<0.01)与rolipram(P<0.01;P<0.01)组均显著逆转了这两项指标,表现出显著抗焦虑作用。然而,各组穿越闭臂次数未见显著差异[F(3,36)=0.317,P>0.05],表明各组动物的自主活动能力无显著差异,见图4B。在高架十字迷宫中慢性束缚应激在诱导动物焦虑样行为的同时,未见其对动物自主行为能力产生显著影响,见图4。
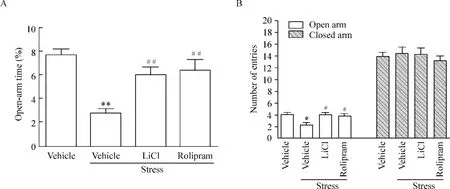
Figure 4.Effect of rolipram on anxiety-like behavior induced by chronic restraint stress,including percentage of time spent in openarm exploration(A)and the numbers of entries into open or closed arm(B)in elevated plus-maze.Data were analyzed using one-way ANOVA followed by Bonferroni post test.E.n=10.*P<0.05,**P<0.01 vs vehicle group;#P<0.05,##P<0.01 vs vehicle+stress group.图4 Rolipram对慢性束缚应激诱导的焦虑样行为的影响
4 应激前及应激25 d后各组动物在旷场实验中行为学比较
应激前(即第0 d)进行的旷场实验表明,各组动物水平穿格次数(P>0.05)、直立次数(P>0.05)及修饰次数(P>0.05)均未见显著差异,见图5A;经过25 d的慢性束缚应激后再次进行旷场实验表明,慢性应激组动物与空白对照组相比水平穿格次数(P<0.01)、直立次数(P<0.05)及修饰次数(P<0.01)均显著降低,而 LiCl(P<0.01;P<0.05;P<0.01)与rolipram(P<0.01;P<0.01;P<0.01)均显著逆转了这些效应,提示rolipram具有逆转抑郁样行为效应,见图5B。另外,这一实验也表明慢性束缚应激建立的大鼠抑郁模型是可靠的。

Figure 5.The open field locomotor activities before(A)or after(B)chronic restraint stress,including crossing,rearing and grooming.Data were analyzed using oneway ANOVA following by Bonferroni post test.E.n=10.*P <0.05,** P <0.01 vs vehicle group;#P<0.05,##P<0.01 vs vehicle+stress group.图5 应激前及应激25 d后各组动物在旷场实验中行为学比较
5 Rolipram对慢性应激诱导的p-CREB、BDNF和PKA表达下调的影响及PKA抑制剂H89的阻断作用
大量研究表明cAMP-CREB-BDNF信号转导通路在抗抑郁及抗焦虑中发挥重要调节作用。本实验发现,慢性束缚应激25 d后应激组与空白组相比,海马内p-CREB(图6B)及BDNF(图6C)表达显著下调[p-CREB,F(3,12)=8.471,P <0.01;BDNF,F(3,12)=4.439,P <0.05],rolipram显著逆转了p-CREB及BDNF表达的下调(p-CREB,P<0.01;BDNF,P <0.05),而LiCl未见对p-CREB及BDNF表达的显著增高,仅仅表现出轻微上调作用。进一步设计实验研究发现,慢性束缚应激21 d后应激组与空白组相比,海马内p-CREB表达显著下调[F(5,24)=43.260,P < 0.01],见图 6F,海马内PKA的表达也显著下调[F(5,24)=51.090,P<0.01],见图6E,并且PKA抑制剂H89显著阻断了rolipram对p-CREB(P<0.01)及PKA(P<0.01)的上调作用,见图6E-F。
6 Rolipram对慢性应激诱导下GSK3及其不同磷酸化状态表达的影响和PKA抑制剂H89的阻断作用
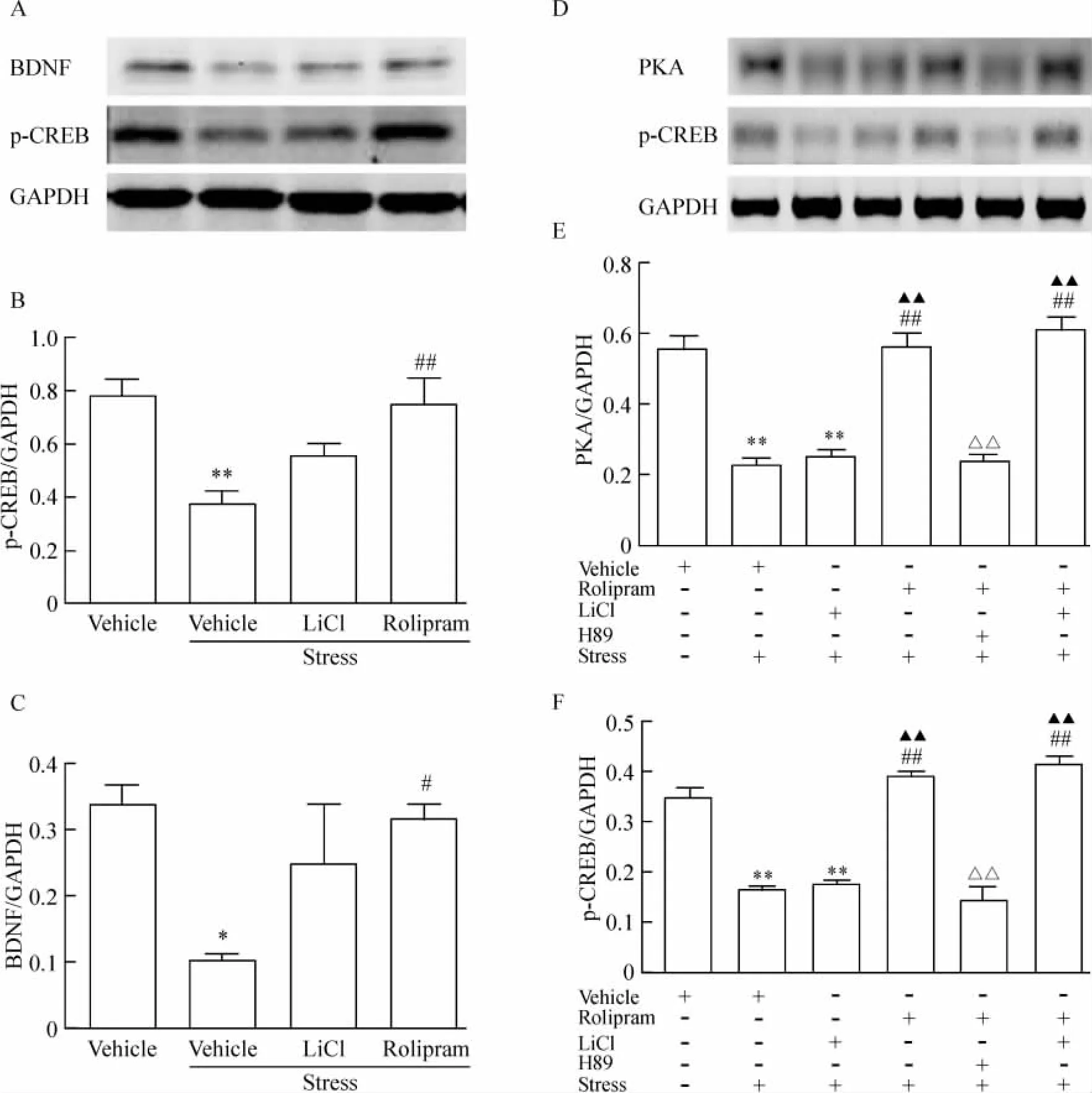
Figure 6.Effects of rolipram and H89 on down-regulation of p-CREB(B and F),BDNF(C)and PKA(E)expression induced by chronic restraint stress in the hippocampus of rats.Data were analyzed using one-way ANOVA following by Bonferroni post test.E.n=4~5.*P<0.05,**P<0.01 vs vehicle group;#P<0.05,##P<0.01 vs vehicle+stress group;▲▲P<0.01 vs LiCl+stress group;△△P<0.01 vs rolipram+stress group.图6 Rolipram及PKA抑制剂H89对慢性应激诱导的p-CREB、BDNF和PKA表达下调的影响
7 Rolipram对慢性应激诱导下PDE4D表达的影响
慢性束缚应激21 d,动物海马内PDE4D的表达显著提高[F(5,24)=13.840,P <0.01],rolipram 显著逆转了这一效应(P<0.01),提示rolipram可能主要通过抑制PDE4D的活性发挥上调PKA/CREB信号通路;而LiCl并未能显著下调PDE4D的表达[F(5,24)=13.840,P > 0.05],提示 LiCl对 GSK3 介导的信号通路的影响可能并不通过PKA/CREB信号通路发挥调节作用,见图8。
讨 论
为了研究药物对动物抑郁和焦虑样行为的影响,我们选择了大鼠慢性束缚应激模型,这是基于大量研究表明慢性束缚应激诱导了哺乳动物的抑郁和焦虑样行为[11-12]。我们将大鼠慢性束缚应激时间每日由4 h增加到6 h,持续进行3周以上,发现慢性束缚应激显著增强了动物在强迫游泳中的不动时间并显著降低了高架十字迷宫中动物的开臂探索行为,表现出稳定的抑郁和焦虑样行为。故本实验证明慢性束缚应激与慢性不可预见性应激相比虽然应激方式单调,但应激时间较久、刺激性较强,可以成为一种较好的获得抑郁症及焦虑症动物模型的方法。因此,本实验在众多诱导手段中[13]选择此方法作为诱导模型,具有稳定、易操作、干扰因素少等特点,为研究抑郁与焦虑共患病提供了良好的动物模型。

Figure 7.Effects of rolipram and H89 on expression of total GSK3α (F),total GSK3β (G),p-Ser21-GSK3α (B),p-Ser9-GSK3β(C and I),p-Tyr279-GSK3α(D),p-Tyr216-GSK3β(E).E.n=4~5.*P<0.05,**P<0.01 vs vehicle trol group;#P<0.05,##P<0.01 vs vehicle+stress group;△△P<0.01 vs rolipram+stress group.图7 Rolipram及H89对慢性应激诱导下total GSK3α、total GSK3β及其不同磷酸化状态(p-Ser21-GSK3α、p-Ser9-GSK3β、p-Tyr279-GSK3α和 p-Tyr216-GSK3β)表达的影响

Figure 8.Effects of rolipram and H89 on down-regulation of PDE4D induced by chronic restraint stress.E.n=5.**P <0.01 vs vehicle group;##P <0.01 vs vehicle+stress group.图8 Rolipram及H89对慢性束缚应激诱导的PDE4D上调作用的影响
慢性束缚应激模型稳定地诱导出抑郁和焦虑样行为,再次证明了:(1)抑郁症与焦虑症共患率高的特点;(2)慢性应激因素是抑郁症与焦虑症患病的共同发病因素;(3)该动物模型脑内信号变化为寻求抗抑郁及抗焦虑药物新靶标提供了研究思路。大量研究已表明,cAMP/CREB信号转导通路不仅在认知功能、而且在抗抑郁及抗焦虑中发挥重要调节作用[14-15]。cAMP特异性水解酶抑制剂——rolipram 因具有显著的致呕吐作用而未能进入临床,但其作为PDE4抑制剂工具药通过上调cAMP/CREB信号转导通路改善认知功能[16]、抗抑郁[17]及抗焦虑[15]的作用已被广泛研究。然而也有研究发现rolipram不仅无抗焦虑作用,反而可以诱导焦虑样行为[18],这提示rolipram对情绪稳定的作用及机制还有待进一步明确。神经营养学说研究表明BDNF作为一个重要的神经营养因子在cAMP/CREB信号转导通路的功能执行(认知增强、抗抑郁及抗焦虑)中发挥重要作用。其主要通过结合其受体酪氨酸受体激酶B(tyrosine receptor kinase B,TrkB)进而激活 PI3K/Akt(PKB)等信号通路来发挥调节作用。BDNF作为cAMP/CREB信号转导通路下游CRE的表达产物之一,通过结合受体TrkB进而激活PI3K/Akt(PKB)等信号通路也可在认知增强、抗抑郁及抗焦虑中发挥调节作用。大量研究显示GSK3作为BDNF下游调节的关键酶,受 PKB及蛋白激酶C的调控[19]。因此,cAMP/CREB/BDNF介导的信号转导通路在中枢神经系统可能对GSK3这一情绪调节的关键因子在抑郁症及焦虑症中发挥调控作用。本研究结果表明,慢性应激诱导抑郁和焦虑样行为的出现,动物海马内p-CREB/BDNF及具有抑制性活性的丝氨酸残基磷酸化GSK3(p-Ser21-GSK3α和p-Ser9-GSK3β)的表达均显著下调,而具有增强GSK3活性的酪氨酸残基磷酸化GSK3(p-Tyr279-GSK3α和p-Tyr216-GSK3β)、total GSK3α 和 total GSK3β 表达均未见显著变化;进一步观察发现LiCl作为GSK3抑制剂显著逆转了慢性束缚应激诱导的抑郁和焦虑样行为,增强了 p-Ser21-GSK3α和 p-Ser9-GSK3β的表达,而未见对 p-Tyr279-GSK3α、p-Tyr216-GSK3β、total GSK3α 和 total GSK3β 表达的影响,这提示LiCl作为GSK3抑制剂可能通过增强具有抑制GSK3活性的p-Ser21-GSK3α和p-Ser9-GSK3β的表达而对GSK3介导的信号转导通路发挥抑制作用,这与Eom等[20]2009年的研究结果一致,且本研究未见LiCl对p-CREB及BDNF表达的增强作用。但是LiCl的作用仅仅通过上调具有抑制性的丝氨酸残基磷酸化GSK3却能显著逆转慢性束缚应激诱导的行为学障碍,也证明了GSK3介导的信号转导通路在抑郁及焦虑症发病中起关键性作用。进一步分析PDE4抑制剂rolipram的作用发现,其不仅具有同LiCl相似的对GSK3信号通路的作用,而且显著增强了p-CREB/BDNF的表达,并有显著的抗抑郁及抗焦虑作用。这些实验数据说明了一直被广泛研究的rolipram抗抑郁及抗焦虑的作用可能不仅局限于通过p-CREB/BDNF信号通路,还可能通过下调GSK3介导的信号通路发挥作用。因此,有必要通过过度激活GSK3信号转导通路能否显著削弱rolipram的作用来进一步深入研究。我们的研究发现LiCl联合rolipram用药与单独给予LiCl相比对p-Ser9-GSK3β的上调作用提高将近1倍,进一步提示rolipram对p-Ser9-GSK3β的调节能力与GSK3抑制剂相似。
但是,PDE4抑制剂诱导的GSK3信号分子的改变与其介导的cAMP/PKA/CREB信号转导通路的关系如何,是否具有特异性的上下游关系值得关注。我们进一步研究表明PKA阻断剂H89显著阻断了rolipram对PKA/CREB信号转导通路的上调作用,并且有效阻断了rolipram对p-Ser9-GSK3β的上调作用,提示PKA/CREB信号转导通路对p-Ser9-GSK3β发挥重要调节作用。另外,既然我们选择PDE4抑制剂作为抗抑郁及抗焦虑症的药物作用靶标,本实验模型中PDE4本身的活性是否发生变化决定了该药物作用靶标的特异性及有效性。我们的研究结果表明慢性应激显著提高了海马内PDE4D的表达,这可能是慢性应激显著下调pCREB信号转导通路的重要原因之一。本研究中我们之所以选择PDE4D进行检测,是因为PDE4D在大脑皮层和海马都有很高的分布[21]。与此相一致的是,PDE4D基因敲除小鼠皮层和海马的PDE4活性降低达60%[22],提示PDE4D有望成为抗抑郁及抗焦虑作用的有效药物靶标。
本研究中我们一直担心,rolipram的致呕吐作用是否会对行为学及动物的精神状态产生影响?我们的研究结果表明,随着慢性应激时间的延长,应激组动物体重显著丢失,而LiCl与rolipram均逆转了动物体重的丢失。这一结果证实了rolipram的给药并未因呕吐反应而影响动物的摄食行为而影响动物的体重。这一点得益于我们前期研究发现大鼠给予rolipram(1 mg/kg)后1 h其呕吐反应基本消失,且我们的行为学也选择在给药后1 h进行,在一定程度上也减少了呕吐反应对行为学的影响,这一发现也得到其他学者研究结果的支持[9]。
我们的研究在应激前与慢性应激后均进行了旷场实验以比较动物的自主活动能力,结果发现应激前各组动物的自主活动能力无显著差异,但经过25 d的慢性应激后应激组动物自主活动能力显著减少,而LiCl及rolipram均显著逆转了这一效应。自主活动能力的减少是长期慢性应激的结果,恰恰证明了慢性束缚应激稳定诱导了动物的情绪障碍。但是,还需考虑自主活动能力是否会影响对动物强迫游泳及高架十字迷宫的行为测试。事实上,我们强迫游泳中对动物游泳时间的比较以及高架十字迷宫中对动物穿越闭臂次数的比较均未见显著差异,表明动物在2个行为学测试中的自主活动能力未受影响。这与旷场实验中应激诱导了动物的自主活动能力降低并不矛盾,可能因为强迫游泳与高架十字迷宫实验均是在一种较为危险的环境下进行的,而旷场实验连续进行2次,且环境较为温和。
总之,本研究发现了PDE4抑制剂的抗抑郁及抗焦虑作用可能通过上调CREB/BDNF及下调GSK3信号转导通路来发挥作用,为探索新型抗抑郁及焦虑共患病药物新靶标提供了思路。
[1]Sartorius N,Ustan TB,Lecrubier Y,et al.Depression comorbid with anxiety:results from the WHO study on psychological disorders in primaryhealth care[J].Br J Psychiatry,1996,168(1):38-45.
[2]Devane CL,Chiao E,Franklin M,et al.Anxiety disorders in the 21st century,status,challenges,opportunities with depression[J].Am J Manag Care,2005,11(12 Suppl):S344-S353.
[3]Uppal A,Singh A,Gahtori P,et al.Antidepressants:current strategies and future opportunities[J].Curr Pharm Des,2010,16(38):4243-4253.
[4]Freland L,Beaulieu JM.Inhibition of GSK3 by lithium,from single molecules to signaling networks[J].Front Mol Neurosci,2012,5:14.
[5]Hur EM,Zhou FQ.GSK3 signalling in neural development[J].Nat Rev Neurosci,2010,11(8):539-551.
[6]Li X,Jope RS.Is glycogen synthase kinase-3 a central modulator in mood regulation[J].Neuropsychopharmacology,2010,35(11):2143-2154.
[7]Mendez P,Garcia-Segura LM.Phosphatidylinositol 3-kinase and glycogen synthase kinase 3 regulate estrogen receptor-mediated transcription in neuronal cells[J].Endocrinology,2006,147(6):3027-3039.
[8]庞瑞萍,胡品津,曾志荣,等.吲哚美辛通过Akt/3β/NAG-1信号通路诱导胃癌细胞的凋亡[J].中国病理生理杂志,2011,27(8):1513-1518.
[9]Jindal A,Mahesh R,Gautam B,et al.Antidepressantlike effect of etazolate,a cyclic nucleotide phosphodiesterase 4 inhibitor-an approach using rodent behavioral antidepressant tests battery[J].Eur J Pharmacol,2012,689(1-3):125-131.
[10]Li YF,Cheng YF,Huang Y,et al.Phosphodiesterase-4D knock-out and RNA interference-mediated knockdown enhance memory and increase hippocampal neurogenesis via increased cAMP signaling[J].J Neurosci,2011,31(1):172-183.
[11]Lee B,Yun HY,Shim I,et al.Bupleurum falcatum prevents depression and anxiety-like behaviors in rats exposed to repeated restraint stress[J].J Microbiol Biotechnol,2012,22(3):422-430.
[12]Cruz FC,Marin MT,Leão RM,et al.Behavioral and neuroendocrine effects of the exposure to chronic restraint or variable stress in early adolescent rats[J].Int J Dev Neurosci,2012,30(1):19-23.
[13]吕俊华,钟 玲.实验性抑郁症动物模型的评价[J].中国病理生理杂志,2001,17(9):916-919.
[14]Eyre H,Baune BT.Neuroplastic changes in depression:A role for the immune system[J].Psychoneuroendocrinology,2012,37(9):1397-1416.
[15]Li YF,Huang Y,Amsdell SL,et al.Antidepressantand anxiolytic-like effects of the phosphodiesterase-4 inhibitor rolipram on behavior depend on cyclic AMP response element binding protein-mediated neurogenesis in the hippocampus[J].Neuropsychopharmacology,2009,34(11):2404-2419.
[16]Wang C,Yang XM,Zhuo YY,et al.The phosphodiesterase-4 inhibitor rolipram reverses Aβ-induced cognitive impairment and neuroinflammatory and apoptotic responses in rats[J].Int J Neuropsychopharmacol,2012,15(6):749-766.
[17]Schaefer TL,Braun AA,Amos-Kroohs RM,et al.A new model of Pde4d deficiency:genetic knock-down of PDE4D enzyme in rats produces an antidepressant phenotype without spatial cognitive effects[J].Genes Brain Behav,2012,11(5):614-622.
[18]Heaslip RJ,Evans DY.Emetic,central nervous system,and pulmonary activities of rolipram in the dog[J].Eur J Pharmacol,1995,286(3):281-290.
[19]Jantas D,Szymanska M,Budziszewska B,et al.An involvement of BDNF and PI3-K/Akt in the anti-apoptotic effect of memantine on staurosporine-evoked cell death in primary cortical neurons[J].Apoptosis,2009,14(7):900-912.
[20]Eom TY,Jope RS.Blocked inhibitory serine-phosphorylation of glycogen synthase kinase-3α/β impairs in vivo neural precursor cell proliferation[J].Biol Psychiatry,2009,66(5):494-502.
[21]Miró X,Pérez-Torres S,Puigdomènech P,et al.Differential distribution of PDE4D splice variant mRNAs in rat brain suggests association with specific pathways and presynaptical localization[J].Synapse,2002,45(4):259-269.
[22]Zhang HT,Huang Y,Jin SL,et al.Antidepressant-like profile and reduced sensitivity to rolipram in mice deficient in the PDE4D phosphodiesterase enzyme[J].Neuropsychopharmacology,2002,27(4):587-595.
