慢病毒介导的c-met RNA干扰对人乳头状甲状腺癌K1细胞生物学行为的影响*
2012-07-31郑时玉刘泽兵
郑时玉,王 丽,刘泽兵,桂 律
(复旦大学附属金山医院病理科,上海 201508)
c-Met是由c-met原癌基因编码的具有酪氨酸激酶活性的跨膜受体,与其配体肝细胞生长因子(hepatocyte growth factor,HGF)结合后,发生自身磷酸化,进而通过一系列信号转导,导致细胞发生各种生物学反应[1]。已有不少研究证实c-Met在乳头状甲状腺癌中高表达,并与其病理分期、侵袭及转移密切相关[2]。RNA 干扰(RNA interference,RNAi)技术是近年来发展起来的新技术,它能介导序列高度同源的靶基因的mRNA降解,从而特异而有效地阻断靶基因的表达。而慢病毒介导的RNAi具有对分裂和非分裂细胞均有感染作用、容纳外源性基因片段大、感染后可以整合到受感染细胞的基因组进行长时间的稳定表达等特点。本研究旨在探讨慢病毒RNAi载体阻断HGF/c-Met信号转导通路后对乳头状甲状腺癌细胞生长、迁移、侵袭等的作用。
材料和方法
1 材料
Lipofectamine 2000购自Invitrogen;SuperReal PreMix(SYBR Green)购自天根生化;β-actin和c-Met I抗购自Santa Cruz;羊抗兔、羊抗鼠Ⅱ抗购自优宁维公司;Transwell小室购自 Corning;DMEM/F12购自HyClone;BALB/c裸鼠购自上海西普尔-必凯实验动物有限公司。
2 方法
2.1 免疫组化 检测组织取自2007年~2009年间在复旦大学附属金山医院实施手术切除的35例乳头状甲状腺癌标本和25例良性甲状腺疾病标本(包括甲状腺腺瘤10例、结节性甲状腺肿15例)。标本经10%中性甲醛固定。免疫组化检测用EnVision二步法,DAB显色,苏木素复染,PBS缓冲液代替I抗作为阴性对照。
2.2 细胞系及细胞培养 人乳头状甲状腺癌K1细胞株由重庆医科大学附属二院提供,并常规培养于含10%FBS的DMEM/F12培养基中;培养条件为37℃、5%CO2。
2.3 RNAi慢病毒载体的制备 根据siRNA设计原则及人类 met基因 mRNA序列(GenBank_id NM_001127500)设计了2条针对met基因的RNAi靶点序列,即 c-met1:GCACGATGAATACATTGAAAT,c-met2:TCAACTTCTTTGTAGGCAATA。针对靶位点分别设计2条互补的寡核苷酸序列,将合成好的单链DNA退火形成双链DNA Oligo,与经Age I和EcoR I双酶切回收好的PGCSIL-GFP载体连接,将连接产物转化大肠杆菌DH5α,挑选阳性重组菌落送上海吉凯基因测序。
2.4 RNAi慢病毒包装及滴度测定 用 Lipofectamine 2000将3种质粒(PGCSIL-GFP、pHelper 1.0和pHelper 2.0)共转染293T细胞,培养48 h后,收集富含慢病毒颗粒的上清液,采用逐孔稀释法测定慢病毒滴度。
2.5 慢病毒感染 K1细胞 慢病毒以感染复数(multiplicity of infection,MOI)为50感染细胞,加入Polybrene至终浓度为5 mg/L;96 h后,荧光显微镜下观察感染效率,继续扩大培养。
2.6 实时荧光定量PCR 采用SYBR Green法,cmet上游引物 5’-TCTGCCTGCAATCTACAAGG-3’,下游引物 5’-ATTATTCCTCCGAAATCCAAAGT-3’;β-actin上游引物5’-AGAGCTACGAGCTGCCTGAC-3’,下游引物5’-CGTGGATGCCACAGGACT -3’。
2.7 Western blotting 用10%SDS-PAGE凝胶电泳分离蛋白,I抗稀释为1∶200,Ⅱ抗稀释为1∶3000。
2.8 克隆形成实验 细胞以200 cells/well接种于6孔板中常规培养,连续培养14 d,经固定、结晶紫染色后,记录含有50个细胞以上的克隆数量。
2.9 流式细胞术测量细胞周期 用胰酶消化细胞,离心沉淀,再用预冷的PBS混悬细胞,离心沉淀,加入70%乙醇4℃固定24 h,再次离心沉淀,每管加入碘化丙啶染色液,染色完成后24 h内用流式细胞术检测。
2.10 划痕实验 细胞以5×104cells/well的密度接种于24孔板中,待接近形成细胞单层时,用200 μL的枪头在24孔板内均匀划直线,更换含1%FBS的培养基继续培养48 h。
2.11 Transwell侵袭实验 采用 24孔 Transwell(8.0 μm滤膜微孔孔径)系统。小室内加入40 μL基质胶(matrigel)(1∶4稀释),用含 0.5%BSA 的培养基调整细胞密度为5×108cells/L,取200 μL细胞悬液加入小室内,下室加入1000 μL含10%FBS的培养基,常规培养24 h。用棉签擦去小室上表面的细胞,固定,结晶紫染色。
2.12 裸鼠皮下成瘤实验 将18只6周龄BALB/c雌性裸鼠随机分为空白对照组、阴性对照组和RNA干扰组,每组6只,饲养在上海市公共卫生动物中心;选用沉默效果最佳的K1-cmet-sh2进行实验;将3组细胞用无血清培养基重悬为密度1×1010/L的悬液,在裸鼠腋窝中部外侧皮下注射0.2 mL的细胞悬液。接种后,定期观察各组成瘤情况,肿瘤体积计算公式:(长×宽2)/2。接种30 d后断颈处死裸鼠,从皮下剥离出肿瘤组织。
3 统计学处理
采用SPSS 17.0统计软件进行统计学处理。计数资料采用χ2检验进行率的比较;计量资料用均数±标准差()表示,组间差异显著性检验采用方差分析。以P<0.05为差异有统计学意义。
结 果
1 免疫组化结果
c-Met蛋白染色定位于甲状腺细胞的细胞浆,见图1,阳性为棕黄色颗粒。根据阳性细胞所占百分比大致分为:阴性(-),未发现阳性瘤细胞;弱阳性(+),阳性细胞≤5%;中阳性(++),阳性细胞5%~20%;强阳性(+++),阳性细胞>20%。其中将阴性(-)及弱阳性(+)归为低表达组,中阳性(++)及强阳性(+++)归为高表达组[3]。乳头状甲状腺癌c-Met蛋白表达明显高于良性甲状腺病(P<0.05),见表1。
2 重组慢病毒载体测序结果
将重组慢病毒载体分别命名为PGC-met1-shRNA、PGC-met2-shRNA和PGC-NC-shRNA,其中PGC-NC-shRNA由上海吉凯基因提供。结果显示根据RNAi靶位合成的双链DNA核苷酸序列成功插入PGCSIL-GFP载体质粒的Age I和EcoR I的酶切位点,说明c-met RNAi载体构建成功,见图2。
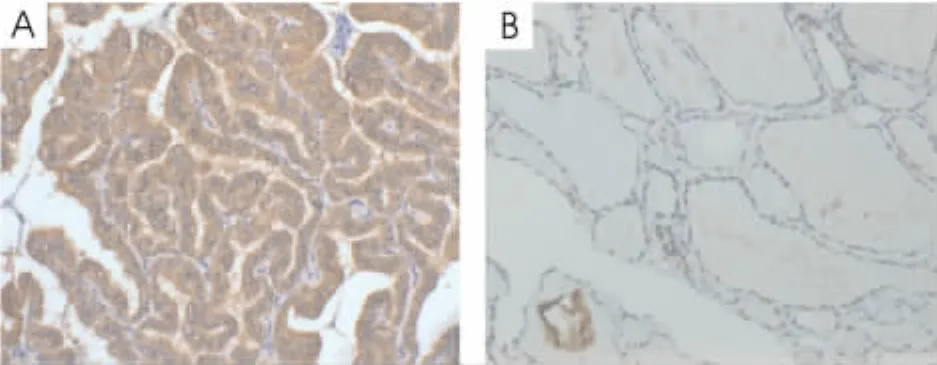
Figure 1.The expression of c-Met protein detected by immunochemistry(×200).A:papillary thyroid cancer;B:benign thyroid disease.图1 免疫组化检测乳头状甲状腺癌中c-Met的表达

表1 c-Met在乳头状甲状腺癌与良性甲状腺病变中的表达情况Table 1.The expression of c-Met in papillary thyroid carcinoma and benign thyroid disease
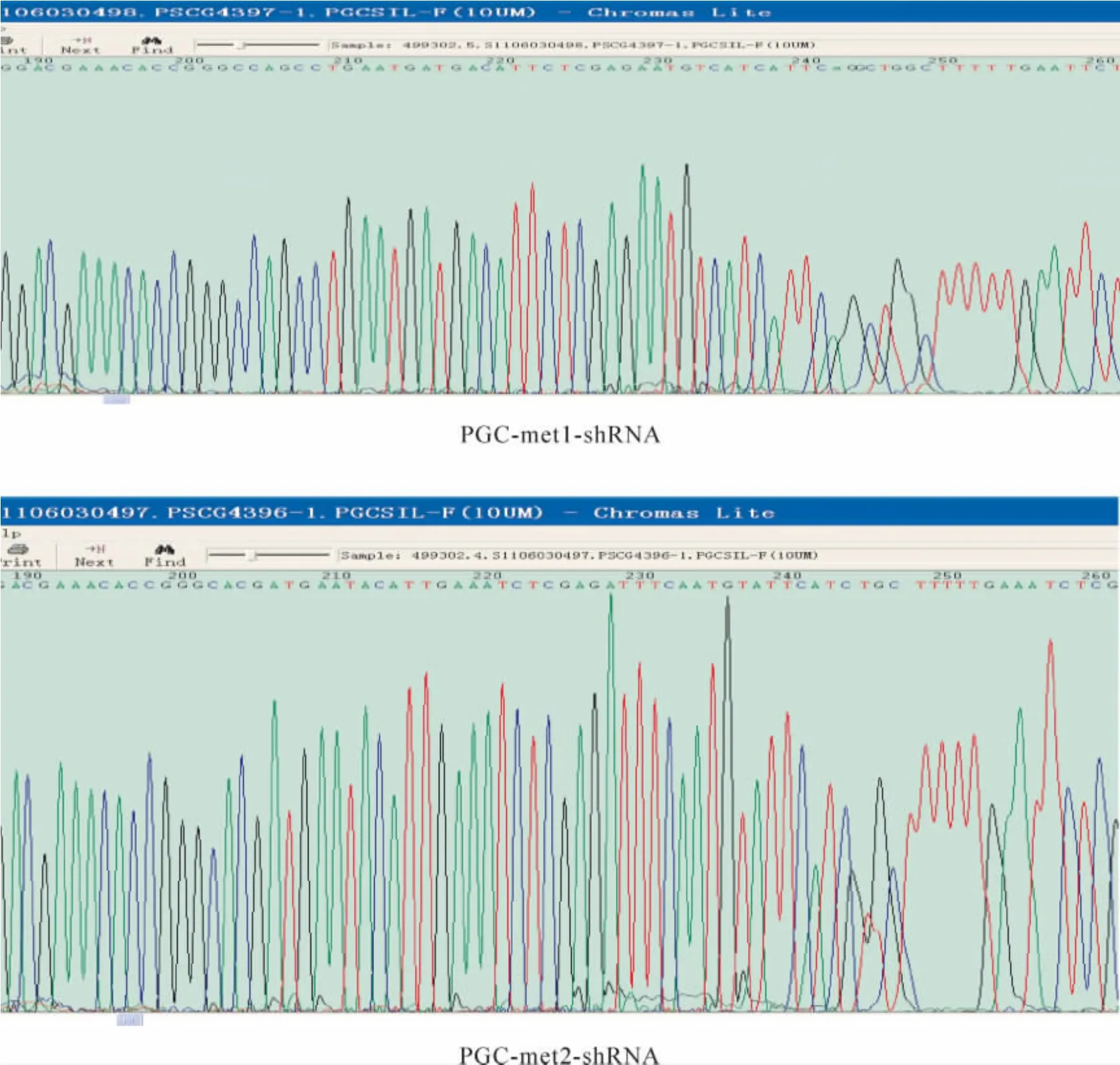
Figure 2.The sequence maps of the recombinant plasmids.图2 重组质粒测序图谱片段
3 重组慢病毒感染K1细胞的效率
将细胞分为4组:K1-CON(空白对照组即未感染慢病毒的细胞)、K1-NC(阴性对照组即感染PGC-NC-shRNA慢病毒的细胞)、K1-cmet-sh1(感染PGC-met1-shRNA慢病毒的细胞)和K1-cmet-sh2(感染PGC-met2-shRNA慢病毒的细胞)。重组慢病毒(MOI=50)感染K1细胞96 h后,荧光显微镜下观察绿色荧光,见图3,结果显示K1-NC、K1-cmet-sh1和K1-cmet-sh2组慢病毒的感染效率分别为93.3%、92.5%和89.5%。

Figure 3.GFP expression examined using fluorescent microscopy(×40).图3 荧光显微镜观察各组细胞GFP表达情况
4 重组慢病毒感染K1细胞后c-met mRNA和蛋白表达
慢病毒感染细胞96 h后,分别用荧光定量PCR及Western blotting检测各组细胞c-met mRNA及蛋白表达情况,以β-actin为内参照。荧光定量PCR采用2-ΔΔCt法计算 c-met mRNA 的相对表达量,结果见图4。K1-cmet-sh1和K1-cmet-sh2组细胞c-met mRNA水平与 K1-NC组相比分别下降65.8%和81.7%,K1-cmet-sh1组与 K1-NC组比较、K1-cmet-sh2组与K1-NC组比较差异均有统计学意义(P<0.05),而K1-NC组与K1-CON组比较差异无统计学意义(P>0.05)。

Figure 4.The effect of c-met RNAi lentivirus on c-met mRNA expression in K1 cells..n=3.*P<0.05 vs K1-CON or K1-NC.图4 c-met RNAi慢病毒对K1细胞c-met mRNA表达的影响
Western blotting结果见图5。K1-cmet-sh1和K1-cmet-sh2组细胞c-Met蛋白水平与K1-NC组相比分别下降40.6%和69.3%,K1-cmet-sh1组与K1-NC组比较、K1-cmet-sh2组与K1-NC组比较差异均有统计学意义(P<0.05),而K1-NC组与K1-CON组比较差异无统计学意义(P>0.05)。荧光定量PCR及Western blotting结果都表明重组慢病毒介导的RNAi能成功下调c-met表达。
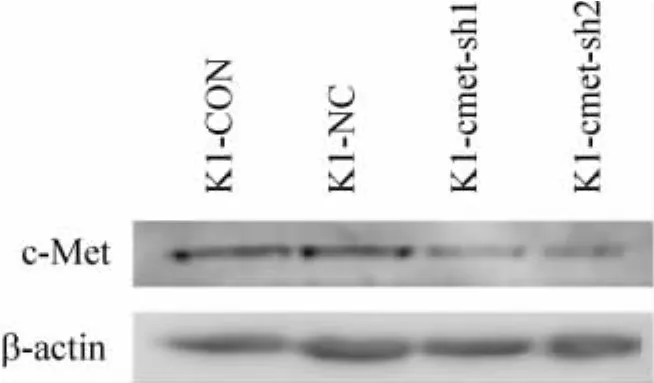
Figure 5.The effect of c-met RNAi lentivirus on c-met protein expression in K1 cells.图5 c-met RNAi慢病毒对K1细胞c-met蛋白表达的影响
5 重组慢病毒感染K1细胞后细胞克隆形成能力的变化
克隆形成实验结果见图6。显微镜下观察计数,记录含有50个细胞以上的克隆数,计算细胞克隆形成率,克隆形成率(%)=克隆数/接种细胞数 ×100%。结果显示 K1-cmet-sh2组(11.5% ±1.3%)的克隆形成率明显小于K1-NC组(17.5% ±1.0%)和 K1 -CON 组(18.6% ±1.2%),K1 -cmet-sh2组较K1-NC组的克隆形成率降低34.3%,K1-cmet-sh2组与 K1-NC组、K1-cmet-sh2组与K1-CON组两两比较差异均有统计学意义(P<0.01)。但K1-NC组与K1-CON组之间差异无统计学意义(P>0.05)。
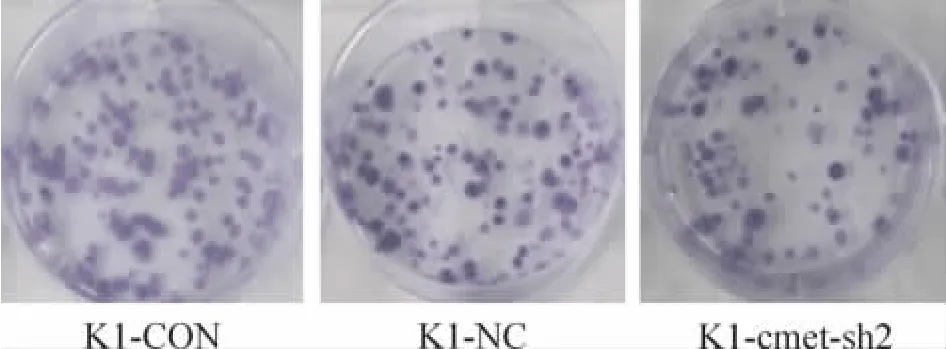
Figure 6.The effect of c-met RNAi lentivirus on colony formation activity of K1 cells.图6 c-met RNAi慢病毒对K1细胞克隆形成能力的影响
6 重组慢病毒感染K1细胞后细胞周期的改变
K1-cmet-sh2组 S期细胞(19.53% ±2.56%)较 K1-CON 组(40.85% ±5.56%)和 K1-NC组(36.75% ±5.32%)都有所较少,且有显著差异(P<0.05),而 K1-CON 组(40.85% ±5.56%)与 K1-NC组(36.75% ±5.32%)相比无明显差异(P>0.05),见图 7。
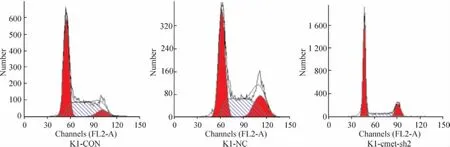
Figure 7.The effect of c-met RNAi lentivirus on cell cycle of K1 cells.图7 c-met RNAi慢病毒对K1细胞细胞周期的影响
7 重组慢病毒感染K1细胞后细胞迁移能力的改变
划痕实验结果见图8。分别测量0 h和48 h的划痕宽度,平均迁移距离=(0 h的划痕宽度-48 h的划痕宽度)/2。结果显示 K1-cmet-sh2组[(146.2±16.6)μm]平均迁移距离小于 K1-NC 组[(210.8±19.7)μm]和 K1 -CON 组[(213.6 ±20.2)μm],K1-cmet-sh2组较K1-NC组的平均迁移距离减少30.6%,K1-cmet-sh2组与K1-NC组、K1-cmet-sh2组与K1-CON组两两比较差异均有统计学意义(P<0.05),但K1-NC组与K1-CON组之间差异无统计学意义(P>0.05)。
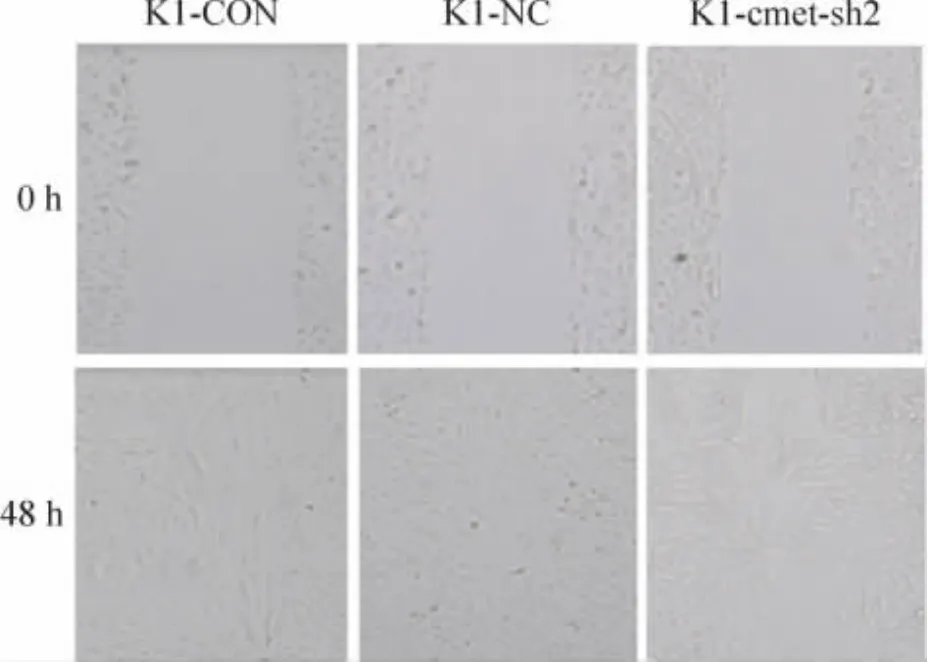
Figure 8.The effect of c-met RNAi lentivirus on migrative activity of K1 cells(×40).图8 c-met RNAi慢病毒对K1细胞迁移能力的影响
8 重组慢病毒感染K1细胞后细胞侵袭能力的改变
倒置显微镜下观察并计数穿过滤膜的细胞数,随机计数5个视野,Transwell实验结果见图9,结果显示 K1-cmet-sh2组[(11.4±1.9)个]细胞数明显小于K1-NC组[(16.4±1.9)个]和K1-CON组[(17.2±2.1)个],K1-cmet-sh2组较 K1-NC 组的迁移细胞数减少30.5%,K1-cmet-sh2组与K1-NC组、K1-cmet-sh2组与K1-CON组两两比较差异有统计学意义(P<0.05),但K1-NC组与K1-CON组之间差异无统计学意义(P>0.05)。
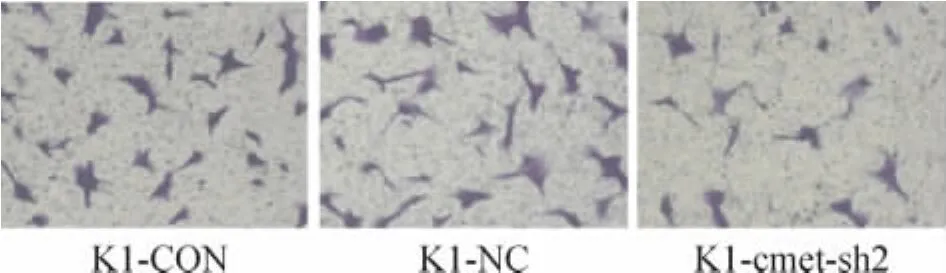
Figure 9.The effect of c-met RNAi lentivirus on invasive activity of K1 cells(×100).图9 c-met RNAi慢病毒对K1细胞侵袭能力的影响
9 裸鼠成瘤实验
接种8 d后阴性对照组可见肿瘤长出,接种20 d后RNAi组见肿瘤长出。接种30 d后将裸鼠处死,见图10。RNAi组的肿瘤体积[(35.0 ±3.2)mm3]明显小于阴性对照组[185.0±12.6)mm3](P <0.05)。

Figure 10.The effect of c-met RNAi lentivirus on the tumor growth of subcutaneous implantation in the nude mice.图10 c-met RNAi慢病毒对裸鼠皮下抑制瘤生长的影响
讨 论
乳头状甲状腺癌是甲状腺癌中最常见的类型,青少年、女性多见,淋巴结转移较早,虽然绝大多数病人经手术、放射碘等治疗后预后较好,但仍有少数病人会发生远处转移,因此寻找一种新的治疗方法已成为一个重要课题。而慢病毒介导的RNA干扰就是近年来发展起来的一项新技术,能特异而有效、稳定地阻断靶基因的表达。
c-Met是具有酪氨酸激酶活性的跨膜受体,它与HGF结合后,胞内区发生自身磷酸化,从而激活下游的PI3K/AKT、MEK/MAPK信号通路,导致细胞发生增殖、侵袭等生物学反应[4-6]。c-Met在不同的肿瘤中可以以点突变、基因移位、基因扩增、过度表达、和HGF形成自分泌环等方式发挥作用,引起促肿瘤细胞增殖、抗凋亡、促侵袭和转移的作用。已有不少研究证实c-Met在乳头状甲状腺癌中高表达,并与其病理分期、侵袭及转移密切相关。因此猜测c-Met参与了甲状腺癌发生与发展的过程,理论上阻断肿瘤细胞c-Met信号转导通路就有可能减低细胞增殖、迁移、侵袭等能力从而抑制肿瘤复发转移。而目前国内尚未见慢病毒介导的c-met RNAi的用于甲状腺癌方面的研究。
克隆形成能力反映细胞群体依赖性和增殖能力两个重要特征,更倾向于反映肿瘤细胞的“接触不抑制”特征[7],是反映肿瘤恶性程度的手段。张盛周等[8]用腺病毒介导c-met RNAi后抑制了肝癌细胞的克隆形成能力。在本实验中我们应用克隆形成实验检测了下调c-met后细胞克隆形成能力的变化,结果显示细胞的克隆形成能力减低。
姬长友等[9]下调 c-met后,喉癌 Hep-2细胞的迁移侵袭能力降低;Wang等[10]下调肺小细胞癌SCLC细胞的c-met后,细胞迁移侵袭能力减低;Chu等[11]下调神经胶质瘤U251细胞的 c-met后,细胞侵袭能力也减低。由此我们推测下调甲状腺癌细胞c-met后细胞的迁移侵袭能力也将会有所减低。在本实验中,我们运用划痕实验和Transwell实验检测体外细胞的迁移侵袭能力,而Transwell小室是目前最为理想的模拟体外细胞侵袭的模型,结果显示下调c-met后细胞的迁移侵袭能力都降低,与我们之前预测的相符。
细胞周期调控机制的紊乱是肿瘤细胞恶性转化的重要因素。细胞周期主要由细胞周期素和细胞周期依赖性激酶形成的复合物进行调节,此复合物的激活和失活可调控细胞周期不同时期之间的转换,其中G1-S和G2-M期的转换为2个关键的检查点[12]。许多基因的突变或失活均可导致细胞周期的失调。在本实验中,我们运用流式细胞术检测细胞周期,结果显示 c-met下调后,细胞周期的进程减慢。
为了证实细胞在体内的生长状况,我们将cmet下调后的细胞接种到裸鼠体内,观察其对K1细胞成瘤能力的影响,结果显示c-met下调后的细胞在裸鼠皮下的成瘤能力降低。
综上所述,通过慢病毒介导的RNAi可以有效降低甲状腺癌K1细胞c-met的表达,这种c-met的下调能够抑制细胞的克隆形成、细胞周期进程、迁移侵袭能力和成瘤能力,由此推测,c-met可能成为未来诊断和治疗甲状腺癌的潜在靶点,这也为临床上对乳头状甲状腺癌进行基因治疗提供了理论依据。
[1]Benvenuti S,Comoglio PM.The MET receptor tyrosine kinase in invasion and metastasis[J].J Cell Physiol,2007,213(2):316-325.
[2]Siraj AK,Bavi P,Abubaker J,et al.Genome- wide expression analysis of Middle Eastern papillary thyroid cancer reveals c-MET as a novel target for cancer therapy[J].J Pathol,2007,213(2):190 -199.
[3]Su JL,Shih JY,Yen ML,et al.Cyclooxygenase-2 induces EP1-and HER-2/Neu-dependent vascular endothelial growth factor-C up-regulation:a novel mechanism of lymphangiogenesis in lung adenocarcinoma[J].Cancer Res,2004,64(2):554 -564.
[4]Coltella N,Manara MC,Cerisano V,et al.Role of the MET/HGF receptor in proliferation and invasive behavior of osteosarcoma[J].FASEB J,2003,17(9):1162 - 1164.
[5]Maulik G,Madhiwala P,Brooks S,et al.Activated c-Met signals through PI3K with dramatic effects on cytoskeletal functions in small cell lung cancer[J].J Cell Mol Med,2002,6(4):539 -553.
[6]Ma PC,Tretiakova MS,Nallasura V,et al.Downstream signalling and specific inhibition of c-MET/HGF pathway in small cell lung cancer:implications for tumour invasion[J].Br J Cancer,2007,97(3):368 -377.
[7]Miyamoto A,Shibamoto Y,Sugie C,et al.Absence of radioadaptive responses in four cell-lines in vitro as determined by colony formation assay[J].Kurume Med J,2006,53(1 -2):1 -5.
[8]张盛周,张宏霞,潘飞燕,等.腺病毒介导的siRNA下调c-Met表达抑制肝癌细胞生长[J].肿瘤防治研究,2008,35(5):309 -312,320.
[9]姬长友,谢治年,陈继川,等.RNA干扰抑制c-Met表达对喉癌Hep-2细胞体内外生长的影响[J].中华耳鼻咽喉头颈外科杂志,2010,45(1):61-67.
[10]Wang ZX,Lu BB,Yang JS,et al.Adenovirus-mediated siRNA targeting c-Met inhibits proliferation and invasion of small- cell lung cancer(SCLC)cells[J].J Surg Res,2011,171(1):127 -135.
[11]Chu SH,Feng DF,Zhang H,et al.c-Met-targeted RNA interference inhibits growth and metastasis of glioma U251 cells in vitro[J].J Neurooncol,2009,93(2):183 -189.
[12]Kawabe T.G2checkpoint abrogators as anticancer drugs[J].Mol Cancer Ther,2004,3(4):513 -519.
