右美托咪定对大鼠脑缺血再灌注损伤后星形胶质细胞的影响*
2012-07-31刘付宁纪风涛何惠燕梁建军曹铭辉
刘付宁,纪风涛,何惠燕,梁建军,刘 玲,曹铭辉△
(中山大学孙逸仙纪念医院 1麻醉科,2供应中心,广东 广州 510120)
脑血管病是当今影响人类健康及致死、致残的主要疾病之一,其中以缺血性脑血管病最为常见。对缺血脑组织进行及时再灌注是治疗脑卒中的有效措施,但再灌注会引起脑缺血再灌注损伤。脑缺血再灌注损伤时,神经元与胶质细胞、胶质细胞与胶质细胞之间的相互作用对神经元的存活具有重要作用。星形胶质细胞是中枢神经系统内数量最多的一类细胞,也是中枢神经系统微环境的主要构成成分,对维持神经元微环境的稳定和调节代谢过程起重要作用[1-2]。近年来研究发现星形胶质细胞在脑缺血后非常活跃,主要表现为胶质细胞增生、肥大,胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)表达水平升高,并且合成多种炎症因子,介导炎症反应从而导致大脑神经组织损伤[3]。在星形胶质细胞诱导产生的多种炎症因子中,肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)是炎症反应的主要致炎因子,在细胞因子的释放顺序中处于源头,参与了脑缺血后炎症与细胞死亡的过程[4]。
盐酸右美托咪定(dexmedetomidine,DEX)是一种新型高选择性的α2-肾上腺素受体激动剂,于2009年6月在我国上市。它除了具有镇痛、镇静和抗焦虑作用,还具有抗交感、抑制应激反应、稳定血流动力学和减少麻醉药用量作用等,目前已广泛应用于临床各个领域。最近研究发现DEX具有脑保护作用,但具体作用机制目前研究很少。我们前期实验发现DEX对胶质细胞具有调控作用[5],但是DEX能否通过调控胶质细胞达到脑保护作用目前还不清楚。本实验拟在建立局灶脑缺血/再灌注模型,通过观察DEX对星形胶质细胞的影响,探讨DEX在脑保护中的作用机制。
材料和方法
1 材料
SPF级SD大鼠,雌性,体重220~250 g,由中山大学实验动物中心提供;DEX购自恒瑞制药,GFAP单克隆抗体购自Neomarkers;TNF-α多克隆抗体购自武汉博士德生物技术有限公司;β-actin单克隆抗体购自Sigma;HRP标记山羊抗鼠IgGⅡ抗购自Amersham。TBST配制抗体稀释液和Western blotting化学发光检测试剂盒购自碧云天生物技术公司。
2 动物选择和分组
健康雌性SD大鼠60只,随机分为假手术组(sham 组)、缺血/再灌注组(ischemia/reperfusion,I/R组)、DEX1组(缺血前30 min腹腔给予DEX 20 μg/kg)和DEX2组(缺血前30 min腹腔给予DEX 40 μg/kg)。
3 动物模型制作
SD大鼠术前禁食12 h,自由饮水,动物模型制作参考Longa等[6]的制作方法制作大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)缺血再灌注模型。实验前腹腔注射10%水合氯醛0.35 g/kg麻醉后,分离出右侧颈外动脉,以尼龙线栓塞右侧大脑中动脉,栓线深度18~20 mm,阻断2 h后再灌注,缝合皮下组织和皮肤,完成脑缺血/再灌注模型。大鼠清醒后进行神经功能缺失评分:无明显神经功能缺失为0分;左侧前爪不能伸直为1分;行走时向左侧旋转为2分;行走时身体向左侧倾倒者为3分;不能自发行走,意识丧失者为4分。
4 给药
DEX1组和DEX2组给药如前所述;I/R组给予等量的生理盐水,sham组只作切口和动脉分离手术,但不行脑缺血再灌注。
5 HE染色
大鼠在缺血24 h后,以10%水合氯醛腹腔注射将其麻醉,开胸经心脏灌流生理盐水,然后输注4%多聚甲醛灌流固定,断头取脑。甲醛固定,冠状脑片制备,选择梗死最大层面,梯度乙醇脱水,石蜡包埋,制成4~6 mm厚的切片,附片,行苏木素-伊红染色。在4倍镜下观测缺血区面积,经图像分析软件统计处理得出各组的平均缺血面积。
6 免疫组织学观察
各组SD大鼠脑缺血再灌注24 h后断头取脑,将脑组织迅速置-80℃冷冻并保存。-20℃恒冷切片机于自额极至枕叶分为5等份,取第3片脑片范围内连续切片(厚4 μm),冰冻切片置4%多聚甲醛磷酸盐缓冲液中固定10 min,3%H2O2室温10 min;0.01 mmol/L PBS浸泡 3次,5 min/次,0.01 mol/L枸橼酸盐缓冲液(pH 6.0)中微波修复10 min,自然冷却至室温。正常山羊血清液封闭10 min,滴加抗小鼠GFAP单克隆或TNF-α多克隆抗体,4℃过夜;滴加生物素标记抗小鼠Ⅱ抗,37℃孵育20 min;滴加辣根过氧化物酶标记链霉素卵白素,37℃孵育20 min;DAB显色,苏木精复染,封片。常规设立阴性对照,以缺血病灶为观察部位,400倍光镜下随机选择不重叠10个海马区视野,以胞浆和突起呈棕黄色的细胞为GFAP阳性表达细胞,以胞浆、胞膜呈棕黄色的细胞为TNF-α阳性表达细胞,每组5只大鼠,每只大鼠随机选取5张非连续切片,计算每只大鼠平均阳性细胞数。
7 蛋白印迹技术检测大鼠大脑皮质的GFAP表达的变化
大鼠断头处死后迅速取出右侧大脑组织,用预冷PBS液冲去表面血迹,置冰盘上快速分离右侧顶叶皮质,取大鼠大脑组织1 mg加入10 mL体积的比例加入蛋白裂解液,冰上裂解、匀浆,5000 r/min离心15 min,提取总蛋白,BCA法测蛋白浓度。经10%SDS-PAGE凝胶电泳、转膜、封闭后,加入Ⅰ抗孵育过夜。加入标记辣根过氧化物酶的抗鼠/兔的IgGⅡ抗,室温下孵育1 h,ECL显色,扫描后用Image J软件分析系统定量,计算灰度值,以β-actin灰度值进行校正,再以sham组为100%进行校正,实验重复3次。
8 统计学处理
结 果
1 神经功能行为评分
缺血/再灌注后各组大鼠均出现了不同程度神经功能损害症状,神经功能缺损评分均高于sham组,与I/R组比较,DEX1组和DEX2组神经功能缺失评分明显降低,见表1。
表1 DEX对大鼠脑缺血再灌注损伤后神经功能缺失评分和梗死面积的影响Table 1.Effects of DEX on neurological deficiency scores and infarct size in rats with ischemia/reperfusion(.n=6)

表1 DEX对大鼠脑缺血再灌注损伤后神经功能缺失评分和梗死面积的影响Table 1.Effects of DEX on neurological deficiency scores and infarct size in rats with ischemia/reperfusion(.n=6)
★P<0.05 vs sham;△P<0.05 vs I/R;#P<0.05 vs DEX1.
Sham 0 0 I/R 3.89±0.45★ 1.70±0.31★DEX1 2.13±0.38★△ 1.21±0.23★△DEX2 2.03±0.51★△ 1.06±0.07★△#
2 HE染色
光镜下见sham组大鼠脑组织细胞排列有序,细胞形态和结构正常,神经元核圆形,边界及核仁清晰,胞浆染色均匀淡染,胞膜完整;I/R组大鼠脑组织有缺血性损伤改变,缺血区扩展到整个大脑中动脉供应区,其脑组织着色浅,细胞染色淡,数量明显减少,与正常脑组织有过渡区,细胞数量减少,部分细胞胞体缩小,胞核固缩,染色质浓缩,缺血边缘区也表现为水肿;DEX1组和DEX2组也可见缺血性损伤改变,但面积较I/R组相应减小,细胞水肿较轻,变性坏死数量较少。与DEX1组比较,DEX2组脑梗死面积减小,见图1、表1。
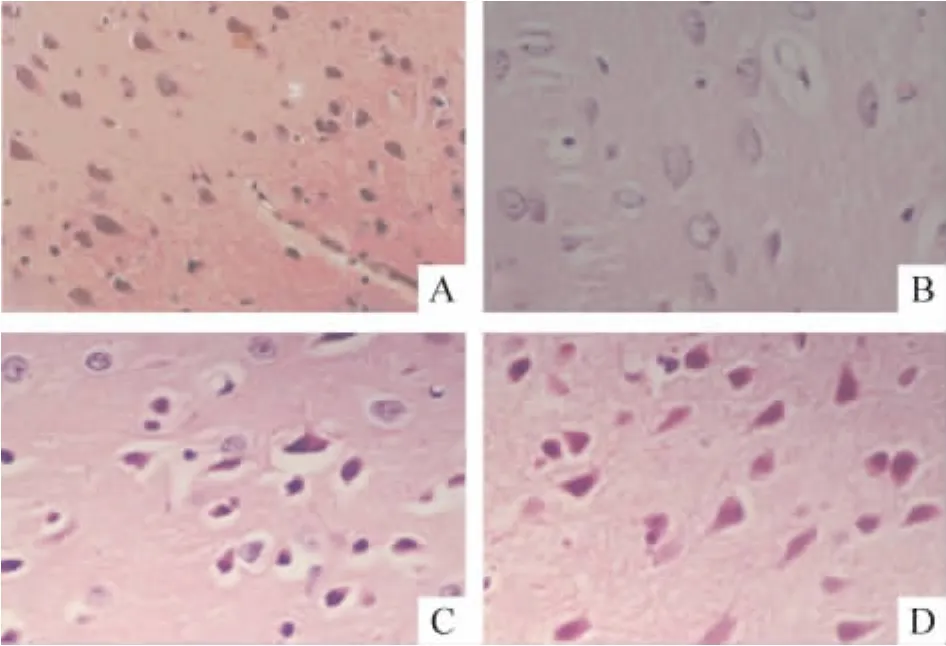
Figure 1.The pathological changes of the brain in rats after 2 h of MCAO followed by 24 h of reperfusion in various groups(HE staining,×400).A:sham;B:I/R;C:DEX1;D:DEX2.图1 各组大鼠大脑组织HE染色
3 免疫组织学改变
3.1 免疫组织学检测GFAP表达变化 在sham组大脑,星形胶质细胞GFAP表达较少,细胞淡染,胞体小,突起细少,纤维排列呈放射状,GFAP阳性星形胶质细胞少;I/R组星形胶质细胞GFAP表达明显增多,染色呈深棕黄色,胞体肥大,突起粗大不规则,GFAP阳性星形胶质细胞明显增多,呈强阳性;而DEX1组和DEX2组星形胶质细胞GFAP表达多于sham组,但比I/R组减少,胞体形态趋于正常,GFAP阳性星形胶质细胞也相应减少,见图2。
3.2 各组大鼠GFAP阳性细胞计数 脑缺血再灌注后I/R组脑组织内有较多细胞表达GFAP,脑缺血后GFAP阳性细胞数较sham组显著增多(P<0.05),DEX预处理后GFAP阳性细胞数均较I/R组显著减少(P<0.05),且DEX2组比DEX1组减少更显著(P <0.05),见表2。
3.3 免疫组织学检测TNF-α表达变化 Sham组大鼠脑组织偶然可以看到零散分布的TNF-α阳性细胞,均为神经元样细胞。I/R组梗死区TNF-α阳性神经元样细胞增多,同时TNF-α阳性星形胶质细胞增多,呈强阳性。而DEX预处理组TNF-α阳性星形胶质细胞多于sham组,但比I/R组减少,见图3。
3.4 各组大鼠TNF-α阳性细胞计数 与sham组比较,脑缺血再灌注后I/R组TNF-α阳性细胞数显著增多(P<0.05),而DEX预处理后TNF-α阳性细胞数均较 I/R组显著减少(P<0.05),并且DEX2组比DEX1组减少更显著(P<0.05),见表2。
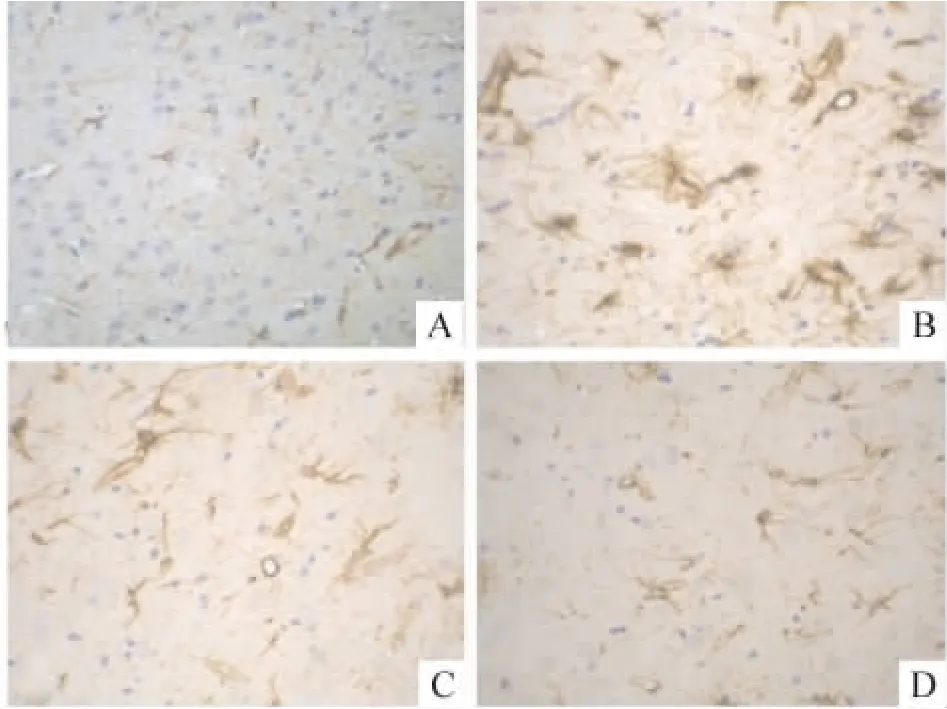
Figure 2.Effects of DEX on GFAP-labeled cells in ischemic area of brain in rats after 2 h of MCAO followed by 24 h of reperfusion in various groups(DAB,×400).A:sham;B:I/R;C:DEX1;D:DEX2.图2 DEX对大鼠脑缺血再灌注损伤后缺血侧大脑GFAP表达的影响

Figure 3.Effects of DEX on TNF-α-labeled cells in ischemic area of brain in rats after 2 h of MCAO followed by 24 h of reperfusion in various groups(DAB,×400).A:sham;B:I/R;C:DEX1;D:DEX2.图3 DEX对大鼠脑缺血再灌注损伤后缺血侧大脑TNF-α表达的影响
表2 星形胶质细胞表达GFAP和TNF-α蛋白的计数Table 2.Counting of astrocytes expressing TNF-α and GFAP proteins in rats(.n=6)

表2 星形胶质细胞表达GFAP和TNF-α蛋白的计数Table 2.Counting of astrocytes expressing TNF-α and GFAP proteins in rats(.n=6)
★P<0.05 vs sham;△P<0.05 vs I/R;#P<0.05 vs DEX1.
Group GFAP TNF-α Sham 13.39±1.40 1.06±0.09 I/R 34.84±3.45★ 7.10±2.51★DEX1 23.26±2.57★△ 3.48±0.47★△DEX2 19.71±4.52★△# 3.06±0.64★△#
4 Western blotting检测DEX预处理对GFAP表达的影响
GFAP蛋白表达水平在缺血再灌注组24 h后明显升高,DEX预处理后,GFAP表达水平比缺血再灌注组显著降低,且以DEX2组效果更加明显。
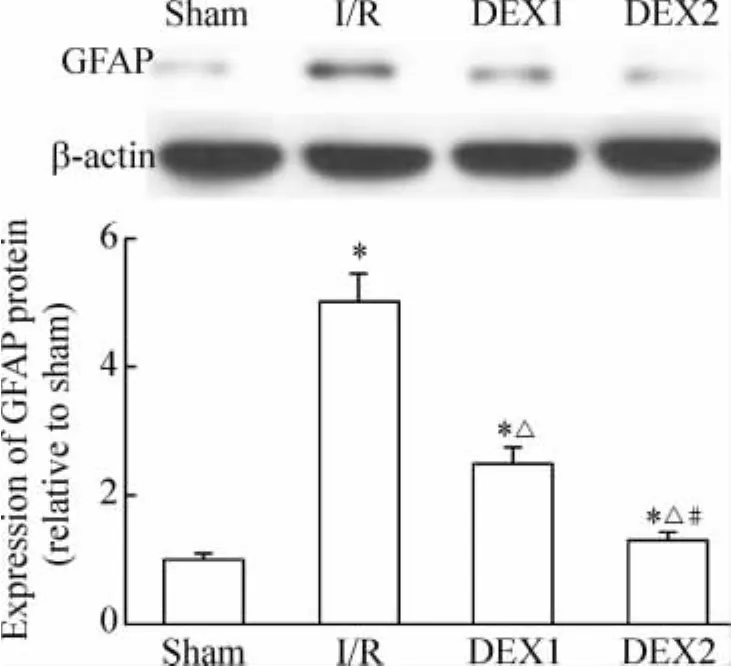
Figure 4.Effects of DEX on the expression of GFAP in rats..n=6.*P <0.05 vs sham;△P <0.05 vs I/R;#P <0.05 vs DEX1.图4 DEX对大鼠脑缺血再灌注后缺血侧大脑皮层GFAP表达的影响
讨 论
脑血管病变是临床多发病、常见病。近年来,其发病率、致死率和致残率有上升趋势,成为目前临床上致残、致死的主要原因,其中又以缺血性脑血管病变最为常见。缺血性脑血管病变特别是脑缺血后的再灌注损伤,危害大,其相关机制的研究一直是临床和基础研究的焦点。目前,对于脑缺血/再灌注损伤机制的研究主要集中在兴奋性神经毒性、氧化损伤、炎症反应、Ca2+超负荷等方面,其中,缺血再灌注时的炎症反应是脑缺血/再灌注损伤的主要机制之一[7]。近年来研究发现星形胶质细胞在脑缺血后非常活跃,主要表现为胶质细胞增生、肥大,GFAP表达水平升高,并且合成多种炎症因子,介导炎症反应从而导致大脑神经组织损伤[1-2]。因此,我们采用DEX作为干预手段,通过观察其对缺血再灌注损伤后星形胶质细胞的影响,探讨其对缺血再灌注损伤保护的可能机制。GFAP是一种中间丝蛋白,作为星形胶质细胞的细胞骨架,同时它也是星形胶质细胞中的一种标志蛋白,参与维持神经元内环境的稳定和血脑屏障的功能。在星形胶质细胞激活后除了胶质细胞胞体的增生、肥大,同时也出现星形胶质细胞胶质纤维酸性蛋白表达增强的现象,并且其表达水平与星形胶质细胞激活程度密切相关[8-10]。我们的实验发现缺血再灌注24 h后,星形胶质细胞GFAP表达量增加,这与Romão等[11]的研究结果一致。
DEX是一种新型高选择性α2-肾上腺素受体激动剂,在我国上市后,由于它除了具有镇痛、镇静和抗焦虑作用,还具有抗交感、抑制应激反应、稳定血流动力学和减少麻醉药用量等多方面作用,目前已广泛应用于临床各个领域。DEX主要药理作用主要是通过激活脑干蓝斑去甲肾上腺素能神经元α2受体后,产生镇静作用;并抑制下行延髓-脊髓去甲肾上腺素能通路突触前膜P物质和其它伤害性肽类的释放,产生镇痛作用[12-13]。这说明 DEX对神经元兴奋性具有抑制作用。但DEX对星形胶质细胞影响的研究很少,特别是DEX对缺血再灌注后星形胶质细胞的影响未见报道。实验中我们发现DEX 20 μg/kg或 DEX 40 μg/kg明显抑制了缺血再灌注诱导的星形胶质细胞GFAP和TNF-α的表达增加,并且以DEX 40 μg/kg效果更加明显,提示DEX可能对缺血再灌注诱导的星形胶质细胞激活有直接抑制作用。一方面有研究发现α2受体不但分布于中枢去甲肾上腺素能神经元突触前膜,中枢神经系统胶质细胞膜也有分布[14];另一方面,Chen 等[15]研究发现,在体外培养的星形胶质细胞加入DEX后细胞内CO2生成增加,氧化代谢增强,星形胶质细胞对细胞间隙谷氨酸的清除能力增加,细胞外谷氨酸含量减少,谷氨酸激活星形胶质细胞膜上N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体减少,星形胶质细胞激活减少。
近年来,星形胶质细胞激活和缺血再灌注损伤的关系越来越受到人们的关注。一方面,脑缺血后星形胶质细胞激活,其对细胞间隙的谷氨酸及H+、K+等清除能力增加,释放神经营养因子增多,有助于脑缺血后受损神经元的修复;另一方面,星形胶质细胞的过度激活影响受损神经元修复和功能恢复,同时通过释放谷氨酸造成兴奋性氨基酸毒性、释放炎症因子等,加重神经元的损伤。目前,星形胶质细胞在脑缺血再灌注过程中发挥保护或损伤作用的时间及深入机制尚未明确,还有待进一步研究。本实验发现DEX对大脑缺血再灌注损伤具有保护作用,其作用机制可能与抑制星形胶质细胞过度激活、减少星形胶质细胞释放TNF-α等炎症因子有关。
[1]Yu AC,Lau LT.Expression of interleukin-1 alpha,tunlor necrosis factor alpba and interleukin-6 genes in astrocytes under ischemic injury[J].Neurochem Int,2000,36(4-5):369-377.
[2]Voherra A,Meldolesi J.Astrocytes,from brain glue to communication elements:the revolution continues[J].Nat Rev Neurosci,2005,6(8):626-640.
[3]李树清,罗海芸.缺血后适应对树鼬海马CAl区脑血流及星形胶质细胞活化的影响及可能机制[J].中国病理生理杂志,2008,24(6):1090-1095.
[4]胡建鹏,王 键,郜 峦,等.局灶性脑缺血再灌注时神经元、胶质细胞形态变化与TNF-α、C-Myc表达相关的实验研究[J].中国病理生理杂志,2004,20(7):1251-1255.
[5]Liu L,Ji F,Liang J,et al.Inhibition by dexmedetomidine of the activation of spinal dorsal horn glias and the intracellular ERK signaling pathway induced by nerve injury[J].Brain Res,2012,1427:1-9.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7]Acalovschi D,Wiest T,Hartmann M,et a1.Muhiple levels of regulation of the interleukin-6 system in stroke[J].Stroke,2003,34(8):1864-1869.
[8]Comes FC,Paulin D,Moura Nero V.Glial fibrillary acidic protein(GFAP):modulation by growth factors and its implication in astrocyte differentiation[J].Braz J Med Biol Res,1999,32(5):619-631.
[9]Dietrich WD,Danton G,Hopkins AC,et al.Thromboembolic events predispose the brain to widespread cerebral infarction after delayed transient global ischemia in rats[J].Stroke,1999,30(4):855-861.
[10]Eng LF,Chimikar RS,Lee YL.Glial fibrillary acidic protein:GFAP-thirty-one years(1969-2000)[J].Neurochem Res,2000,25(9-10):1439-1451.
[11]Romão LF,Sousa Vde O,Neto VM,et al.Glutamate activates GFAP gene promoter from cultured astrocytes through TGF-beta1 pathways[J].J Neurochem,2008,106(2):746-756.
[12]Nacif-Coelho C,Correa-Sales C,Chang LL,et al.Perturbation of ion channel conductance alters the hypnotic response to the α2-adrenergic agonist dexmedetomidine in the locus coeruleus of the rat[J].Anesthesiology,1994,81(6):1527-1534.
[13]Hodgson PS,Liu SS.New developments in spinal anesthesia[J].Anesthesiol Clin North America,2000,18(2):235-249.
[14]Ampatzis K,Kentouri M,Dermon CR.Neuronal and glial localization of α2A-adrenoceptors in the adult zebrafish(Danio rerio)brain[J].J Comp Neurol,2008,508(1):72-93.
[15]Chen Y,Zhao Z,Code WE,et al.A correlation between dexmedetomidine-induced biphasic increases in free cytosolic calcium concentration and energy metabolism in astrocytes[J].Anesth Analg,2000,91(2):353-357.
