乌司他丁对心肺复苏后兔脑组织氧化应激损伤的影响*
2012-07-31夏金明胡春林魏红艳李颖庆廖晓星荆小莉
夏金明,胡春林,李 欣,李 慧,魏红艳,李颖庆,廖晓星,荆小莉△
(1中山大学附属第一医院急诊科,广东 广州 510080;2杭州师范大学附属医院急诊科,浙江 杭州 310015)
随着人口老龄化,心脑血管病已经成为当今社会最主要、最常见的疾病之一,心脏性猝死(sudden cardiac death,SCD)也随之成为中老年患者死亡的重要原因,而有效的心肺复苏(cardiopulmonary resus-citation,CPR)是成功抢救这类患者的首要步骤。尽管由于CPR新指南的出台、复苏技术的发展和公众CPR技术的普及,SCD病人的自主循环恢复(return of spontaneous circulation,ROSC)率得到了显著提高,成功率可达20%~50%[1],然而仅有2%~15%的病人能存活出院[2],大多数病人死于CPR后全脑缺血缺氧导致的神经元损伤,即使幸免存活者,其中40%~50%也伴有不同程度的神经功能障碍和缺失[3]。因此,脑复苏是CPR成功的关键。
氧化应激损伤是CPR后脑损伤的主要机制之一[4],而核因子 E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是机体对抗氧化应激最重要的细胞防御机制[5]。Nrf2通过与胞浆蛋白 Kelch样环氧氯丙烷相关蛋白-1(Kelch-like epichlorohydrinassociated protein 1,KEAP1)以及抗氧化反应元件(antioxidant response element,ARE)相互作用,启动下游编码抗氧化蛋白和 II相解毒酶的基因表达,发挥细胞保护作用[6]。我们前期的研究表明乌司他丁(ulinastatin,UTI)可减轻 CPR 后脑损伤[7],但其具体机制还不清楚。本文从UTI对CPR后氧化应激的影响探讨UTI的脑保护作用机制,类似研究国内外还未见报道。
材料和方法
1 动物与分组
56只雄性新西兰成年大白兔,由中山大学实验动物中心提供。动物购进后饲养1周,实验前晚禁食不禁水。实验1:8只新西兰兔建立CA模型,ROSC后24 h内连续采血监测血浆丙二醛(malondialdehyde,MDA)和还原型谷胱甘肽 (glutathione,GSH)水平。实验2:48只新西兰兔建立CA模型,ROSC后随机分为模型组(model组)和UTI组,每组分别于ROSC后2 h、4 h和8 h取大脑皮层和海马,测定MDA和GSH含量,检测Nrf2激活情况;其余动物存活72 h后取大脑皮层和海马,TUNEL法检测原位细胞凋亡。
2 主要试剂及设备
MDA和GSH测定试剂盒购自南京建程生物工程研究所;TUNEL凋亡试剂盒购自Roche;BCA法蛋白定量试剂盒、核/胞浆蛋白提取试剂盒购自北京百泰克生物技术有限公司;戊巴比妥钠购自Sigma;Nrf2试剂盒购自Abcam;UTI购自广州天普生化医药股份有限公司。小动物呼吸机(RODENT VENTILATOR 683.Harvard Apparatus);4道生理信号采集分析系统(BIOPAC SYSTEMS MAP150,Inc.MP100A -CE Santa Barbara);动物除颤仪(SAN-ei Cardiopace 3MII)。
3 方法
3.1 术前准备 戊巴比妥钠(30 mg/kg)经兔左耳缘静脉注入,麻醉成功后,胸部备皮。选择3.0号气管导管经口气管插管,常规Ⅱ导联心电监护,小号留置针穿刺右耳动脉,接高敏感换能器监测动脉血压。心电图和动脉血压通过4道生理信号采集分析系统连续记录在电脑上。
3.2 建立CPR模型 按照本课题组前期的研究方法建立室颤-CPR模型[8-10]。采用经胸体表交流电(6 V,50 Hz)诱发室颤,诱发时间5~10 s。成功诱发室颤的标准为:心电监护显示室颤波形,血压迅速下降,接近0 mmHg。室颤持续5 min后开始CPR,行心前区胸外心脏按压,频率为200次/min,深度为胸腔前后径的1/3;同时接呼吸机,通气频率为45次/min,潮气量约10 mL/kg(根据血气分析结果调整呼吸机参数,使PCO2控制在35~45 mmHg之间)。复苏期间每3 min给予肾上腺素20 μg/kg。按压2 min后给予电除颤,选择能量为20~30 J。如15 min未恢复自主循环,终止实验。判断ROSC成功的标准为:恢复自主心律,平均动脉压大于60 mmHg并持续30 min以上。UTI组动物ROSC后立即给予UTI 10×104U/kg一次性经左耳缘静脉注入,而model组只给予等体积的生理盐水注入。ROSC后维持实验动物平均动脉血压大于60 mmHg,补充生理需要的能量。ROSC后所有动物维持机械通气2~3 h,断开呼吸机后如呼吸节律规则且血流动力学稳定,并持续1 h以上,停机械通气。ROSC后不予以维持麻醉。所有实验数据按照UTSTEIN模式记录。
3.3 血浆MDA和GSH水平测定 实验1组动物分别于复苏前、ROSC 后 0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h、5 h、7 h、9 h、12 h、18 h 和 24 h 从左耳缘静脉采血,离心后取上清用硫代巴比妥酸(thibabituric acid,TAB)法测定血浆MDA,用二硫代二硝基苯甲酸[5,5’-dithiobis(2-nitrobenzoic acid),DTNB]法测定GSH。
3.4 脑组织MDA和GSH含量测定 ROSC后2 h、4 h和8 h 3个时点各取4只兔并取其大脑皮层和海马,组织匀浆后用BCA法测定匀浆蛋白浓度,并测定MDA和GSH含量,计算出每毫克组织中MDA和GSH的含量。
3.5 Western blotting检测Nrf2蛋白水平 处理不同时段脑组织冻存标本,按照核/胞浆蛋白提取试剂盒说明,提取胞浆蛋白和核蛋白,BCA法蛋白定量。取50 μg蛋白进行聚丙烯酰胺凝胶电泳,按湿转法将电泳产物转移到PVDF膜,5%的脱脂奶粉封闭2 h,滴加Ⅰ抗(1∶1000)4℃过夜,TBST洗膜,5 min×3次,滴加HRB标记的Ⅱ抗(1∶3000)室温下孵育1 h,TBST洗膜,5 min×3次,Milipore发光液浸泡1 min,Koda胶片曝光,显影、定影,计算蛋白灰度。
3.6 脑组织凋亡神经元计数 ROSC后72 h过量麻醉处死动物,取大脑皮层和海马组织,用4%甲醛固定,做石蜡切片后TUNEL法原位细胞凋亡检测,在光镜400倍视野下,计数100×100像素内凋亡细胞数。
4 统计学处理
将数据录入SPSS 13.0统计软件,依据正态检验(Kolmogorov-Smirnov)结果数据分别用均数±标准差()或中位数(第1四分位数,第3四分位数)表示,用t检验或秩和检验(Mann-Whitney rank),以P<0.05为差异有统计学意义。
结 果
1 致颤及ROSC情况
实验1中8只动物,均致颤成功,有6只存活至ROSC后24 h。实验2中48只动物,均致颤成功,ROSC后2、4和8 h,每组各时点均分别处死4只动物,取材。Model组和UTI组各有6只存活到ROSC后72 h。2组动物的生理学参数如体重(body weight,BW)、心率(heart rate,HR)、呼吸频率(respiratory rate,RR)、平均动脉压(mean arterial pressure,MAP)和复苏相关的指标如基础生命支持时间(basic life support,BLS)、除颤次数(defibrillation times,DF-T)、肾上腺素(adrenaline,AD)用量之间没有显著差异,见表1、2。
表1 2组动物CPR前一般生理参数Table 1.Physiological parameters in the two groups before CPR(.n=18)
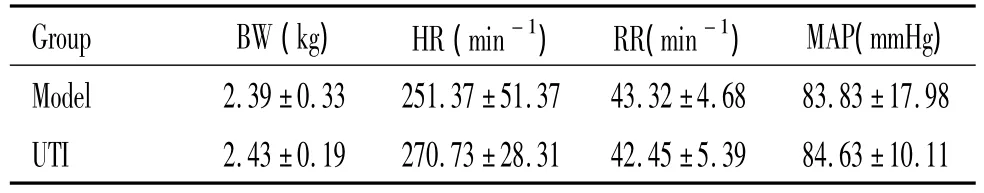
表1 2组动物CPR前一般生理参数Table 1.Physiological parameters in the two groups before CPR(.n=18)
Group BW(kg) HR(min-1) RR(min-1) MAP(mmHg)Model 2.39±0.33 251.37±51.37 43.32±4.68 83.83±17.98 UTI 2.43±0.19 270.73±28.31 42.45±5.39 84.63±10.11
表2 2组动物CPR相关指标Table 2.CPR-related indicators in the two groups(.n=18)
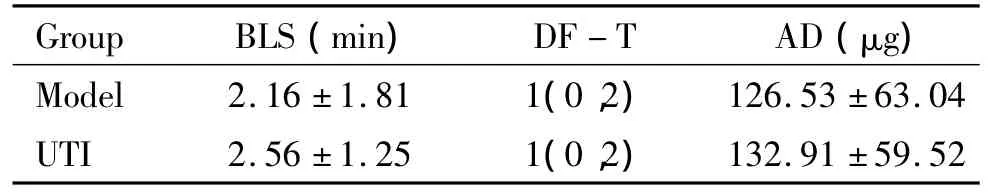
表2 2组动物CPR相关指标Table 2.CPR-related indicators in the two groups(.n=18)
Group BLS(min) DF-T AD(μg)Model 2.16 ±1.81 1(0,2)126.53 ±63.04 UTI 2.56 ±1.25 1(0,2)132.91 ±59.52
2 ROSC后24 h内血浆MDA和GSH的变化
ROSC后血浆MDA迅速升高,在ROSC后1.5~2 h左右达到峰值水平(195.51±23.57)μmol/L,见图1A,ROSC后血浆GSH明显下降,在ROSC后2 h达到最低谷[(69.89±14.53)mmol/L],见图1B。
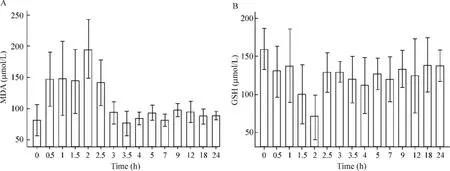
Figure 1.The changes of plasma MDA(A)and GSH(B)levels in 24 h after ROSC..n=6.图1 ROSC后24 h内血浆MDA和GSH的变化
3 ROSC后2 h、4 h和8 h脑组织MDA和GSH的含量
ROSC后2 h、4 h和8 h 3个时点2组动物大脑皮层与海马MDA含量见表3,结果发现UTI组ROSC后脑组织MDA含量明显低于model组,2组差异有统计学意义。
表3 ROSC后2 h、4 h和8 h兔脑组织MDA含量Table 3.The concentration of MDA in rabbit brain tissues at 2 h,4 h and 8 h after ROSC[μmol/(g protein)..n=4]

表3 ROSC后2 h、4 h和8 h兔脑组织MDA含量Table 3.The concentration of MDA in rabbit brain tissues at 2 h,4 h and 8 h after ROSC[μmol/(g protein)..n=4]
*P <0.05,** P <0.01 vs model group.
Hippocampus 2 h 4 h 8 h 2 h 4 h 8 h Model 17.28 ±1.43 14.75 ±1.20 12.12 ±1.24 17.1 Group Cortex 9 ±1.35 13.42 ±4.27 12.21 ±1.83 UTI 13.05 ±1.25** 11.51 ±0.68** 8.71 ±0.92** 13.02 ±1.19** 10.95 ±1.00* 7.59 ±1.92**
ROSC后2 h、4 h和8 h 3个时点2组动物大脑皮层与海马GSH含量见表4,UTI组ROSC后脑组织GSH含量明显高于model组,2组间差异有统计学意义。
表4 ROSC后2 h、4 h和8 h兔脑组织GSH含量Table 4.The concentration of GSH in rabbit brain tissues at 2 h,4 h and 8 h after ROSC[mmol/(g protein)..n=4]

表4 ROSC后2 h、4 h和8 h兔脑组织GSH含量Table 4.The concentration of GSH in rabbit brain tissues at 2 h,4 h and 8 h after ROSC[mmol/(g protein)..n=4]
** P <0.01 vs model group.
Hippocampus 2 h 4 h 8 h 2 h 4 h 8 h Model 1.97 ±0.58 1.59 ±0.36 1.22 ±0.24 2.22 ±0.Group Cortex 74 1.76 ±0.72 1.02 ±0.34 UTI 4.36 ±1.00** 3.61 ±0.86** 3.05 ±0.90** 4.59 ±0.53** 3.88 ±0.36** 3.13 ±0.32**
4 Western blotting检测Nrf2蛋白水平
Western blotting检测结果显示,ROSC后2、4和8 h model组胞核/胞浆Nrf2蛋白表达分别为0.91±0.08、0.87±0.04和 0.79±0.09,明显低于同时段UTI组(1.07±0.06、1.04±0.09和0.98±0.07,均P <0.05),见图2。

Figure 2.The expression of Nrf2 in the cortex of rabbits after ROSC..n=4.*P<0.05 vs model group.图2 ROSC后兔大脑皮层Nrf2蛋白的表达
5 ROSC后72 h大脑皮层及海马内神经元凋亡情况
ROSC后72 h 2组大脑皮层凋亡神经元数目model组为8.8±1.5,UTI组为5.7±1.0,P <0.01。海马CA1~CA3区model组凋亡神经元数目分别为17.2±1.2、13.5 ±2.1和17.3±2.7,明显多于 UTI组(14.2±1.5、11.0±0.9和13.7±1.6,P<0.05或P <0.01),见图3。
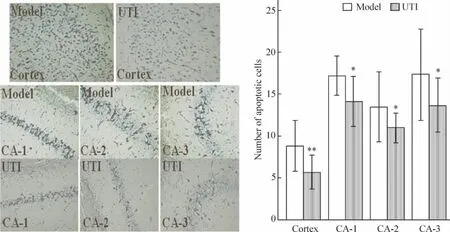
Figure 3.The apoptosis of neurons in cortex and hippocampus CA1~CA3 areas after ROSC 72 h(TUNEL staining,×400)..n=6.*P <0.05,**P <0.01 vs model group.图3 ROSC后72 h大脑皮层和海马CA1~CA3区神经元凋亡情况
讨 论
CA后机体血液循环近乎停止,全身各脏器和组织处于极为严重的缺血缺氧状态,经过有效及时的心肺复苏,ROSC后全身血运得以重建,但机体又将会面临新的伤害,即再灌注损伤[11]。大脑血液循环丰富,耗氧量也是全身最多的器官,因此CA会对脑组织产生极为严重的影响和后果,而神经元损伤会选择性出现在一些对缺血再灌注极为敏感的脑区,如海马、丘脑网状核和大脑皮层[3]等部位,而氧化应激损伤则是CPR后继发性脑损伤的主要机制之一[4]。
氧自由基会引起生物体内尤其是脑组织蛋白质、核酸和脂质过氧化损伤[12],导致体内氧化与抗氧化作用平衡失调,产生MDA等大量过氧化降解产物,破坏细胞膜,引起线粒体和内质网结构和功能改变,加重细胞能量代谢障碍,反过来促进新自由基的产生,周而复始,最终导致了神经元凋亡和坏死[13]。氧自由基还可使细胞色素C、凋亡蛋白酶激活因子1(apoptotic protease-activating factor 1,Apaf-1)等释放增加,通过多条途径导致神经元凋亡[3]。
在实验1中我们发现新西兰兔历经5 min的室颤以及随后2~5 min的CPR,自主循环恢复后血浆中MDA明显增高,在ROSC后2 h达到峰值水平,而体内重要的抗氧化剂GSH在CPR后有所下降,在ROSC后2 h达到最低谷。上述结果表明CA后机体出现了明显的氧化应激损伤,氧化产物大量产生,抗氧化物质明显减少,两者之间动态平衡被完全打破。因此,尽早干预ROSC后的失控性氧化应激损伤可能会给CA病人带来益处。
UTI是一种强力的蛋白酶抑制剂,可抑制多种酶的活性,能通过多种途径阻滞炎症反应及氧化应激的中间环节,减少TNF-α等致炎因子及介质的释放[14],抑制氧自由基的生成,降低血脑屏障通透性,减轻脑水肿,从而保护脑细胞[15-16]。我们在实验2中观察UTI对ROSC后不同时点大脑皮层、海马内MDA、GSH含量的变化和对神经元凋亡的影响,结果表明UTI明显减少ROSC后实验动物大脑皮层及海马内MDA含量、提高GSH含量。因此,我们认为UTI可显著抑制兔ROSC后大脑皮层和海马MDA水平,提高GSH含量,加强机体内抗氧化能力,维持氧化与抗氧化之间的平衡,保护大脑皮层及海马神经元。
Nrf2是细胞内抗氧化应激的重要转录因子。在生理状态下,Nrf2与KEAP1以二聚体的形式存在于细胞浆中[6]。在基础条件下,绝大部分Nrf2以非活性状态储存于细胞质中,与 KEAP1相偶联,后者与胞浆肌动蛋白结合而被锚定在胞浆,通过泛素介导的蛋白降解系统维持Nrf2的基础水平;另一部分Nrf2以活性状态存在于细胞核中介导基因的基本转录。泛素化的Nrf2很快被26S蛋白酶体降解,使Nrf2通路关闭,抑制26S蛋白酶可能使Nrf2在细胞核堆积,持续开放Nrf2通路[17]。26S蛋白酶是泛素化酶系统的重要成员,缺血再灌注后26S蛋白酶被激活,广泛参与组织损伤,抑制其激活可减轻组织损伤,保护缺血性心肌损伤[18-20],UTI可能通过抑制26S蛋白酶,减少Nrf2降解,促进其转入细胞核内。在实验2中Western blotting结果显示Nrf2蛋白表达在ROSC后2 h、4 h和8 h UTI组 Nrf2的胞核/胞浆比明显高于model组,表明CPR后UTI可促进Nrf2转入细胞核内与ARE相互作用,启动下游的抗氧化蛋白、II相解毒酶、蛋白酶体和分子伴侣等基因转录和表达[21],发挥其抗氧化作用,保护全身组织器官免受缺血再灌注带来的氧化损伤,减少神经元凋亡。
UTI已被广泛应用于临床,但在CPR后用于预防继发性脑损伤的研究还比较少,我们的研究表明UTI可升高ROSC后兔脑组织GSH水平,降低MDA含量,增加Nrf2的表达,减少神经元的凋亡,为UTI用于预防CPR后继发性脑损伤的治疗提供了一定的理论基础,其有效性还有待临床研究来证实。
[1]Cooper S,Janghorbani M,Cooper G.A decade of inhospital resuscitation:Outcomes and prediction of survival?[J].Resuscitation,2006,68(2):231-237.
[2]Fredriksson M,Herlitz J,Engdahl J.Nineteen years’experience of out-of-hospital cardiac arrest in Gothenburg-reported in Utstein style[J].Resuscitation,2003,58(1):37-47.
[3]Schneider A,Bottiger BW,Popp E.Cerebral resuscitation after cardiocirculatory arrest[J].Anesth Analg,2009,108(3):971-979.
[4]Huet O,Dupic L,Batteux F,et al.Postresuscitation syndrome:potential role of hydroxyl radical-induced endothelial cell damage[J].Crit Care Med,2011,39(7):1712-1720.
[5]Al-Omar FA,Nagi MN,Abdulgadir MM,et al.Immediate and delayed treatments with curcumin prevents forebrain ischemia-induced neuronal damage and oxidative insult in the rat hippocampus [J].Neurochem Res,2006,31(5):611-618.
[6]He X,Chen MG,Lin GX,et al.Arsenic induces NAD(P)H-quinone oxidoreductase I by disrupting the Nrf2·Keap1·Cul3 complex and recruiting Nrf2·Maf to the antioxidant response element enhancer[J].J Biol Chem,2006,281(33):23620-23631.
[7]胡春林,夏金明,魏红艳,等.乌司他丁对心肺复苏后兔脑损伤和心功能的影响[J].中华急诊医学杂志,2012,21(1):12-18.
[8]廖晓星,胡春林,文 洁,等.兔心肺复苏后经腹腔诱导亚低温的研究[J].中华急诊医学杂志,2010,19(1):16-20.
[9]Hu CL,Wei HY,Liu ZY,et al.Investigation of the relationship between venticular fibrillation duration and cardiac/neurological damage in a rabbit model of electrically induced arrhythmia[J].Trauma,2010,69(6):1442 -1447.
[10]胡春林,魏红艳,廖晓星,等.兔室颤心搏骤停模型的建立[J].中华急诊医学杂志,2009,18(9):943-947.
[11]Krep H,Brinker G,Pillekamp F,et al.Treatment with an endothelin type A receptor-antagonist after cardiac arrest and resuscitation improves cerebral hemodynamic and functional recovery in rats[J].Crit Care Med,2000,28(8):2866-2872.
[12]Heusch G,Boengler K,Schulz R.Cardioprotection:nitric oxide,protein kinases,and mitochondria [J].Circulation,2008,118(19):1915 -1919.
[13]Vereczki V,Martin E,Rosenthal RE,et al.Normoxic resuscitation after cardiac arrest protects against hippocampal oxidatives tress,metabolic dysfunction,and neuronal death[J].J Cereb Blood Flow Metab,2006,26(6):821-835.
[14]严跃红,黄爱群,李显波,等.乌司他丁对心肺复苏后兔肾损伤的影响[J].中国病理生理杂志,2011,27(6):1138-1142.
[15]景炳文.乌司他丁在急危重症临床应用的进展[J].中国危重病急救医学,2006,18(2):117-120.
[16]王姗姗,陈寿权,李章平,等.乌司他丁对心肺复苏后大鼠脑水肿和血脑屏障的作用[J].中华急诊医学杂志,2006,15(4):338-341.
[17]Cullinan SB,Gordan JD,Jin J,et al.The Keap1 - BTBprotein is an adaptor that bridges Nrf2 to a Cul3-based E3 ligase:oxidative stress sensing by a Cul3-Keap1 ligase[J].Mol Cell Biol,2004,24(19):8477 -8486.
[18]Geng Q,Romero J,Saini V,et al.A subset of 26S proteasomes is activated at critically low ATP concentrations and contributes to myocardial injury during cold ischemia[J].Biochem Biophys Res Commun,2009,390(4):1136-1141.
[19]Huang S,Patterson E,Yu X,et al.Proteasome inhibition 1 h following ischemia protects GRK2 and prevents malignant ventricular tachyarrhythmias and SCD in a model of myocardial infarction[J].Am J Physiol Heart Circ Physiol,2008,294(3):H1298 - H1303.
[20]Yu X,Kem DC.Proteasome inhibition during myocardial infarction[J].Cardiovasc Res,2010,85(2):312 -320.
[21]Tong KI,Katoh Y,Kusunoki H,et al.Keap1 recruits Neh2 through binding to ETGE and DLG motifs:characterization of the two-site molecular recognition model[J].Mol Cell Biol,2006,26(8):2887 -2900.
