人胰岛素样生长因子1基因转染对大鼠骨骼肌成肌细胞缺血再灌注损伤的影响*
2012-07-31荣书玲王庸晋王晓林赵俊青贺小峰胡耀东刘丽云
荣书玲,王庸晋△,王晓林,赵俊青,贺小峰,胡耀东,刘丽云
(长治医学院附属和平医院1心内科,2儿科,3康复科,4信息科,山西 长治 046000)
细胞移植是近年来治疗心力衰竭的一个全新策略。成肌细胞作为骨骼肌的前体细胞具有以下优势而作为细胞移植的候选细胞之一:自体来源,取材方便,易于在体外扩增,只向肌纤维细胞分化,对缺血耐受力大,植入自体不引起排斥反应[1]。但细胞移植由于移植细胞的生存率低而影响了治疗效果。胰岛素样生长因子1(insulin like growth factor 1,IGF-1)是人体内的一种重要的细胞因子。它具有广泛的生物学活性[2],它可以促进细胞的增殖、分化,还可以抑制细胞的凋亡,促进局部血管化,增强机体免疫功能等生物活性[2-3]。因此,IGF-1成为基因治疗某些疾病的理想靶点。如果用IGF-1基因修饰的成肌细胞移植改善受损的心功能,一方面,骨骼肌成肌细胞能替代坏死的心肌细胞发挥收缩功能,另一方面,IGF-1基因修饰的成肌细胞分泌的IGF-1可以改善病损部位的微环境,通过多种途径抑制移植细胞的凋亡,从而进一步改善受损的心功能。因此,本研究首先探讨了IGF-1基因修饰的骨骼肌成肌细胞对成肌细胞缺血再灌注损伤后细胞凋亡的影响,为下一步将IGF-1基因修饰的成肌细胞移植到受损心肌改善心功能奠定基础。
材料和方法
1 动物
新生SD大鼠的乳鼠(1~3 d)由华中科技大学同济医学院实验动物中心提供,实验动物许可证号为SCXK(鄂)2004-0007,实验过程中对动物的处置符合2006年科技部《关于善待实验动物的指导性意见》的规定[4]。
2 主要试剂
DMEM液体培养基和胎牛血清购自Gibco;Desmin抗体购自Sigma,转染试剂Poly-brene购自Sigma;pLghIGF-1SN和pLgGFPSN质粒由华中科技大学卢永昕教授惠赠,PT67包装细胞购自Clontech,E86包装细胞购自ATCC,Fugene6转染试剂购自Roche,兔抗人IGF-1单克隆抗体购自武汉博士德生物工程有限公司,人IGF-1 ELISA检测试剂盒购自 R&D,Trizol RNA提取试剂盒购自 Gibco-BRL,原位细胞凋亡检测盒购自Roche,RT-PCR试剂盒购自Invitrogen,其它生化试剂均为进口分装或国产分析纯。
3 主要方法
3.1 成肌细胞的分离、培养、鉴定和转染 鼠骨骼肌成肌细胞的分离和培养按照以前描述的方法[5]。培养瓶的底部放人无菌的盖玻片,成肌细胞生长3~4 d后,取出盖玻片,PBS洗2次,冷丙酮固定,按常规SP染色方法进行Desmin免疫组化染色的检测。
3.2 基因转染成肌细胞 PT67包装细胞用含100 mL/L胎牛血清DMEM培养,E86包装细胞用含100 mL/L小牛血清DMEM培养。分别将携带人胰岛素样生长因子1(human insulin-like growth factor 1,hIGF-1)基因的pLghIGF-1SN质粒和携带绿色荧光蛋白(green fluorescent protein,GFP)基因的对照质粒pLgGFPSN,用二步转染法转染E86和PT67包装细胞,G418筛选并扩增阳性细胞克隆。收集病毒液用0.45 μm的滤器过滤后冻存于-80℃的冰箱。
将纯化的成肌细胞传代到不同的培养瓶中,待细胞长满到约70%时,吸去培养液,分别取含pLgGFPSN和pLghIGF-1SN的病毒上清及polybrene的混合液,培养过夜,第2 d吸去病毒液,换用成肌细胞的正常培养基,继续培养至48 h后在共聚焦显微镜下观察其绿色荧光的强度,换用含G418的培养基筛选并扩增阳性克隆。
3.3 基因在成肌细胞的表达
3.3.1 免疫细胞化学鉴定基因在成肌细胞的表达人IGF-1蛋白在成肌细胞中的表达采用免疫组织化学方法。所用Ⅰ抗为兔抗人IGF-1单克隆抗体(1∶100),Ⅱ抗为生物素标记羊抗兔IgG,Ⅲ抗为辣根过氧化物酶标记的卵白素,DAB显色液显色,光学显微镜下观察。
1936年2月,红二、六军团帮助大定八堡建立苗族独立团。据统计,“红军帮助黔西北各族人民共建立了95个游击团,”[17]在猫山、松桃建立了苗民游击队。红军在贵州活动中,还帮助各族人民建立苏维埃政权。黔西北成立建川滇黔省革命委员会。在各级苏维埃政权中,选拔培养了一批少数民族干部,“松桃甘龙区10个乡苏维埃有34位苗族干部,占干部总数的40%,”[18]P81-86严家坡革命委员会正副主席都是苗族。也正是因为在红军帮助下建立了不少少数民族武装,从而在贵州几乎形成了遍及省内各地声势浩大的武装斗争怒潮。
3.3.2 RT-PCR检测成肌细胞中 hIGF-1 mRNA表达 成肌细胞分3组,IGF组(转入hIGF-1基因的细胞),GFP组(转入GFP基因的细胞),control组(未转染的成肌细胞)。基因转染成肌细胞后72 h,用Trizol RNA提取试剂盒提取细胞总RNA,紫外光检测样品吸光度,A260/A280为1.8~2.0。应用 RTPCR法(按照RT-PCR试剂盒说明操作)检测成肌细胞中hIGF-1 mRNA的表达。引物设计,hIGF-1上游引物5’-ATGCACACCATGTCCTCCTCGCAT-3’,下游引物 5’-CTACATCCTGTAGTTCTTGTT-3’;GAPDH 上游引物 5’-TTCTTGTGCAGTGCCAGCCTCGTC-3’,下游引物5’-TAGGAACACGGAAGGCCATGCCAG-3’。以GAPDH作为内参照进行标化。
3.4 ELISA法检测hIGF-1表达 成肌细胞培养上清中hIGF-1浓度采用双抗体一步夹心ELISA法检测。实验步骤按照试剂盒的操作说明进行。从室温平衡20 min后的铝箔袋中取出所需板条,设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;待测样本孔先加待测样本10 μL,再加样本稀释液40 μL;随后标准品孔和样本孔中每孔加入辣根过氧化物酶标记的hIGF-1抗体100 μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60 min。弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次(也可用洗板机洗板)。每孔加入底物A、B各50 μL,37℃避光孵育15 min。每孔加入终止液50 μL,15 min内,在450 nm波长处测定各孔的吸光度(A)值。计算样品浓度。
3.5 IGF-1基因修饰成肌细胞对成肌细胞增殖的影响 取3组生长良好,数目为2×106的成肌细胞,其中一组转入IGF-1基因(IGF组),另一组转入GFP基因(GFP组),未转染的成肌细胞作为细胞对照(control组),在转染3~14 d用细胞计数仪分别计数3组细胞的数目,比较3个不同组中成肌细胞的增殖情况,观察IGF-1基因转染对成肌细胞增殖的影响。
3.6 IGF-1基因转染对成肌细胞缺血再灌注损伤的影响 基因转染成肌细胞后7 d,IGF-1组和GFP组的成肌细胞用PBS洗涤2~3次,然后加入模拟的缺血液,在模拟缺血条件下(5%CO2、1%O2、94%N2、37℃培养箱中缺氧、缺糖)培养1 h,之后将模拟缺血液吸尽并加入正常DMEM(含胎牛血清)培养基,放至普通培养箱中(5%CO2、37℃)继续培养6 h。实验结束后,取出细胞爬片,PBS洗涤3次,4%多聚甲醛固定30 min,用TUNEL法检测成肌细胞凋亡,严格按照试剂盒说明书进行,control组细胞作为正常对照。细胞显色后,在光镜下观察凋亡阳性细胞。计数5个200倍视野,以平均每100个细胞核中含凋亡细胞个数作为凋亡指数(apoptotic index,AI)。
3.7 RT-PCR检测IGF-1基因转染对bax和bcl-2 mRNA表达的影响 缺血再灌注损伤后6 h,用Trizol RNA提取试剂盒提取细胞总RNA,紫外光检测样品吸光度,A260/A280为1.8~2.0。应用RT -PCR 法(按照RT-PCR试剂盒说明操作)检测成肌细胞中bax和bcl-2 mRNA的表达,以GAPDH作为内参照进行标化。bax上游引物5’-GCAGAGGATGATTGCTGATG-3’,下游引物 5’-CTCAGCCCATCTTCTTCCAG - 3’;bcl-2:上游引物 5’-TCCATTATAAGCTGTCACAG-3’,下 游 引 物 5’ -GAAGAGTTCCTCCACCAC-3';GAPDH上游引物5’-TTCTTGTGCAGTGCCAGCCTCGTC-3’,下游引物5’-TAGGAACACGGAAGGCCATGCCAG -3’。
3.8 Western blotting检测 IGF-1基因转染对caspase-3活化的影响 缺血再灌注损伤后6 h,用含蛋白酶抑制剂的RIPA裂解3组成肌细胞,15000 r/min离心30 min,吸取上清(可溶性蛋白),并以BCA法定量总蛋白。然后进行SDS-PAGE电泳,蛋白经转膜后,5%脱脂奶粉封闭2h,加入活化的caspase-3单抗4℃过夜,TBS-T(含0.05%Tween 20的TBS)洗涤,HRP-标记的Ⅱ抗室温孵育1 h,TBS-T洗涤后应用化学发光法显色,之后曝光显影。采用Bio-Rad公司Quantity One分析软件对显影条带进行灰度分析,将目的蛋白与GAPDH灰度比值作为目的蛋白的相对表达水平。
4 统计学处理
结 果
1 成肌细胞免疫细胞化学鉴定
我们用携带hIGF-1基因的逆转录病毒载体感染成肌细胞,G418筛选后免疫细胞化学检测可见hIGF-1在成肌细胞中的表达,见图1B。
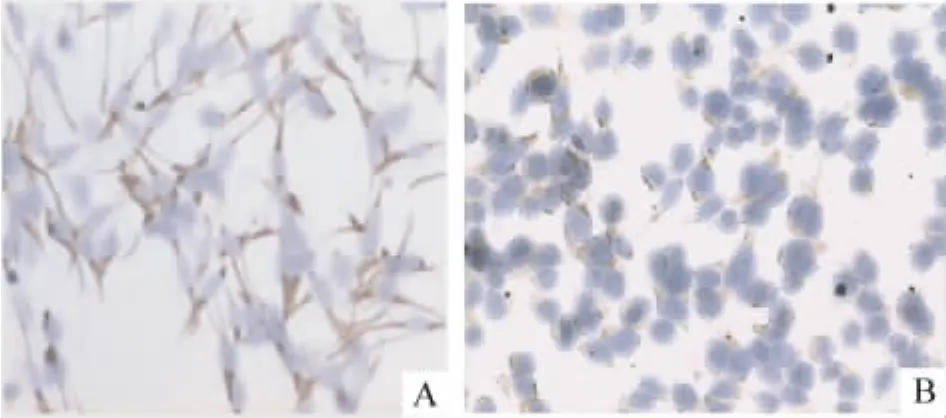
Figure 1.Expression of desmin(A)and hIGF-1(B)in rat myoblasts detected by immunocytochemistry(×200).图1 免疫细胞化学鉴定desmin和hIGF-1在大鼠成肌细胞的表达
2 RT-PCR检测成肌细胞中hIGF-1 mRNA表达
成肌细胞感染后72 h,RT-PCR检测显示,hIGF-1基因转染的细胞(IGF组)中有 hIGF-1 mRNA的表达,而GFP基因转染的成肌细胞(GFP组)及未经转染的成肌细胞(control组)未见hIGF-1 mRNA的表达,见图2。
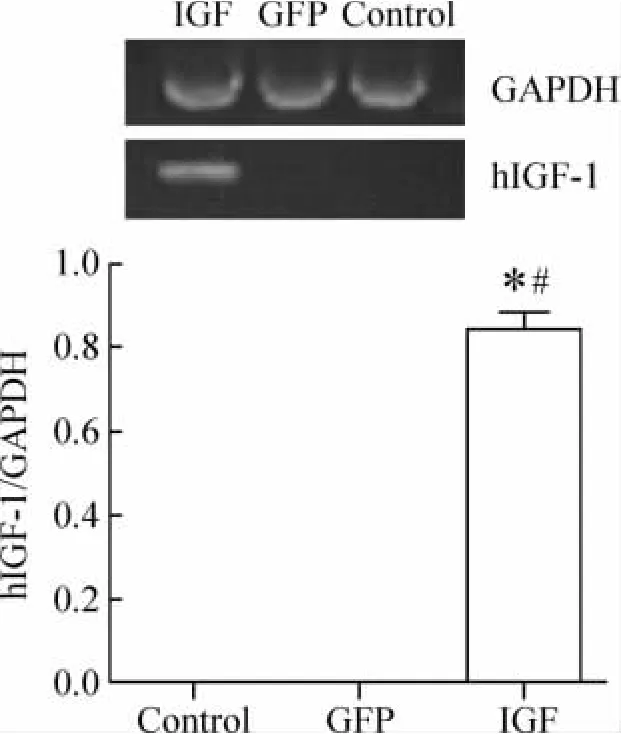
Figure 2.Expression of hIGF - 1 mRNA in myoblasts.IGF:myoblasts transfected with pLghIGF-1SN;GFP:myoblasts transfected with pLgGFPSN;control:untransfected myoblasts..n=6.*P<0.05 vs control;#P <0.05 vs GFP.图2 成肌细胞中hIGF-1 mRNA的表达
3 ELISA法检测hIGF-1表达
ELISA法检测结果显示,IGF组细胞上清中有hIGF-1蛋白的表达。而GFP组细胞及control组细胞上清中未检测到hIGF-1蛋白的表达,见图3,hIGF-1的有效表达在成肌细胞至少可持续4周以上。
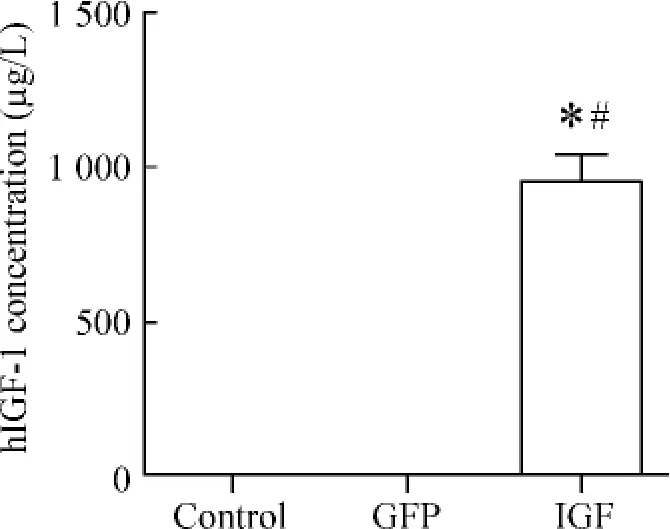
Figure 3.Expression of hIGF-1 in conditioned medium detected by ELISA..n=6.*P<0.05 vs control;#P<0.05 vs GFP.图3 ELISA法检测各组细胞分泌的hIGF-1浓度
4 IGF-1基因转染促进成肌细胞的增殖
3个不同组最初培养的细胞数为2×106,基因转染后3 d,IGF组和GFP组细胞数显著低于未转染的细胞[IGF组:(1.21±0.04)× 106,GFP组:(1.23±0.03)×106cells,control组:(2.87 ±0.13) ×106],然而到转染后14 d,IGF组的细胞数显著高于GFP组的细胞和未转染的细胞[IGF组:(11.36±0.01)×106,GFP 组:(8.09 ±0.02)×106,control组:(10.58±0.02)×106],IGF 组增加的细胞数显著高于GFP组和control组(P<0.05),见图4。
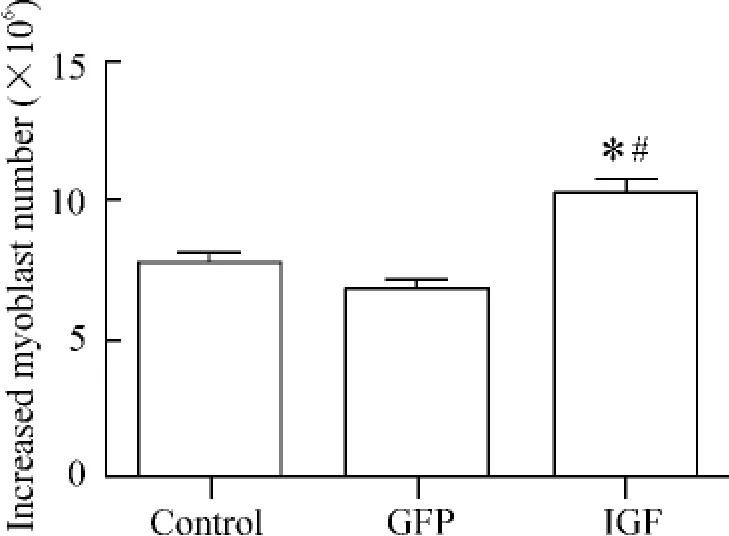
Figure 4.The numbers of increased myoblasts in different groups..n=6.*P<0.05 vs control;#P<0.05 vs GFP.图4 基因转染成肌细胞后增加的细胞数
5 IGF-1基因转染成肌细胞对成肌细胞缺血再灌注损伤的影响
成肌细胞缺血再灌注损伤6 h后细胞凋亡检测结果显示:缺血/再灌注损伤后IGF-1基因转染的成肌细胞的凋亡百分率显著低于GFP基因转染的成肌细胞。IGF-1基因转染显著抑制了成肌细胞的凋亡(P< 0.05),见图5。
6 RT-PCR检测IGF-1基因转染成肌细胞对成肌细胞bax和bcl-2 mRNA表达的影响
成肌细胞缺血再灌注损伤6 h后,RT-PCR检测结果显示,IGF组成肌细胞的bax mRNA表达显著低于GFP组的成肌细胞,bcl-2 mRNA表达显著高于GFP组成肌细胞(P<0.05),见图6。IGF-1基因转染显著增加了抗凋亡基因的表达,抑制了促凋亡基因的表达。
7 Western blotting检测 IGF-1基因转染对caspase-3表达的影响
Western blotting结果显示,IGF组细胞与GFP组细胞相比,活化的caspase-3蛋白表达显著降低(P < 0.05),见图7。
讨 论
基因修饰的细胞移植为受损心肌的修复提供了有效方法,但是,细胞移植存在的最大问题是移植细胞的生存问题。大部分被移植细胞在移植早期由于损伤心肌的缺血及炎性氧化应激环境而发生死亡。细胞的死亡直接影响着心功能的恢复。研究证实通过联合基因治疗可以改善移植细胞的生存,从而改善心脏功能[6-8]。因此,寻找一个理想的候选细胞和一个有效的抗凋亡基因是目前细胞移植的一个关键问题。
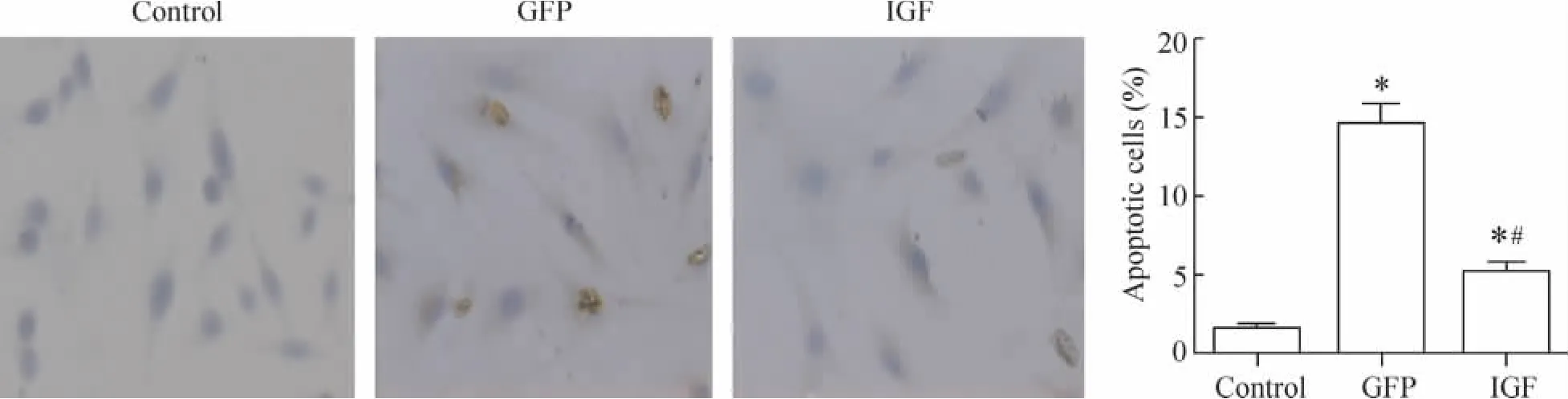
Figure 5.Apoptotic cells in different groups detected by TUNEL(×200)..n=6.*P<0.05 vs control;#P<0.05 vs GFP.图5 hIGF-1基因转染成肌细胞对成肌细胞缺血再灌注损伤后细胞凋亡的影响
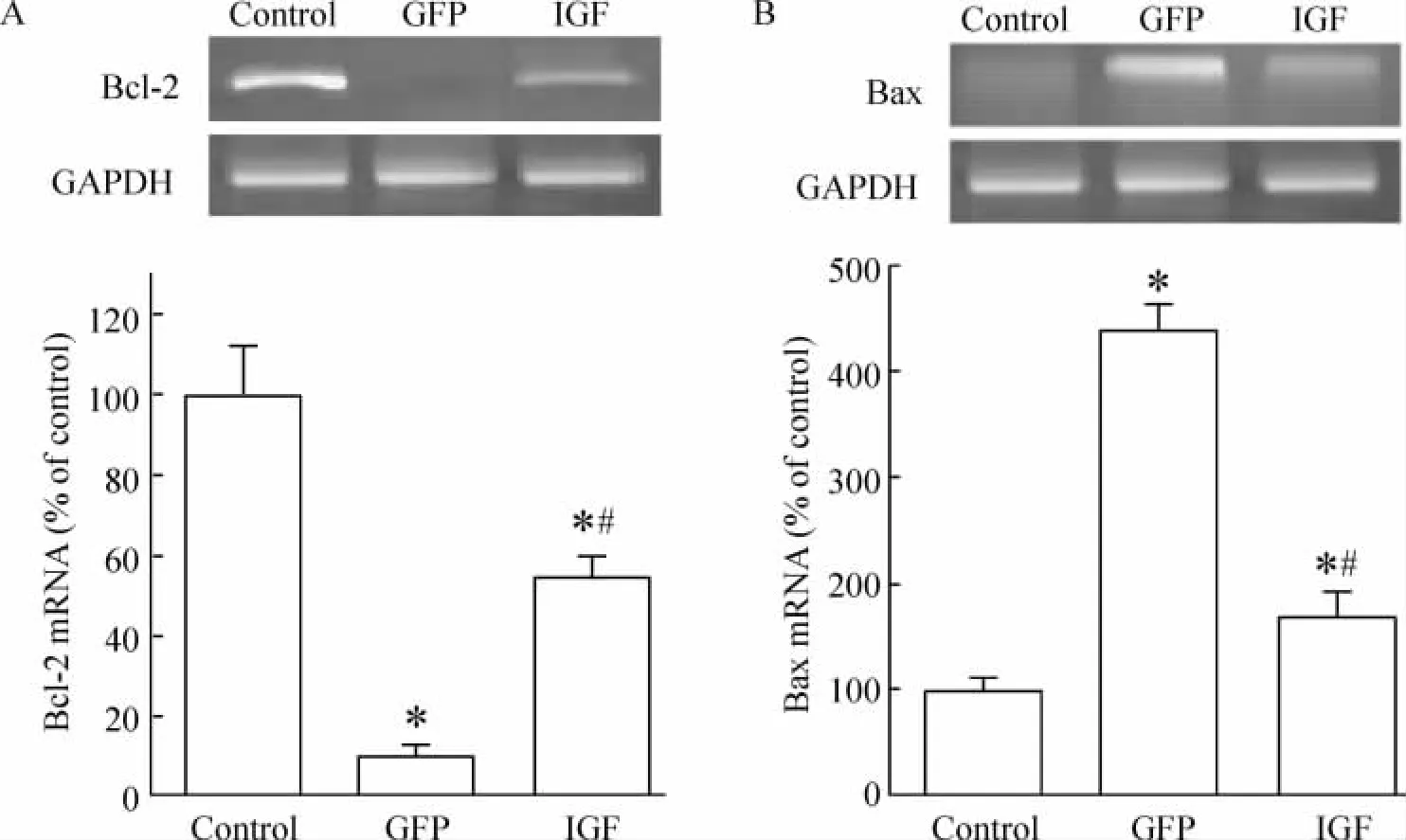
Figure 6.Expression of bcl-2(A)and bax(B)mRNA after ischemia/reperfusion injury detected by RT-PCR..n=6.*P<0.05 vs control;#P <0.05 vs GFP.图6 RT-PCR检测各组细胞缺血再灌注损伤后bax和bcl-2的表达
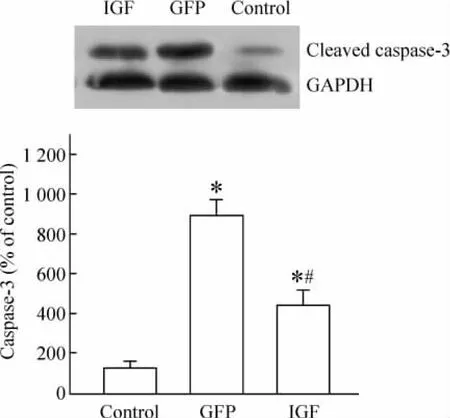
Figure 7.Expression of cleaved caspase-3 after ischemia/reperfusion injury detected by Western blotting..n=6.*P <0.05 vs control;#P <0.05 vs GFP.图7 Western blotting检测各组细胞缺血再灌注损伤后活化的caspase-3蛋白的表达
近年来,人们尝试用多种干细胞移植到受损心肌,来改善受损的心功能。目前用于试验研究的移植细胞有多种,最常用的细胞有胚胎心肌细胞、胚胎干细胞、自体骨髓干细胞、骨骼肌成肌细胞(肌卫星细胞)、内皮干细胞[9]。各种细胞均有自己的优点和不足:胚胎心肌细胞与心肌细胞成分最相近,是最好的选择,但存在着供体细胞缺少、移植后的排斥反应以及伦理冲突等问题。胚胎干细胞为多能干细胞,在体外培养可以分化出心肌细胞,但也存在着来源受限、移植后的排异反应,以及伦理学的问题。而自体骨髓干细胞、骨骼肌成肌细胞、内皮干细胞移植则没有论理学的制约,也不存在排异问题,不需要终身免疫抑制治疗,因此得到了广泛的研究[10-12]。
骨骼肌成肌细胞是骨骼肌的前体细胞,成肌细胞因其独特的生物学特性使其成为基因治疗[13]和细胞移植的理想载体[14]。来源于骨骼肌的成肌细胞具有:(1)来源丰富,取材方便(只需局部麻醉),植入自体不引起排斥反应;(2)体外容易扩增培养:与造血干细胞不同,成肌细胞分离、培养简单,体外扩增效率较高的;(3)易于外源基因导入:成肌细胞是贴壁生长细胞,在体外容易转入外源基因,并表达高水平目的基因产物,并可以分泌重组蛋白;(4)成肌细胞具有较强的抗缺血能力,并可以在宿主体内长期存活,有利于目的蛋白稳定、持续地表达;(5)成肌细胞移植后不影响邻近组织的生理功能,而且肌肉组织易于重复活检,应用安全;(6)容易通过注射传递,为大规模细胞移植提供了条件;(7)在体内不会无限制增殖,没有致瘤作用。基于以上这些条件,基因修饰的成肌细胞注入到动物体内,可作为生物细胞工程治疗的载体细胞,来治疗某些基因丢失或缺陷疾病,如肌营养不良症,内分泌缺陷,凝血功能障碍(如血友病)等症。植入后容易与宿主的肌纤维融和,己成为成体干细胞的一个研究热点和最具价值的组织工程细胞,具有广泛的应用前景[14-16]。
IGF-1是由肝脏合成和分泌的胰岛素家族的一种多肽。由于其广泛的生物学活性而被广泛地应用于临床。它在细胞的分化、增殖、个体的生长发育中具有重要的促进作用。作为刺激因子,可以促进细胞的有丝分裂。抑制细胞的凋亡,增强机体免疫功能等生物活性。因此,IGF-1成为基因治疗某些疾病的理想靶点[2-3]。将hIGF-1基因导入骨骼肌成肌细胞,治疗缺血性疾病(如心肌缺血损伤)以及促进创伤修复将具有更好的效果。为此,我们首先探讨了hIGF-1本身对骨骼肌成肌细胞的增殖与凋亡是否有影响。
目的基因的转染有稳定和瞬时转染两种。瞬时转染中,目的基因序列不整合到宿主基因组中,逆转录病毒载体可以整合到宿主的染色体中,因此可以实现目的基因在宿主体内持续稳定地表达[17-18]。
因此,本实验以大鼠成肌细胞作为候选细胞,IGF-1基因作为理想的靶基因,将携带hIGF-1的重组逆转录病毒载体转染体外培养的成肌细胞,并从mRNA水平、蛋白水平及细胞水平均可检测到IGF-1基因在靶细胞内的存在,而对照组未见hIGF-1的表达,证明IGF-1基因成功转染到成肌细胞中并在转录水平及翻译水平得以表达。一个基因的最终表达结果是产生相应的蛋白质,因此检测蛋白质是测定基因表达的主要标志。实验利用免疫细胞化学方法检测hIGF-1基因转染成肌细胞,并用G418筛选后,可见转染细胞几乎全部表达,说明转染hIGF-1基因的成肌细胞可稳定、高效地表达hIGF-1。
本研究用重组hIGF-1转染骨骼肌成肌细胞,然后观察了hIGF-1对成肌细胞增殖及缺血再灌注损伤后凋亡的影响。结果显示,IGF-I基因转染成肌细胞后,携带hIGF-1基因的成肌细胞可以持续稳定表达hIGF-1,在体外显著促进了成肌细胞的增殖,并可对抗缺血缺氧诱导的细胞凋亡。由于在细胞移植治疗中需要大量的细胞,这为成肌细胞在IGF-I诱导下的扩增及将来临床大规模的细胞移植提供了有利的条件。
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,细胞凋亡的最终途径为激活caspase-3蛋白酶,caspase-3通常以酶原的形式存在于胞浆中,在凋亡的早期阶段被激活,活化的caspase-3裂解相应的胞浆胞核底物,最终导致细胞凋亡。另外,在凋亡过程中,Bcl-2和Bax也起着非常重要的作用,Bcl-2是抑制凋亡的主要蛋白,Bax是促进凋亡的主要蛋白[19]。因此,在进一步的研究中,我们通过检测hIGF-1基因转染对成肌细胞caspase-3表达的影响,对bcl-2和bax mRNA表达的影响,探讨了hIGF-1抑制成肌细胞凋亡的机制,结果发现,hIGF-1转染成肌细胞显著地降低了caspase-3和bax的表达,增加了bcl-2的表达,这一结果提示我们,IGF-1介导的抗凋亡效果可能与降低细胞的Bax和caspase-3表达,增加Bcl-2表达有关。
综上所述,IGF-1基因修饰的成肌细胞分泌的IGF-1蛋白在体外促进了成肌细胞的增殖,减少了缺血再灌注损伤的成肌细胞的凋亡,这些结果为进一步的动物实验及临床研究提供了实验依据。
[1]Rong SL,Lu YX,Liao YH,et al.Effetcs of transplantated myoblasts transfected with human growth hormone gene on improvement of ventricular function of rats[J].Chin Med J,2008,121(4):347 -354.
[2]Liu TB,Fedak PW,Weisel RD,et al.Enhanced IGF-1 expression improves smooth muscle cell engraftment after cell transplantation[J].Am J Physiol Heart Circ Physiol,2004,287(6):H2840-H2849.
[3]Su EJ,Cioffi CL,Stefansson S,et al.Gene therapy vector-mediated expression of insulin-like growth factors protects cardiomyocytes from apoptosis and enhances neovascularization[J].Am J Physiol Heart Circ Physiol,2003,284(4):H1429-H1440.
[4]王禄增,王 捷,贺争鸣,等.起草“关于善待实验动物的指导性意见”草案溯源的探讨[J].中国比较医学杂志,2007,17(8):S38-S41.
[5]Rong SL,Lu YX,Liao YH,et al.Effects of recombinant retroviral vector mediated human insulin like growth factor- 1gene transfection on skeletal muscle growth in rat[J].Chin Med J,2006,119(23):1991 -1998.
[6]Pouzet B,Vilquin JT,Hagege AA,et al.Factors affecting functional outcome after autologous skeletal myoblast transplantation[J].Ann Thorac Surg,2001,71(3):844-850.
[7]Muller- Ehmsen J,Whittaker P,Kloner RA,et al.Survival and development of neonatal rat cardiomyocytes transplanted into adult myocardium[J].J Mol Cell Cardiol,2002,34(2):107-116.
[8]Nakamura Y,Yasuda T,Weisel RD,et al.Enhanced cell transplantation:preventing apoptosis increases cell survival and ventricular function[J].Am J Physiol Heart Circ Physiol,2006,291(2):H939 - H947.
[9]Pfister O,Jain M,Liao R.Cell therapy in heart failure[J].Heart Fail Clin,2005,1(2):303 -312.
[10]Menasché P.Skeletal myoblasts as a therapeutic agent[J].J Mol Cell Cardiol,2008,45(4):545 -553.
[11]Dib N,Michler RE,Pagani FD,et al.Safety and feasibility of autologous myoblast transplantation in patients with ischemic cardiomyopathy four-year follow -up[J].Circulation,2005,112(12):1748 -1755.
[12]Premaratne GU,Tambara K,Fujita M,et al.Repeated implantation is a more effective cell delivery method in skeletal myoblast transplantation for rat myocardial infarction[J].Circ J,2006,70(9):1184 -1189.
[13]Vandenburgh H,Del Tatto MD,Shansky J,et al.Attenuation of skeletal muscle wasting with recombinant human growth hormone secreted from a tissue-engineered bioartificial muscle[J].Hum Gene Ther,1998,9(17):2555-2564.
[14]Suzuki K,Murtuza B,Smolenski RT,et al.Cell transplantation for the treatment of acute myocardial infarction using vascular endothelial growth factor-expressing skeletal myoblasts[J].Circulation,2001,104(12 Suppl 1):I207-I212.
[15]Hagege AA,Marolleau JP,Vilquin JT,et al.Skeletal myoblast transplantation in ischemic heart failure:longterm follow - up of the first phase I cohort of patients[J].Circulation,2006,114(1 Suppl):I108-I113.
[16]Guarita-Souza LC,Francisco JC,Simeoni R,et al.Benefit of stem cells and skeletal myoblast cells in dilated cardiomyopathies[J].World J Cardiol,2011,3(3):93 -97.
[17]Guo XM,Wang HL,Chu HY,et al.High level expression of human factor in mammalian cellsⅧafter retroviral- mediated gene transfer[J].Chin Med J,2001,114(7):690-693.
[18]Dolnikov A,Wotherspoon S,Millington M,et al.Retrovirus vector production and transduction:modulation by the cell cycle[J].Gen Virol,2003,84(Pt 11):3131 -3141.
[19]刘淑珍,尤 鑫,熊小栓,等.心肌再灌注对抑郁大鼠心肌细胞凋亡以及bcl-2、bax和caspase-3表达的影响[J].中国病理生理杂志,2012,28(3):453-458.
