钾通道在系统性红斑狼疮T细胞中的作用研究①
2012-07-30邱红霞赵阴环朱桂启赵海慧付冰冰刘鑫钰
邱红霞 赵阴环 朱桂启 赵海慧 付冰冰 刘鑫钰
(哈尔滨医科大学附属二院风湿免疫科,哈尔滨150086)
系统性红斑狼疮(Systemic lupus erythematosus,SLE)是一种累及多系统多器官的慢性自身免疫性疾病,其特征是免疫系统紊乱,导致抗核抗体(Antinuclear antibody,ANA)等自身抗体的产生、免疫复合物的沉淀以及补体系统的激活。SLE发病机制尚未完全明确,近年来国内外研究发现T淋巴细胞钾离子通道 Kv1.3(Voltage-gated potassium channel)和IKCa1(Intermediate-conductance calcium-activated potassium channel 1)对于启动和维持免疫反应至关重要。本研究检测了SLE外周血T细胞活化时Kv1.3及IKCa1通道的表达,以及阻断Kv1.3通道后对SLE患者 T细胞增殖的影响,分析Kv1.3通道在SLE患者T细胞活化中的作用。探讨Kv1.3通道作为SLE免疫治疗靶点的可能性。
1 资料与方法
1.1 临床资料 33例SLE患者来自哈尔滨医科大学附属第二医院风湿免疫科2011年7月至2011年12月的住院患者,其中女性30例,男性3例,平均年龄35岁,所有患者均符合1997年美国风湿病学会(ACR)修订的SLE分类标准。采用SLE疾病活动指数(SLEDAI)-2K评分评估疾病活动性[1];健康对照组12人为我院体检中心的健康人,其中女性8名,男性4名,平均年龄32岁,均无风湿病史和风湿病家族史。研究组与对照组性别、年龄构成上差异无统计学意义。本研究经哈尔滨医科大学附属第二医院伦理委员会批准,并取得受试对象的知情同意。
1.2 方法
1.2.1 主要仪器和试剂 PCR扩增仪(德国 Eppendorf公司);Lightcycler2.0实时定量PCR仪(德国QIAGEN公司,型号 RG-3000);UV-2450紫外可见分光光度计(日本岛津公司);酶标仪(瑞士TECAN公司)。人淋巴细胞分离液(Ficoll-Hypaque)(天津灏洋生物制品科技有限公司),纯化抗人CD3单克隆抗体(美国eBioscience公司,克隆号OKT3),All-in-One qPCR Mix(美国 GeneCopoeia公司),Allin-One First-Strand cDNA Synthesis Kit(美国GeneCopoeia公司);Kv1.3、IKCa1 及 β-Actin 引物(美国Genecopoeia公司,货号分别为 Hs-QRP-20905、Hs-QRP-20903、Hs-QRP-20056);ShK(以色列 Alomone公司);CCK-8(碧云天生物技术研究所)。
1.2.2 实验方法
1.2.2.1 外周血T细胞培养 晨起无菌采集外周静脉血10 ml,枸橼酸钠抗凝。应用Ficoll-Hypaque按照操作说明密度梯度离心法分离PBMC,之后应用尼龙毛柱法提取T细胞。以含10%胎牛血清的RPMI1640完全培养液调整细胞浓度至1×106ml-1,按照1 ml/孔接种于24孔培养板;每孔中加抗CD3单抗刺激T细胞活化,终浓度为0.5μg/ml;5%CO2、饱和湿度的37℃培养箱中培养72小时。
1.2.2.2 荧光实时定量PR-PCR检测活化 T细胞中Kv1.3通道和IKCa1通道mRNA表达水平 收集培养细胞,Trizol法提取总RNA,根据All-in-One First-Strand cDNA Synthesis Kit(美国GeneCopoeia公司)说明配制反应体系,逆转录合成cDNA。据Allin-One qPCR Mix(美国GeneCopoeia公司)说明配制RT-PCR反应体系。反应体系如下:2×All-in-one qPCR Mix 10 μl,PCR 上游引物(2 μmol/L)2 μl,PCR 下游引物(2 μmol/L)2 μl,cDNA 2 μl,去离子水4μl。反应程序为:95℃预变性10分钟;95℃反应10秒,60℃反应20秒,72℃反应15秒,共进行45个循环。
1.2.2.3 CCK-8 法检测阻断 Kv1.3 通道对 SLE 患者T细胞增殖的影响 向96孔培养板中加入100 μl细胞悬液,将细胞分为抗CD3单抗组和抗CD3单抗+ShK组,设空白孔,只加含10%胎牛血清的RPMI1640完全培养液及抗CD3单抗。37℃培养72小时后,向每孔中加入10μl CCK-8溶液,37℃培养4小时。在酶标仪上于450 nm处测定吸光度OD值。计算相对增殖指数:相对增殖指数=(不同处理组OD值-空白孔OD值)/(抗CD3单抗组OD值-空白孔OD值。
1.3 数据处理和统计分析 实验数据用统计软件SPSS17.0进行数据统计分析,数据以x±s表示,对组间实验数值比较采用t检验,对Kv1.3和IKCa1通道mRNA相对表达量与补体C3、C4、抗dsDNA抗体、SLEDAI积分及尿蛋白间进行相关性分析。P<0.05具有统计学意义
2 结果
2.1 Kv1.3、IKCa1 mRNA表达情况 利用实时定量PCR分析软件自动生成相关数据,分析SLE患者T细胞活化后与对照组之间 Kv1.3及 IKCa1的mRNA表达水平的差异。结果显示,Kv1.3通道mRNA的相对表达值为 2.36±0.64,正常对照为1.04±0.32;IKCa1通道 mRNA 的相对表达值为0.77 ±0.19,正常对照者为 0.98 ±0.19。SLE 患者Kv1.3通道mRNA的表达与正常对照相比明显增高,而IKCa1通道mRNA的表达与正常对照相比明显降低,差异有显著统计学意义(P值分别为P<0.001,P=0.006),如图1 所示。
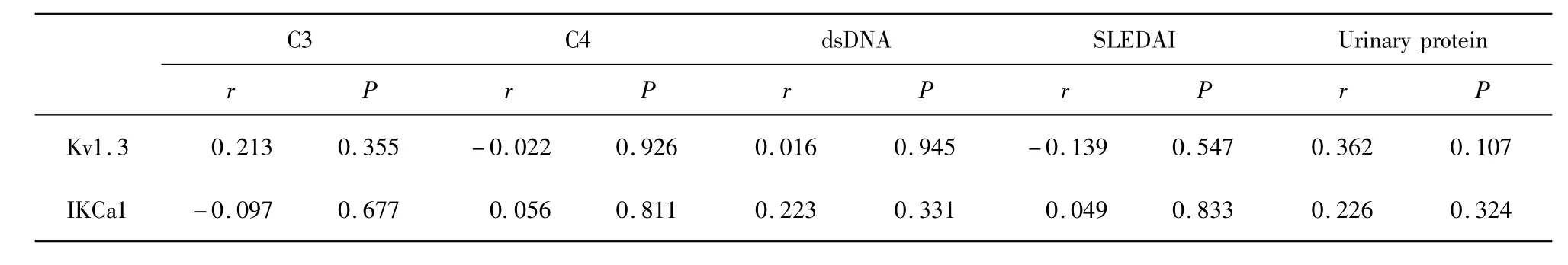
表1 SLE组Kv1.3及IKCa1 mRNA表达水平与补体C3、C4、抗dsDNA抗体、尿蛋白量及SLEDAI积分间的相关性Tab.1 The correlation between the Kv1.3 and IKCa1 mRNA expression level and complement C3,C4,SLEDAI scores,urinary protein,anti-dsDNA antibody in SLE group
2.2 SLE患者Kv1.3及IKCa1mRNA表达水平与补体C3、C4、抗dsDNA抗体、SLEDAI积分及尿蛋白间的相关性分析 SLE患者Kv1.3及IKCa1 mRNA表达水平均与补体C3、C4、抗dsDNA抗体、SLEDAI积分及尿蛋白无相关性。如表1所示。
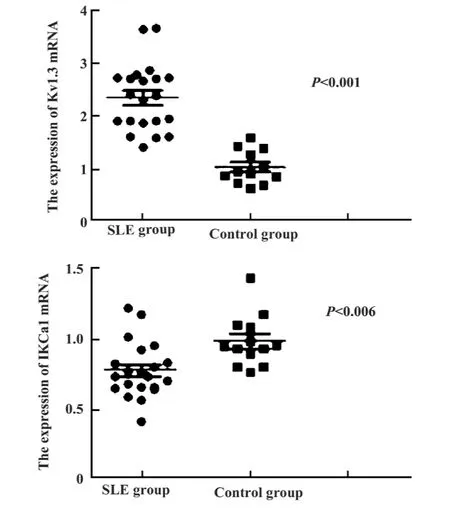
图1 SLE组和对照组Kv1.3及IKCa1 mRNA表达水平Fig.1 The expression of Kv1.3 and IKCa1 channels in activated T cells of SLE and in controls
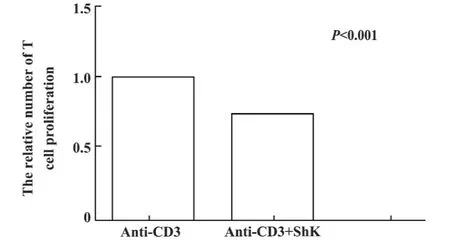
图2 CCK-8法测SLE T细胞加入ShK后相对增殖指数Fig.2 The effects of blocking Kv1.3 channels with ShK on T cell proliferation were measured by CCK-8 assay
2.3 CCK-8法检测阻断Kv1.3通道对SLE患者T细胞增殖的影响 本实验用CCK-8法检测T细胞的增殖,通过OD值计算相对增殖指数,分析ShK阻断Kv1.3通道后对SLE患者T细胞增殖的影响。结果显示,加入ShK后,SLE患者T细胞的相对增殖指数由1.00 ±0.13 降为 0.77 ±0.15,两者间有显著差异(P<0.001),提示ShK可明显抑制SLE患者T细胞增殖,如图2所示。
3 讨论
近年来国内外研究发现T淋巴细胞K通道Kv1.3和IKCa1对于启动和维持免疫反应至关重要。T细胞表面表达的两种主要的K通道是Kv1.3和IKCa1,研究发现这两种K通道的表达与免疫细胞的活化状态有关[2,3]。在受到抗原的反复刺激后,CD4+和CD8+T细胞会由初始T细胞分化为TCM和TEM记忆性T细胞亚群,同时会伴随着T细胞膜表面钾离子通道类型的改变。在静息状态,初始T细胞,TCM细胞以及TEM细胞表达的Kv1.3(200~400个/细胞)明显高于IKCa1(8~10个/细胞);受抗原或丝裂原激活后,初始T细胞和TCM细胞表达Kv1.3(250~300个/细胞)和 IKCa1(500~600个/细胞)的数量相当,而TEM细胞活化后表达的Kv1.3(1800个/细胞)显著高于 IKCa1(50~100个/细胞)[4]。这说明两种钾离子通道在活化的初始T细胞、TCM细胞和TEM细胞表达不同,发挥的作用也不同。Kv1.3通道是TEM细胞活化的主要钾离子通道,而在初始T细胞和TCM活化时,IKCa1通道表达增加,发挥主要功能[5]。
过去研究发现在SLE患者中存在一系列的信号异常,尤其是T细胞表现出对抗原刺激的过度应答。这种“过度活化”T细胞的标志是,在T细胞受体(TCR)与抗原肽结合后,与正常T细胞相比,表现出更显著的并且持续性增加的胞内Ca2+水平[6]。持续的Ca2+内流对下游信号活化和T细胞功能起着重要作用。因此,在 SLE患者T细胞中,胞内Ca2+水平调节异常可以导致T细胞功能异常。
在T细胞中TCR介导的Ca2+内流是通过钙释放活化钙通道(CRAC)实现的,并且受多种膜通道和信号分子的调节[7]。抗原与 TCR的结合活化PLC-γ并诱导胞内储存Ca2+释放。胞内储存Ca2+排空后,引起CRAC通道开放,Ca2+流入胞内。持续的Ca2+内流是T细胞活化所必需的,从而调节细胞增殖和细胞因子的产生。Ca2+内流的电化学驱动力是由阳离子通过K通道外流所提供的。
为了研究SLE患者T细胞中钾通道的作用,本研究用抗CD3单抗刺激T细胞活化,分析活化的外周血T细胞中Kv1.3及IKCa1通道的表达情况,并分析其与SLEDAI积分、补体、抗dsDNA抗体及尿蛋白的关系。结果提示SLE组Kv1.3通道表达量与正常对照组相比明显增加,而IKCa1通道的表达量与正常对照组相比减少,这两种通道的表达与SLE病情活动指标SLEDAI积分、补体、抗dsDNA抗体、及尿蛋白之间无相关性。有研究发现SLE患者中TEM细胞增加[8],作为TEM细胞活化的主要钾离子通道,Kv1.3通道的活动变化可能影响T细胞对抗原的识别及T细胞的活化。选择性阻断K通道,可抑制T细胞活化,从而控制SLE发病。对Kv1.3通道的进一步研究,有助于研究Kv1.3通道阻断剂通过调节Kv1.3通道来干扰T细胞活化的药理作用及新药研制。
为了研究Kv1.3通道阻断剂对T细胞增殖的影响,本实验进行了CCK-8法检测阻断Kv1.3通道对SLE患者T细胞增殖的影响。结果显示,ShK可明显抑制SLE患者T细胞增殖。这提示Kv1.3通道是SLE患者TEM细胞活化的主要离子通道,Kv1.3通道可成为SLE免疫治疗的一个新靶点。
钾离子通道的电生理学试验表明在SLE患者T细胞中,Kv1.3通道电流强度比IKCa1高,SLE患者T细胞中Kv1.3通道表达量平均为349±30通道/细胞,IKCa1通道表达量平均为 30.7±2.5通道/细胞;并且发现在IS区域Kv1.3通道的动力学发生改变,与正常对照者静止性T细胞相比,在SLE患者T细胞中Kv1.3通道转移至IS区域有更快的动力学。并且这种现象与SLE病情活动及是否接受免疫抑制剂治疗无关[8]。因此,Kv1.3通道是SLE患者T细胞的主要K电导通道,并且是细胞电位和钙平衡的主要调节因子。Kv1.3通道状态的改变对SLE患者T细胞的Ca2+平衡有很多影响。
Rus等[9]对MS患者脑组织的病理研究证实,在MS脑组织的血管周围及脱髓鞘病灶中的T淋巴细胞上大量表达Kv1.3通道,其中大部分的T细胞为TEM细胞。研究发现在再生障碍性贫血患者中存在 Kv1.3highIKCa1lowTEM细胞增多,特异性 Kv1.3 阻断剂ShK可明显抑制TEM细胞增殖,并抑制IFN-γ和IL-4的产生[10]。其他体外研究也证明Kv1.3阻断剂能有效治疗多种T细胞介导的免疫反应,如大鼠和小型猪的迟发型超敏反应,实验性自身免疫型糖尿病,异十八烷诱导的关节炎和大鼠中变应性接触性皮炎,并没有出现任何毒副作用[11,12]。在这些疾病模型中,Kv1.3通道阻断剂选择性抑制TEM细胞功能,但对初始T细胞和TCM细胞的归巢及向淋巴结的迁移没有影响[13],因为初始和TCM细胞可以通过上调IKCa1通道而逃避免疫抑制,使得正常的免疫应答不受影响,靶向Kv1.3通道的治疗方法比全身免疫调节的治疗更有优势。
Kv1.3通道在抑制自身免疫性疾病的免疫异常中有独特的优势,但Kv1.3通道阻断剂可否用于SLE及其他自身免疫性疾病的治疗,尚需进一步对Kv1.3通道阻断剂药理学特性、生物利用度及安全性进行深入研究。
1 Bombardier C,Gladman D D,Urowitz M B et al.Derivation of the SLEDAI.A disease activity index for lupus patients.The committee on prognosis studies in SLE.[J].Arthritis Rheum,1992;35:630-640.
2 Lam J,Wulff H.The lymphocyte potassium channels Kv1.3 and KCa3.1 as targets for immunosuppression[J].Drug Dev Res,2011;72(7):573-584.
3 Wulff H,Calabresi P A,Allie R et al.The voltage-gated Kv1.3 K(+)channel in effector memory T cells as new target for MS[J].Clin Invest,2003;111:1703-1713.
4 Fernanda Mello de Queiroz,Cristiano G Ponte,Adriana Bonomo et al.Study of membrane potential in T lymphocytes subpopulations using flow cytometry[J].BMC Immunology,2008;9(63):1471-2172.
5 Hu L,Gocke A R,Knapp E et al.Functional blockade of the voltagegated potassium channel Kv1.3 mediates reversion of T effector to central memory lymphocytes through SMAD3/p21cip1 signaling[J].Biol Chem,2012;287(2):1261-1268.
6 Krishnan S,Nambiar M P,Warke V G et al.Alterations in lipid raft composition and dynamics contribute to abnormal T cell responses in systemic lupus erythematosus[J].Immunol,2004;172:7821-7831.
7 Gallo E M,Cante-Barrett K,Crabtree GR.Lymphocyte calcium signaling from membrane to nucleus[J].Nat Immunol,2006;7:25-32.
8 Nicolaou S A,Szigligeti P,Neumeier L et al.Altered dynamics of Kv1.3 channel compartmentalization in the immunological synapse in systemic lupus erythematosus[J].J Immunol,2007;179(1):346-356
9 Rus H,Pardo C A,Hu L et al.The voltage-gated potassium channel Kv1.3 is highly expressed on inflammatory infiltrates in multiple sclerosis brain[J].Proc Natl Acad Sci,2005;102:11094-11099.
10 Hu X,Gu Y,Wang Y et al.Increased CD4+and CD8+effector memory T cells in patients with aptestia anemia[J].Hmatologic,2009;94(3):428-429.
11 Beeton C,Wulff H,Standifer N E et al.Kv1.3 channels are a therapeutic target for T cell-mediated autoimmune diseases[J].PNAS,2006;103:17414-17419.
12 Philippe Azam,Ananthakrishnan Sankaranarayanan,Daniel Homerick et al.Targeting effector memory T cells with the small molecule Kv1.3 blocker PAP-1 suppresses allergic contact dermatitis[J].J Investigative Dermatology ,2007;127:1419-1429.
13 Matheu M P,Beeton C,Garcia A et al.Imaging of effector memory T cells during a delayed-type hypersensitivity reaction and suppression by Kv1.3 channel block[J].Immunity,2008;29:602-614.
