乳腺癌组织Livin和PTEN表达与肿瘤血管生成的相关性①
2012-07-30黄玉钿谭云山曾海英福建医科大学附属福州市第一医院病理科福州350009
黄玉钿 谭云山 曾海英 (福建医科大学附属福州市第一医院病理科,福州350009)
微血管形成是肿瘤细胞获取营养、肿瘤赖以存活及发生远处转移的最基本条件。凋亡抑制蛋白Livin和抑癌基因PTEN的异常表达在肿瘤的发生发展过程中扮演重要角色[1,2]。本研究采用 Elivision免疫组化法检测90例乳腺癌组织和30例乳腺纤维腺瘤组织中Livin和PTEN的表达,分析乳腺癌中两者表达与CD34标记的微血管密度(MVD)及其它临床病理学参数的关系,探讨Livin和PTEN表达对乳腺癌血管生成与侵袭转移的影响及其意义。
1 材料与方法
1.1 材料 2002年至2011年间复旦大学附属中山医院和福建医科大学附属福州市第一医院切除的乳腺浸润性导管癌,石蜡包埋组织90例,患者均为女性,年龄30~80岁,并以30例乳腺纤维腺瘤组织作为对照组,所有病例均有完整临床资料,术前均未接受过放化疗或免疫治疗。乳腺癌组织病理学分级采用Bloom-Richardson系统Nottingham改良方案[3];患者临床分期按照TNM分期法(UICC,2003版)。
1.2 主要试剂和方法 兔抗人多克隆抗体Livin和VEGF为武汉Boster生物公司产品(工作浓度分别为1∶200和1∶100);鼠抗人单克隆抗体PTEN为美国LabVision-NeoMarkers公司产品,为即用型试剂;鼠抗人单克隆抗体CD34为美国LabVision-NeoMarkers公司产品,为即用型试剂;Elivision免疫组化试剂盒购自福州迈新生物公司。采用EliVision免疫组化检测法,乳腺癌及纤维腺瘤石蜡包埋组织制成的组织芯片蜡块经切片、脱蜡、水化、抗原修复,加3%H2O2阻断内源性过氧化物酶,加一抗(Livin、PTEN、VEGF、CD34抗体),室温下孵育 60 分钟,加聚合物增强剂(试剂A),室温下孵育20分钟;加酶标抗鼠/兔聚合物(试剂B),室温下孵育30分钟,再经DAB显色,苏木精衬染,梯度酒精脱水干燥,中性树脂封片。用已知阳性片作阳性对照,同时用PBS代替一抗为阴性对照。
1.3 结果判断 Livin、PTEN和VEGF免疫组化检测结果的判定均采用半定量法:先将特异性定位于乳腺癌细胞浆的染色按着色深浅打分:0分为无色、1分为淡黄、2分为棕黄、3分为棕褐;再将阳性细胞所占百分比打分:0分为阴性、1分为≤10%、2分为11% ~50%、3分为≥51%,两种得分乘积≥3分为阳性表达。采用免疫组化检测 CD34,其标记的MVD 按照 Weidner的标准[4],CD34阳性染色定位于血管内皮细胞,呈棕黄色,乳腺癌组织内孤立的棕黄色血管内皮细胞或细胞团,不管其是否形成管腔,均代表一条可计数的微血管,但管腔直径大于8个红细胞的较大血管排除在外;在低倍镜下选取4个微血管数量最丰富的区域,然后在高倍镜视野(HPF,×400)下计数微血管的数目,取其平均值作为 MVD(个/HPF)。
1.4 统计学处理 采用SPSS11.0统计软件分析:Livin、PTEN和VEGF阳性率的组间差异显著性检验采用χ2检验;用±s代表组内MVD的平均水平,组间差异的显著性检验采用t检验。
2 结果
2.1 Livin、PTEN、VEGF 和 MVD 在乳腺良恶性肿瘤中的表达差异 Livin、PTEN和VEGF阳性表达位于乳腺癌的细胞浆(见图1~3),三者表达阳性率分别为 54.4%(49/90)、48.9%(44/90)、61.1%(55/90),三者在乳腺纤维腺瘤中的表达阳性率分别为16.7%(5/30)、90%(27/30)、13.3%(4/30),以上差异均有统计学意义(P<0.01)。CD34阳性定位于乳腺癌间质微血管内皮细胞浆(见图4),CD34标记的乳腺癌 MVD为(30.81±11.29)个/HPF,高于良性对照组的(9.62 ±2.97)个/HPF,差异有统计学意义(P<0.01)。
2.2 Livin表达与乳腺癌临床病理学参数及MVD、VEGF的关系 乳腺癌中Livin阳性表达与肿瘤大小、临床分期呈正相关,差异具有统计学意义(P<0.05),在不同年龄、病理分级、有/无腋窝淋巴结转移的分组中表达差异无统计学意义(P>0.05),见表1。乳腺癌中Livin阳性组的MVD为(33.51±10.12)个/HPF,高于 Livin 阴性组的(27.58 ±9.34)个/HPF,差异具有统计学意义(P<0.01),且Livin阳性表达与VEGF表达呈正相关(P<0.05),见表2。

图1 乳腺癌细胞浆Livin的阳性表达,Elivision免疫组化检测(×400)Fig.1 Positive expression of Livin in plasma of breast cancer cells,Elivision immunohistochemistry( ×400)
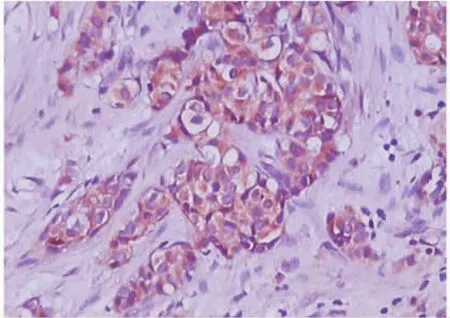
图2 乳腺癌细胞浆PTEN的阳性表达,Elivision免疫组化检测(×400)Fig.2 Positive expression of PTEN in plasma of breast cancer cells,Elivision immunohistochemistry( ×400)
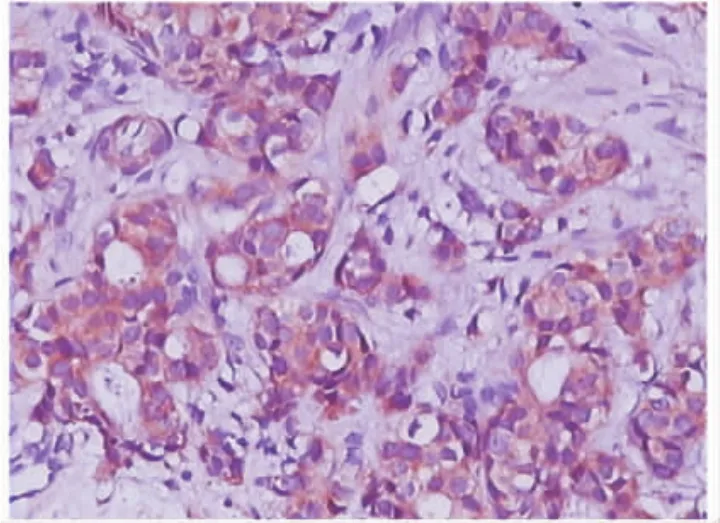
图3 乳腺癌细胞浆VEGF的阳性表达,Elivision免疫组化检测(×400)Fig.3 Positive expression of VEGF in plasma of breast cancer cells,Elivision immunohistochemistry( ×400)
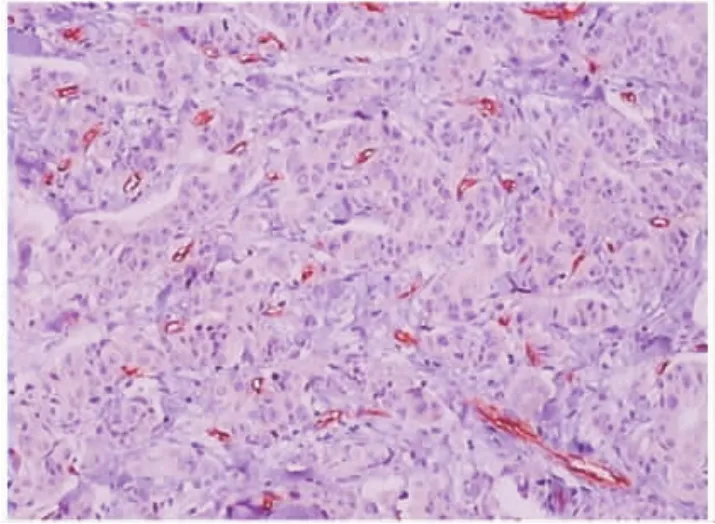
图4 乳腺癌间质微血管内皮细胞浆CD34的阳性表达,Elivision免疫组化检测(×200)Fig.4 Positive expression of CD34 in plasma of microvessel endothelial cells in breast cancer stroma,Elivision immunohistochemistry(×200)

表1 Livin和PTEN表达与乳腺癌患者临床病理学参数的关系Tab.1 Relationships between the Livin and PTEN expression and the clinicopathological parameters in patients with breast cancer

表2 乳腺癌中Livin和PTEN表达与MVD及VEGF表达的关系Tab.2 Relationships between the Livin and PTEN expression and the MVD and the VEGF expression in breast cancer tissues
2.3 PTEN表达与乳腺癌临床病理学参数及MVD、VEGF的关系 PTEN阳性表达与乳腺癌淋巴结转移、临床分期呈负相关,差异具有统计学意义(P<0.05),在不同年龄、肿瘤大小、病理分级分组中表达差异无统计学意义(P>0.05),见表1。PTEN阳性组的乳腺癌组织 MVD 为(28.35 ±10.38)个/HPF,低于PTEN 阴性组的(33.16±11.07)个/HPF,差异具有统计学意义(P<0.05),PTEN阳性表达与VEGF表达无显著相关(P >0.05),见表2。
3 讨论
Folkman于1971年首次提出,恶性肿瘤的无限制侵袭性生长及其转移依赖于血管生成,新生血管为肿瘤生长提供氧气和营养支持,并为肿瘤细胞的转移提供通道[5],关于肿瘤血管生成机制及抗血管生成的研究逐渐成为当今肿瘤研究的热点问题。CD34是一种分子量为110 kD的单链跨膜糖蛋白,是血管内皮细胞的特异性标记,CD34标记的微血管密度(MVD)反映了肿瘤组织内血管生成的程度,已在许多肿瘤中证实是一个独立的预后指标。本研究结果显示,乳腺癌组织MVD较良性对照组显著升高,提示乳腺癌的发生具有明显的血管生成依赖性。血管内皮生长因子(VEGF)是一种重要的血管生成正性调节因子,能刺激血管内皮细胞增殖并促进新生毛细血管网的建立,提高微小血管的通透性,使血浆大分子外渗沉积在血管外的基质中,为肿瘤细胞的生长提供营养等[6]。本研究显示,乳腺癌VEGF阳性表达率显著高于乳腺纤维腺瘤,提示VEGF对微血管生成的直接促进作用,是乳腺癌MVD高于乳腺良性病变组织的重要原因。
凋亡抑制蛋白Livin(又称ML-IAP)是2000年发现的凋亡抑制蛋白(IAP)家族的新成员,它包含有一个高度保守杆状病毒IAP氨基酸重复序列(BIR)和一个指状结构域,可编码Livin-α和Livin-β两种剪切异构体[7]。与 IAP家族其他成员相似,Livin通过BIR结构域与caspases结合并直接抑制caspases的酶水解活性,发挥抗细胞凋亡的作用,在人类胚胎组织及大多数恶性肿瘤中高表达,正常成人组织中低表达。本研究结果表明Livin在乳腺癌中的表达阳性率较良性组显著增高,且Livin阳性率随乳腺癌肿瘤大小和临床分期的上升而增高,提示Livin具有促进乳腺癌生长侵袭的作用,Livin阳性表达反映患者预后不良。本研究还通过检测乳腺癌间质MVD水平,分析Livin与乳腺癌血管生成的关系,结果显示,Livin阳性组的乳腺癌中MVD水平比Livin阴性组显著提高,且Livin阳性表达与VEGF表达呈正相关,提示Livin具有促进乳腺癌血管生成的作用,该作用与Livin对VEGF表达的上调密切相关,其机制可能是通过Livin激活TAK1/JNK1信号转导途径增加VEGF基因的转录表达有关,该途径独立于 caspases途径[8]。
抑癌基因PTEN基因定位于人染色体10q23,编码403个氨基酸,具有双重特异性磷酸酶活性,其抑癌作用主要通过脂质磷酸酶活性使细胞内第二信使3,4-二磷酸磷脂酰肌醇(PIP2)和 3,4,5-三磷酸磷脂酰肌醇(PIP3)去磷酸化,负调控PI3K/PKB/AKT信号转导途径,诱导caspase-9及P27等蛋白活性,介导细胞凋亡,发挥抑癌作用[9,10]。本研究结果表明乳腺癌中PTEN的阳性表达率明显低于良性对照组,且PTEN阳性率与乳腺癌淋巴结转移、临床分期呈负相关,提示PTEN缺失表达在乳腺癌的发生过程中扮演重要角色,PTEN蛋白能有效抑制乳腺癌细胞的侵袭转移。本研究结果还显示,PTEN阳性的乳腺癌组织MVD水平显著低于PTEN阴性组,但PTEN阳性表达与 VEGF表达无显著相关,提示PTEN表达对乳腺癌的血管生成具有抑制作用,PTEN可能是通过蛋白酪氨酸磷酸酶作用,使粘着斑激酶(FAK)去磷酸化,从而抑制血管内皮细胞的粘附和生长[11]。
抑制血管生成是目前乳腺癌临床治疗研究的热点之一,寻求抗乳腺癌微血管生成的有效靶点具有重要意义。本研究显示Livin和PTEN在乳腺癌的血管生成及发生发展过程中分别起促进和抑制作用,临床检测两个指标有助于乳腺癌患者的预后判断,对Livin和PTEN表达的调控有望在乳腺癌的靶向治疗中发挥一定作用。
1 Dasgupta A,Alvarado C S,Xu Z et al.Expression and functional role of inhibitor-of-apoptosis protein livin(BIRC7)in neuroblastoma[J].Biochem Biophys Res Commun,2010;400(1):53-59.
2 Schneider E,Keppler R,Prawitt D et al.Migration of renal tumor cells depends on dephosphorylation of Shc by PTEN[J].Int J Oncol,2011;38(3):823-831.
3 Meyer JS,Alvarez C,Milikowski C et al.Breast carcinoma malignancy grading by Bloom-Richardson system vs proliferation index:reproducibility of grade and advantages of proliferation index[J].Mod Pathol,2005;18(8):1067-1078.
4 Möbius C,Demuth C,Aigner T et al.Evaluation of VEGF A expression and microvascular density as prognostic factors in extrahepatic cholangiocarcinoma[J].Eur J Surg Oncol,2007;33(8):1025-1029.
5 Samaranayake H,Maatta A M,Pikkarainen J et al.Future prospects and challenges of antiangiogenic cancer gene therapy[J].Hum Gene Ther,2010;21(4):381-396.
6 Mabuchi S,Kawase C,Altomare D A et al.Vascular endothelial growth factor is a promising therapeutic target for the treatment of clear cell carcinoma of the ovary[J].Mol Cancer Ther,2010;9(8):2411-2422.
7 Abd-Elrahman I,Hershko K,Neuman T et al.The inhibitor of apoptosis protein Livin(ML-IAP)plays a dual role in tumorigenicity[J].Cancer Res,2009;69(13):5475-5480.
8 Sanna M G,da Silva Correia J,Ducrey O et al.IAPsuppression of apoptosis involves distinct mechanisms:the TAK1/JNK1 signaling cascade and caspase inhibition[J].Mol Cell Biol,2002;22(6):1754-1766.
9 Mitra A K,Jia G,Gangahar D M et al.Temporal PTEN inactivation causes proliferation of saphenous vein smooth muscle cells of human CABG conduits[J].J Cell Mol Med,2009;13(1):177-187.
10 黄玉钿,张 声,郑 曦et al.乳腺癌细胞凋亡及侵袭转移与诱导型一氧化氮合酶、抑癌基因PTEN及环氧合酶-2表达的关系[J].中华实验外科杂志,2010;27(6):714-716.
11 Tanaka M,Koul D,Davies M A et al.MMAC1/PTEN inhibits cell growth and induces chemosensitivity to doxorubicin in human bladder cancer cells[J].Oncogene,2000;19(47):5406-5412.
