粉尘螨变应原第10组分基因克隆表达及生物信息学分析①
2012-07-30孙金霞王运刚马桂芳崔玉宝盐城卫生职业技术学院盐城224006
周 鹰 孙金霞 杨 李 王运刚 马桂芳 崔玉宝 (盐城卫生职业技术学院,盐城224006)
传统采用药物治疗Ⅰ型变态反应性疾病,只能暂时缓解患者症状,而变应原特异性免疫治疗具有特异性、可根除疾病的优点[1]。目前,临床普遍使用变应原粗提浸液混合物进行免疫治疗,其成分复杂,含有变应原、非变应原、甚至于毒性蛋白成分,因此临床应用会发生副反应,严重者会威胁患者生命[2-4]。重组DNA技术为变应原的生产提供了新的途径,通过基因工程技术可以按照人类意志降低变应原的致敏性。迄今,人们已经获得数百种重组变应原,为过敏性疾病患者个体化诊疗提供了可能,重组变应原用于皮下注射和舌下含服免疫治疗过敏性疾病也进入了临床研究[5,6]。
国际免疫学会联合会(WHO/IUIS,http://www.allergen.org)已命名了23组尘螨变应原,了解这些变应原组分的分子特征必将有助于临床诊断和治疗尘螨过敏性疾病。此外,已有报道多组变应原组分存在多态性,并影响其临床诊断和治疗效果[7]。因此,有必要了解我国尘螨变应原各组分的免疫生物学特征。本课题组采用基因工程技术先后获得了粉尘螨变应原第1至10组分的编码基因,现将第10组分基因克隆表达结果报道如下。
1 材料与方法
1.1 材料 EcoRⅠ酶、HindⅢ酶、TaKaRa RNAiso Reagent(Code No.D312)、High Fidelity PrimeScriptTMRT-PCR Kit(TaKaRa Code No.DR027A)、Prime-STAR®HSDNA(TaKaRa Code No.DR010A)、TaKa-Ra DNA Fragment Purification Kit Ver.2.0(Code No.DV807)、TaKaRa DNA A-Tailing Kit(Code No.D404)、TaKaRa DNA Ligation Kit< Mighty Mix>(Code No.D6023)、pMD19-T simple(Code No.D104)、E.coli Competent Cells JM109(Code No.D9052)、TaKaRa Agarose Gel DNA Purification Kit Ver.2.0(Code No.DV805)、Protein marker 均购自大连宝生物公司。E.coli BL21(DE3)Stratagene公司生产。pET28a(+)(Kit Lot No.N72770)及Perfect protein marker由Novagen公司生产。Precision Plus Protein Standards购自Bio-Rad公司。True blue PEROXIDASE Substrate由Kirkegaard&Perry Laboratories(KPL,Gaithersburg,MD)提供。Isopropyl-β-D-thiogalactopyranoside(IPTG)(Code No.D9030A)、CBB-R250染色、PVDF膜、Western blot膜封闭液、CBB-R250染色液购自天根生化科技(北京)有限公司。Penta-His Antibody(BSA free)购自QIAGEN公司。HRP-Robbit Anti-Mouse IgG(H+L)购自ZYMED Laboratories公司。其他化学试剂均为国产分析纯。TP3000 PCR 仪(TaKaRa Bio Inc.),Mupid电泳仪(Advance-Bio Co.,Ltd),ImageMaster®VDS电泳成像装置(Pharmacia Biotech),ABI PRISMTM377XL DNA Sequencer DNA测序仪(Perkin Elmer)。
1.2 方法 解剖镜下挑取粉尘螨(Dermatophagoides farinae)约600只,匀浆后用TaKaRa RNAiso Reagent试剂盒提取总RNA,操作按说明书进行。根据GenBank(EU 106617)公布的Der f 10 CDS区序列设计引物,并加入BamHⅠ/HindⅢ酶切位点,由宝生物工程(大连)有限公司合成如下:上游引物F:GC-3',下游引物GTGGTGGTGCTCGAG-3',下游引物R2:5'-GTGGTGGTGCTCGAGTGCGGCCGCATAACCAGTAA-3'。以总RNA为模板,反转录后经套式PCR扩增出目的基因并克隆至pMD19-T simple载体测序,将测序正确的目的基因插入表达质粒pET28a(+),转入E.coli BL21(DE3)表达,用 SDS-PAGE和 Western blot鉴定重组蛋白。
1.2.1 反转录 使用 High Fidelity PrimeScriptTMRT-PCR Kit(Code No.DR027A)进行反转录试验,取Eppendorf管1支,依次加入总 RNA 1μl、各10 mmol/L dNTP Mixture 0.5 μl、20 μmol/L Random 6 mers 0.5 μl和RNase Free dH2O 3 μl,65℃水浴5 分钟后,立即置冰上放置2分钟,然后加入5×Prime-Script RT Buffer 2 μl、40 U/μl RNase Inhibitor 0.25 μl、PrimeScript RTase 0.5 μl、RNase Free dH2O 2.25 μl,置30℃ 10分钟、42℃30分钟、70℃15 分钟进行反应。
1.2.2 套式PCR扩增 Der f 10全长 cDNA 使用PrimeSTAR®HS DNA Polymerase(Code No.DR010A),进行PCR扩增,PCR反应总体积25μl,具体组成如下:上述反转录反应液2μl,5×Prime-STAR PCR Buffer 5 μl,各 2.5 mmol/L dNTP Mixture 2μl、10 μmol/L上游引物F 1 μl、10μmol/L下游引物 R21 μl、2.5 U/μl PrimeSTAR®HS DNA Polymerase 0.25 μl、dH2O 13.75 μl。反应条件:94℃变性2分钟后,98℃ 10秒、55℃ 30秒、72℃ 30秒条件下进行30个循环,72℃ 5分钟延伸。取上述PCR产物进行二次PCR,反应体积50μl,组成如下:上述PCR反应液2 μl、5 ×PrimeSTAR PCR Buffer 10 μl、各2.5 mmol/L dNTP Mixture 4 μl、10 μmol/L上游引物F 1 μl、10 μmol/L 下游引物 R11 μl、2.5 U/μl Prime-STAR®HSDNA Polymerase 0.25 μl、dH2O 31.5 μl。反应条件:94℃变性2分钟后,98℃ 10秒、55℃ 30秒、72℃ 30秒条件下进行30个循环,72℃ 5分钟延伸。取5μl PCR产物上样电泳,观察目的条带。
1.2.3 克隆载体构建、阳性克隆筛选及鉴定 回收上述PCR产物,加“A”尾、DNA精制后,将目的基因片段与pMD19-T Simple Vector(Code No.D104)连接后,热转化至感受态 E.coli JM109(Code No.D9052),涂布于含氨苄青霉素(100μg/ml)的LB平板上,37℃培养过夜。随机挑取16个白色菌落,利用载体上的引物进行PCR扩增后行琼脂糖凝胶电泳,含有目的条带的菌落为阳性克隆菌。取阳性克隆菌置于含氨苄青霉素的TB培养液中,37℃振摇培养过夜。取重组阳性克隆,提取质粒,用 Bam HⅠ/HindⅢ双酶切鉴定pMD19-T-Der f 10,酶切反应体积为 10 μl,组成为重组质粒 1 μl、15 U/μl的BamHⅠ0.5 μl、15 U/μl的 Hind Ⅲ 0.5 μl、K Buffer 1 μl,dH2O 7 μl、37℃水浴30 分钟,用1.0%琼脂糖凝胶电泳检测酶切片段的大小。以重组质粒DNA为模板,委托宝生物工程(大连)有限公司进行序列测定。
1.2.4 表达质粒pET28a(+)-Der f 10的构建及鉴定 用BamHⅠ和HindⅢ对上述阳性质粒进行双酶切,反应体积 50 μl,组成如下:约 200 ng/μl的pMD19-T-Der f 10 5 μl、10 × K Buffer 5 μl、15 U/μl BamHⅠ 1.5 μl、15 U/μl Hind Ⅲ1.5 μl、dH2O 37 μl,置37℃过夜,取5μl进行1% 琼脂糖凝胶电泳,用 TaKaRa Agarose Gel DNA Purification Kit Ver.2.0(Code No.DV805A)切胶回收得目的基因片段。用BamHⅠ和HindⅢ对pET28a(+)载体进行酶切,反应体积 50 μl,组成如下:约 100 ng/μl的 pET28a(+)10 μl、10 ×K Buffer 5 μl、15 U/μl BamHⅠ 1.5 μl、15 U/μl Hind Ⅲ1.5 μl、dH2O 32 μl,置 37℃ 过夜,取5μl进行1% 琼脂糖凝胶电泳,切胶回收大片段,用TaKaRa DNA Ligation Kit将目的基因片段和pET28a(+)连接后,热转化至E.coli Competent Cells JM109,37℃培养过夜。挑取单个菌落,提取质粒后行琼脂糖凝胶电泳,对目的质粒行BamHⅠ/HindⅢ双酶切鉴定,取10μl进行1%琼脂糖凝胶电泳。
1.2.5 重组蛋白的诱导表达 取pET28a(+)-Der f 10阳性克隆 0.5μl转化 Competent cell BL21(DE3)100μl,涂布于 LB平板 (LB/抗生素 Kana为50μl/450μl)上,37℃摇菌过夜,以 pET28a(+)vector进行同样操作。次日挑取单菌落至2 ml LB/抗生素培养液中,37℃摇菌至OD600 nm值约为0.5 ~0.7,添加 IPTG 50 μl(final 1 mmol/L IPTG),37℃诱导3小时后进行蛋白质抽提,分别取各抽提液(全蛋白、上清可溶性蛋白、沉淀的不溶性蛋白)10 μl,加入 2.5 μl 5 ×SDSsample buffer,95℃加热10 分钟,12.5 μl(约0.05 OD)上样进行 SDSPAGE电泳,剩余样品-80℃保存。电泳条件:20 mA/枚,90 分钟,12%polyacrylamide gel,每孔加入5 μl TaKaRa protein marker(Broad)。电泳结束后,CBB-R250染40分钟以上,使用脱色液脱色。
1.2.6 Western blot鉴定重组蛋白 按上述方法进行SDS-PAGE电泳,按阳极、滤纸 A、滤纸 B、PVDF膜、PAGE Gel、滤纸 C、阴极顺序进行 Blot stack,将蛋白质转移(Semi-dry Blot)到 PVDF膜。再将PVDF 膜置 10 ml Blocking buffer(1.5%BSA、20 mmol/L Tris-HCl、150 mmol/L NaCl、0.1%Tween 20)中,4℃平放过夜封闭。用 Blocking buffer按1∶1 000 稀释一抗(Penta-His Antibody,BSA free,QIAGEN),取5 ml抗体溶液置PVDF膜上静置1小时,洗涤 Buffer(150 mmol/L NaCl,20 mmol/l Tris-HCl)+0.1%Tween(20 ml)洗涤2次,洗涤 Buffer冲洗3次。使用Blocking Buffer按1∶1 000稀释二抗[HRP-Rabbit Anti-Mouse IgG(H+L),ZYMED],取稀释后抗体溶液5 ml置PVDF膜上1小时,同上法洗涤,同前法洗涤去除多余的抗体,用1 ml True-Blue Peroxidase Substrate显色1分钟。将PVDF膜置于水中终止反应。
1.3 生物信息学分析 将原始测序结果5'和3'端的酶切位点去除后,NCBI网站在线软件进行ORF分析。用Translate工具推导编码氨基酸的序列及理化性质,CELLO2.5软件进行亚细胞定位,Finger-PRINTScan分析其模序特点。
2 结果
2.1 粉尘螨变应原Der f 10基因扩增结果 RNAiso Reagent试剂盒提取粉尘螨总RNA后,根据Gen-Bank公布的Der f 10核酸序列设计并合成引物,RT-PCR扩增获得Der f 10,其产物经琼脂糖凝胶电泳,见一条约888 bp的条带,与理论值相符合(具体见图1)。
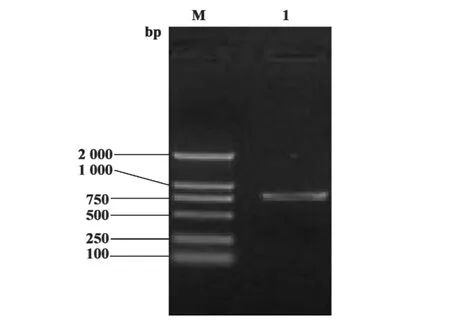
图1 粉尘螨变应原第10组分RT-PCR产物琼脂糖凝胶电泳图Fig.1 Electrophoresis analysis of the RT-PCR product of the group 10 allergen of Dermatophagoides farinae
2.2 克隆质粒构建及酶切鉴定结果 将回收的PCR产物与pMD19-T simple连接后,转化至E.coli Competent Cells JM109中,过夜培养,蓝白斑筛选并提取8个质粒,用BamHⅠ/HindⅢ双酶切鉴定获得与预期相符的结果,1.0%琼脂糖凝胶电泳结果见图2。
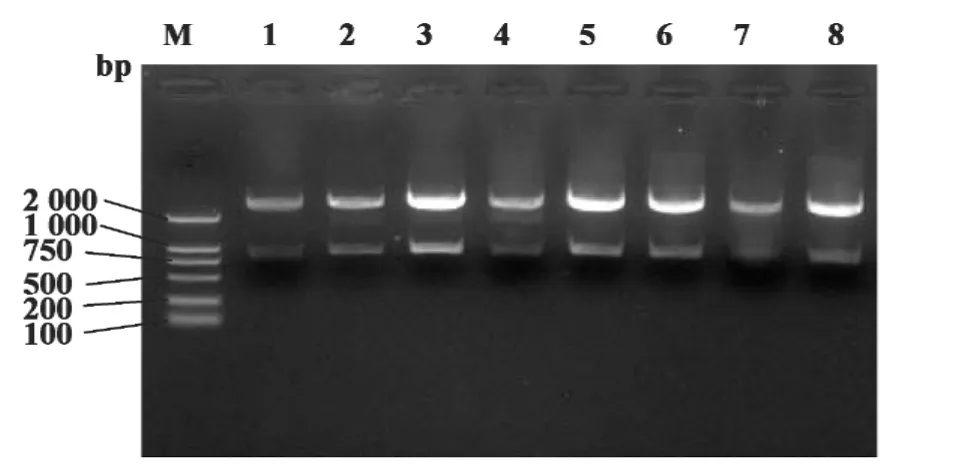
图2 重组质粒p MD 19-T-Der f 10双酶切鉴定电泳图Fig.2 Enzyme digestion analysis of the recombinant plasmid p MD 19-T-Der f 10
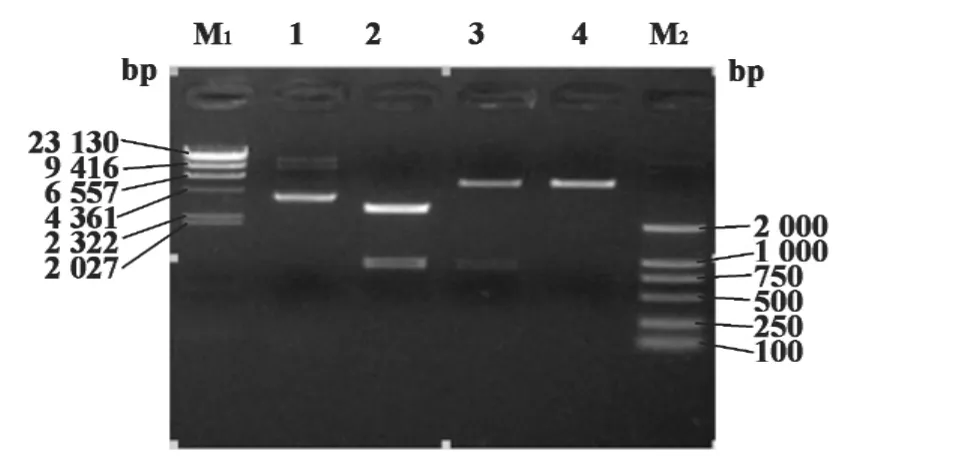
图3 原核表达质粒pET28a(+)-Der f 10酶切鉴定Fig.3 The enzyme digestion analysis of the plasmids pET28a(+)-Der f 10
2.3 核酸序列测定 从酶切鉴定正确的8个质粒中随机挑取前5个质粒,使用引物Primer pMD18F/Primer pMD18R对阳性重组质粒测序,去除原始测序结果5'和3'端的酶切位点后,从起始密码子ATG到终止密码子TAA共888 bp,与参考序列(Accession Number EU106617)比对,序列同源性高达99.8%,有2处发生碱基突变,依次位于57 bp(T→C)和429 bp(T→A),但并不引起氨基酸变化。
2.4 原核表达质粒pET28a(+)-Der f 10的构建及鉴定 用BamHⅠ/HindⅢ双酶切pMD 19-T-Der f 10,回收后获得目的基因,将其插入pET28a(+)载体,质粒提取后行琼脂糖凝胶电泳,挑选目的质粒用BamHⅠ/HindⅢ进行酶切鉴定,经1%琼脂糖凝胶电泳显示出两个条带,与预期相符(见图3),说明原核表达质粒构建成功。
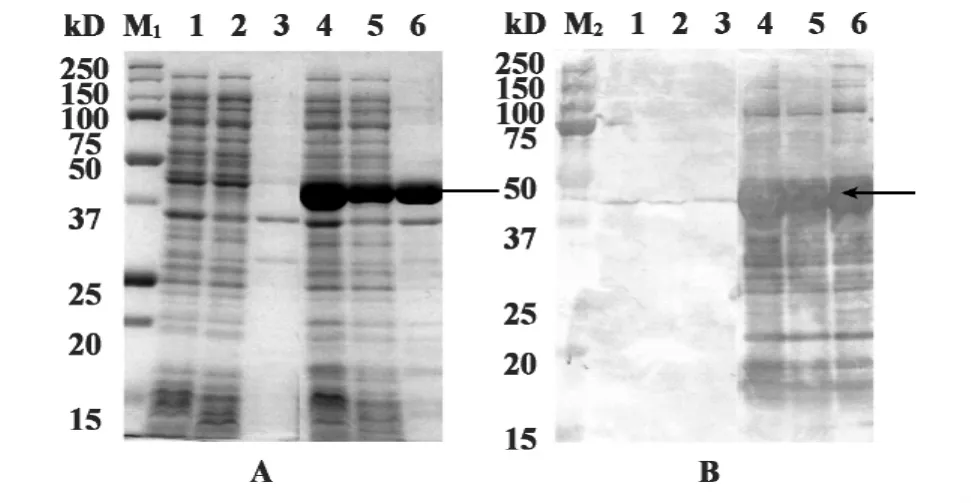
图4 粉尘螨变应原第10组分原核表达及鉴定Fig.4 Expression of r Der f 10 in E.coli BL21 cells
2.5 重组变应原rDer f 10的表达及鉴定 将pET28a(+)-Der f 10质粒转化宿主菌E.coli BL21,测定得吸光度值为0.614,诱导表达后吸光度值为0.993,SDS-PAGE电泳时出现特异性条带;Western blot分析表明重组蛋白可与抗His-Tag Mab抗体结合,也出现一特异性的反应条带,具体见图4A、B。
2.6 氨基酸序列推导、蛋白质结构和功能预测 由测序结果推导Der f 10全长cDNA由295个氨基酸组成,相对分子质量为34 233.1 Da,摩尔消光系数(Molar extinction coefficient)5 960,等电点为 4.90;该蛋白的不稳定系数是44.71,表明该蛋白性质不稳定;其亲水性指数(Grand average of hydropathicity,GRAVY)为 -1.063,表明其为疏水性蛋白。GOR4预测其二级结构包括 α-螺旋(271aa,91.86%)、延伸主链(4,1.36%)和无规卷曲(20,6.78%),具体见图5。将推导出来的氨基酸序列输入FingerPRINTScan在线工具发现5个原肌球蛋白(Tropomyosin)模序,其分别位于 84~101、120~140、145~173、175~198和231~256氨基酸处。
3 讨论

图5 粉尘螨变应原第10组分二级结构分析(GOR4软件)Fig.5 The secondary structure analysis of the group 10 allergen of Dermatophagoides farinae(GOR4 software)
特异性免疫治疗被认为是目前惟一的哮喘病因治疗方法,可以提高患者对特异性变应原的免疫耐受力,改变哮喘病程、阻滞症状的恶化和防治对新的变应原产生过敏[2-4]。目前,临床主要采用粉尘螨变应原粗提浸液免疫治疗哮喘患者,由于变应原浸液包含成分较复杂,如存在变应原、非过敏性或毒性蛋白及其它成分,所以很难进行变应原标准化,且在治疗中长期使用易导致红晕、肿胀、硬结、坏死等局部反应和休克、喉头水肿、支气管痉挛、荨麻疹、血管性水肿、全身性红斑等全身反应[2-4]。随着分子生物学技术的发展和成熟,研制基因工程变应原成为变态反应学研究的主流。本次研究获得了粉尘螨变应原第10组分全长基因,并成功构建其原核表达体系,为进一步生产重组变应原用于临床诊断和治疗奠定了基础。
随着功能基因组、基因芯片和蛋白质芯片技术迅猛发展,生物信息学分析已成为变态反应学研究的重要手段,尤其是用于变应原结构、模序及表位研究[8-10]。通过对Der f 10测序结果的生物信息学分析,提示此变应原由295个氨基酸组成的疏水性蛋白,相对分子质量为34 233.1 Da。功能位点分析发现Der f 10含有5个原肌球蛋白位点,提示此变应原与原肌球蛋白具有同源性。进一步的分析显示,其二级结构包括 α-螺旋(91.86%)、延伸主链(1.36%)和无规卷曲(6.78%)。α-螺旋是指氨基酸链形成螺旋状,4个氨基酸螺旋成一周,其在Der f 10二级结构占有绝对优势,一定会对其三维结构具有重要作用,并在其与IgE抗体结合反应中发挥重要作用,因此有必要开展针对其二级结构的后续研究。
1 Valenta R,Niespodziana K,Focke-Tejkl M et al.Recombinant aller gens:what does the future hold [J] J Allergy Clin Immunol,2011;127(4):860-864.
2 Ventura M T,D’Erasmo M,di Giodia R et al.Adverse reaction to specific immunotherapy for house-dust mite in a patient with Anisakis allergy[J].JEur Acad Dermatol Venereol,2008;22(2):259-260.
3 Bousquet J,Hejjaoui A,Dhivert H et al.Immunotherapy with a standardized Dermatophagoides pteronyssinus extractⅢ:systemic reactions during the rush protocol in patients suffering from asthma[J].JAllergy Clin Immunol,1989;83(4):797-802.
4 Focke M,Swoboda I,Marth K et al.Developments in allergen-specific immunotherapy:from allergen extracts to allergy vaccines bypassing allergen-specific immunoglobulin E and T cell reactivity[J].Clinical and Experimental Allergey,2010;40(3):385-397.
5 Valents R,Niespodziana K,Focke-Tejkl M et al.Recombinant allergens:what does the future hold [J]JAllergy Clin Immunol,2011;127(4):860-864.
6 Valenta R,Linhart B,Swoboda I et al.Recombinant allergens for allergen-specific immunotherapy:10 years anniversary of immunotherapy with recombinant allergens[J].Allergy,2011;66(6):775-783.
7 Piboonpocanun S,Malainual N,Jirapongsananuruk O et al.Genetic polymorphisms of major house dust mite allergens[J].Clin Exp Allergy,2006;36(4):510-516.
8 Brusic V,Petrovsky N.Bioinformatics for characterisation of allergens,allergenicity and allergic crossreactivity[J].Trends Immunol,2003;24(5):225-228.
9 Brusic V,Petrovsky N,Gendel SM et al.Computational tools for the study of allergens[J].Allergy,2003;58(11):1083-1092.
10 Song J,Li L,Liu Z et al.Sequence analysis and expression of a cDNA clone encoding tropomysin in Sinonovacula constricta[J].Mol Biol Rep,2009;36(2):315-321.
