柯萨奇病毒B组3型亚单位疫苗与基因靶向疫苗免疫小鼠的效果比较①
2012-07-30高志云蓝佳明金玉怀刘贵霞张永红王永祥
高志云 蓝佳明 金玉怀 李 剑 刘贵霞 羡 仙 张永红 王永祥
(河北医科大学病原生物学教研室,石家庄050017)
柯萨奇病毒 B组 3型(Coxsackievirus B3,CVB3)感染所致的病毒性心肌炎严重危害人类健康。自病原体确立以来,已开展大量疫苗研发工作,但并没有获得满意的进展。研究显示,CVB3衣壳蛋白1(Capsid protein1,VP1)是其主要的中和抗原,可诱导机体产生保护性免疫应答。
本室前期构建了原核表达质粒pET-his/VP1,证实表达VP1蛋白,并且将分泌型CVB3 VP1的基因和三拷贝C3d分子的基因拼接,构建成靶向B细胞的融合基因疫苗pcDNA3/C3d3-sVP1和rAd/C3d3-sVP1[1,2]。为筛选较好的候选疫苗,本研究将VP1蛋白、pcDNA3/C3d3-sVP1和 rAd/C3d3-sVP1分别免疫小鼠,通过观察不同疫苗诱导的特异性免疫应答水平,以及病毒攻击后的免疫保护作用来评价疫苗的免疫效果。
1 材料与方法
1.1 细胞、菌株和病毒株 人宫颈癌细胞系(He-La)细胞,本室保存;人胚肾293(HEK293)细胞购自中国医学科学院基础所细胞中心;大肠杆菌E.coli DH5α 和 BL21(DE3)pLysS,CVB3 Nancy株,本室保存。
1.2 质粒、重组腺病毒及实验动物 原核表达质粒pET-his/VP1、真核表达质粒pcDNA3/C3d3-sVP1和重组腺病毒rAd/C3d3-sVP1,本室前期构建。6~8周龄雄性纯系BALB/c小鼠购自河北医科大学实验动物中心。
1.3 试剂 各种工具酶购自美国Promega公司;腺病毒沉淀法纯化试剂盒购自上海杰美基因医药科技有限公司;细胞计数试剂盒CCK-8购自日本同仁化学研究所。抗His单克隆抗体(mAb)和辣根过氧化物酶(HRP)标记的羊抗鼠IgG购自北京中杉公司。其他试剂购自国内外生物公司。
1.4 质粒的大量提取与纯化 将pcDNA3/C3d3-sVP1转化感受态大肠杆菌DH5α,然后接种至2YT液体培养基(含氨苄青霉素),于37℃振荡培养过夜,收集菌体,按碱裂解法大量制备质粒,并用PEG法对之进行纯化,定量后保存于-70℃备用。
1.5 重组腺病毒的大量扩增与纯化 大量培养HEK293细胞,将第三代重组腺病毒rAd/C3d3-sVP1分别感染293细胞。当大部分细胞(约80%)出现细胞病变时,收集细胞,用腺病毒纯化试剂盒纯化。用GFP阳性细胞计数法测定病毒滴度,-70℃保存备用。
1.6 VP1蛋白的表达和纯化 按参考文献[3]方法,将表达CVB3VP1蛋白的重组质粒pET-his/VP1转入感受态菌E.coli BL21(DE3)pLysS中,然后转种于 LB液体培养基中,37℃培养至A600为0.6~0.8时,加IPTG至终浓度为1 mmol/L,于30℃诱导5小时。用超声波裂解细菌,离心后收集包涵体沉淀,用Western blot鉴定蛋白。其余沉淀用尿素溶解,用Ni-NTA亲和层析柱纯化目的蛋白,透析后浓缩定量保存于-70℃备用。
1.7 免疫接种 6~8周龄雄性纯系BALB/c小鼠随机分为4组,每组18只,分别于股四头肌注射PBS、pcDNA3/C3d3-sVP1、rAd/C3d3-sVP1 与 VP1蛋白。PBS组、pcDNA3/C3d3-sVP1质粒组与VP1蛋白组免疫3次,间隔3周;rAd/C3d3-sVP1腺病毒组免疫2次,间隔2周。质粒接种前注射25%高渗蔗糖溶液100μl,20分钟后原位注射质粒100μg/100μl;重组腺病毒每次每只1.2×107pfu/100μl;PBS组每次每只注射100μl;VP1蛋白初次免疫加完全弗氏佐剂,加强免疫用不完全弗氏佐剂,每次每只接种50μg。
1.8 血清特异性IgG检测 采用ELISA方法。每次接种后第14天内眦静脉取血,分离血清。用纯化的VP1蛋白包被96孔酶标板,洗涤后加入2倍系列稀释的上述小鼠血清,每个稀释度4复孔,同时设阴性和空白对照孔,37℃孵育2小时,洗涤后加辣根过氧化物酶标记的羊抗小鼠 IgG,再次洗涤后加TMB显色。用酶标仪测450 nm吸光度(A)值。(试验孔A450-空白对照孔A450)/(阴性对照孔A450-空白对照孔A450)≥2.1时判为阳性。以阳性孔最高血清稀释度的倒数作为该血清IgG抗体滴度。
1.9 中和抗体检测 采用微量中和试验方法。取上述小鼠血清置56℃水浴30分钟灭活,用 RPMI1640维持液(含青、链霉素各100 U/ml)稀释成1∶5、1∶10、1∶20、1∶40、1∶80、1∶160、1∶320,共 7 个稀释度。将各稀释度血清加入96孔板中,每个稀释度4个复孔,每孔50μl。每孔加入100TCID50CVB3 50 μl,于37℃ 5%CO2孵育60分钟。HeLa单层细胞经胰酶消化后,调浓度为5×108ml-1,每孔加入50μl。另设病毒对照孔、血清对照孔和细胞对照孔,于37℃ 5%CO2孵育,每日于倒置显微镜下观察细胞病变效应。以能保护细胞不出现细胞病变的最高血清稀释度的倒数作为该血清标本的中和抗体滴度。
1.10 特异性CTL检测 末次免疫后3周,每组取3只小鼠处死,无菌取脾。将脾淋巴细胞用IL-2、ConA和灭活的CVB3体外刺激3天,作为效应细胞。用灭活的CVB3体外刺激1天的SP2/0细胞作为靶细胞。以效靶比为40∶1进行试验,靶细胞以含10%新生牛血清的1640培养液稀释至1×105ml-1,加入96孔板中,每孔100μl,每孔加入效应细胞100μl,同时加入IL-2、ConA和灭活的CVB3刺激,于37℃、5%CO2孵箱中培养24小时,采用CCK-8法检测脾细胞杀伤活性,具体操作按说明书进行。同时设效应细胞孔和靶细胞孔各3复孔。杀伤率(%)=[1-(效靶A值-效应细胞A值)/靶细胞A值]×100%。
1.11 血中病毒滴度测定 末次免疫后3周,每组取3只小鼠,腹腔注射3LD50的CVB3。第7天取血后分离血清,用RPMI1640细胞维持液10倍系列稀释,接种HeLa单层细胞,于37℃ 5%CO2条件下孵育并逐日观察CPE,按Reed-Muench法计算病毒的滴度。
1.12 攻毒试验 末次免疫后3周,小鼠腹腔注射含4LD50的 CVB3的病毒液0.2 ml/只,观察各组小鼠的存活情况至感染后第21天。
1.13 统计学处理 用SPSS14.0统计软件进行统计分析。小鼠中和抗体、血清特异性IgG抗体水平、CTL的杀伤率和病毒滴度的比较采用单因素方差分析,两两比较使用SNK检验;生存率和生存时间的比较分别采用卡方检验。
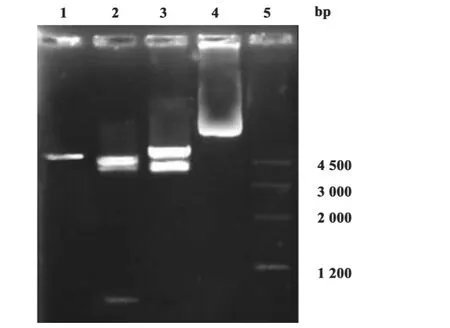
图1 重组质粒pcDNA3/C3d3-sVP1的酶切电泳结果Fig.1 Digestion results of pcDNA3/C3d3-sVP1
2 结果
2.1 质粒pcDNA3/C3d3-sVP1的鉴定 大量制备的质粒经提纯后酶切鉴定,除可见预期的特异性条带外,未见其他非特异性条带(图1)。
2.2 重组腺病毒rAd/C3d3-sVP1的培养 重组腺病毒rAd/C3d3-sVP1感染293细胞后,用荧光显微镜可观察到腺病毒增殖情况(图2)。
2.3 VP1蛋白的鉴定 将纯化后蛋白进行SDSPAGE,用His单抗作Western blot检测显示,相对分子质量在33 000左右有一条清晰的目的条带(图3)。
2.4 血清特异性IgG水平 结果显示,除PBS组未检测到VP1特异性IgG抗体外,其余各组IgG抗体滴度随免疫次数的增加而提高(P<0.05);末次免疫后各组比较,VP1蛋白组抗体滴度显著高于pcDNA3/C3d3-sVP1和 rAd/C3d3-sVP1组(P <0.05),提示3种疫苗均能诱导出较强的特异性抗体,但以VP1蛋白疫苗最为显著(见表1)。
2.5 血清中和抗体水平 PBS组各次平均效价均低于1∶5,其余3组中和抗体滴度逐次增加(P<0.05)。各组各次免疫后血清中和抗体平均滴度见表2。从表中可以看出,末次免疫后,VP1蛋白组的中和抗体滴度明显高于pcDNA3/C3d3-sVP1组和rAd/C3d3-sVP1 组(P <0.05)。
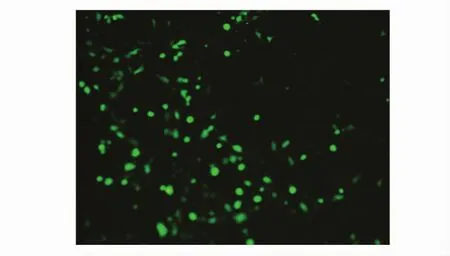
图2 荧光显微镜观察重组腺病毒r Ad/C3d3-sVP1感染的HEK293细胞(×200)Fig.2 Fluorescence microscopy analysis of recombinant adenovirus r Ad/C3d3-sVP1 production(×200)
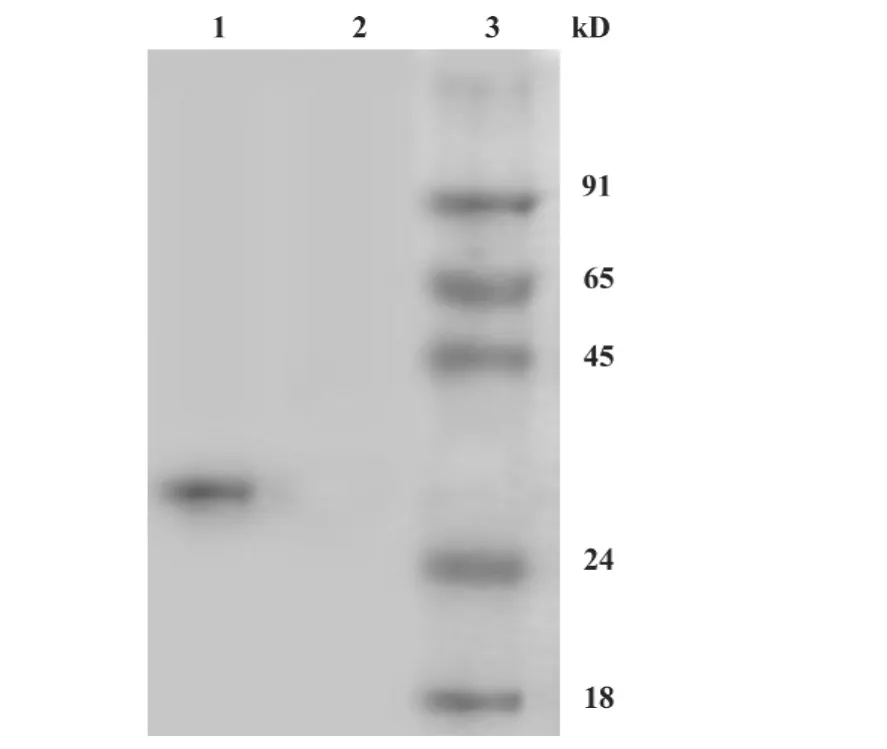
图3 重组蛋白的Western blot检测结果Fig.3 Western blot analysis of the purposing protein by His antiboby
表1 血清特异性VP1 IgG滴度(±s)Tab.1 Mean sera specific VP1 IgG titers±s)
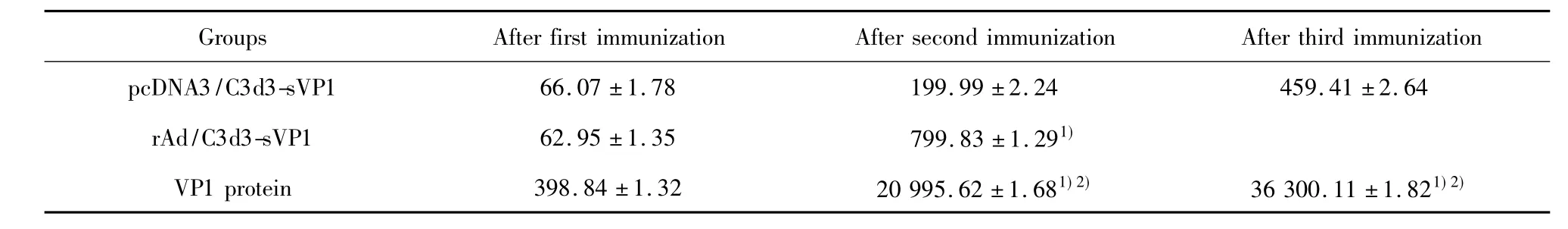
表1 血清特异性VP1 IgG滴度(±s)Tab.1 Mean sera specific VP1 IgG titers±s)
Note:After the last immunization:compared with pcDNA3/C3d3-sVP1,1)P <0.05;compared with rAd/C3d3-sVP1,2)P <0.05.
Groups After first immunization After second immunization After third immunization pcDNA3/C3d3-sVP1 66.07 ±1.78 199.99 ±2.24 459.41 ±2.64 rAd/C3d3-sVP1 62.95 ±1.35 799.83 ±1.291)VP1 protein 398.84 ±1.32 20 995.62 ±1.681)2) 36 300.11 ±1.821)2)
表2 平均的中和抗体滴度±s)Tab.2 Mean neutralizing antibody titers(±s)
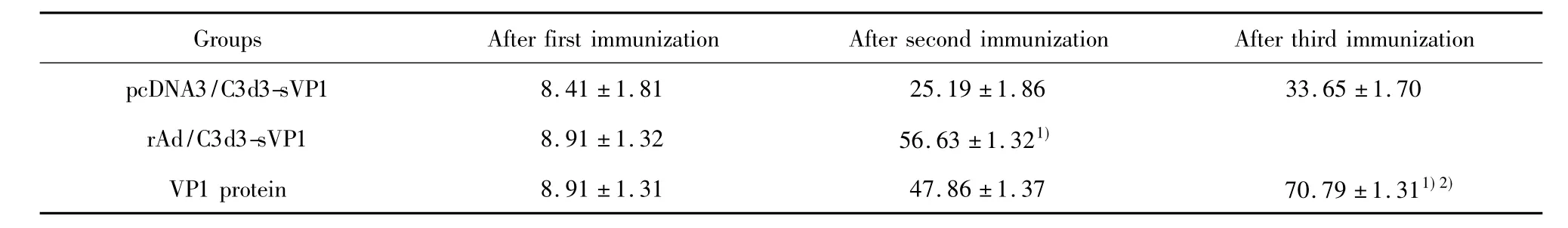
表2 平均的中和抗体滴度±s)Tab.2 Mean neutralizing antibody titers(±s)
Note:After the last immunization:compared with pcDNA3/C3d3-sVP1,1)P <0.05;compared with rAd/C3d3-sVP1,2)P <0.05.
Groups After first immunization After second immunization After third immunization pcDNA3/C3d3-sVP1 8.41 ±1.81 25.19 ±1.86 33.65 ±1.70 rAd/C3d3-sVP1 8.91 ±1.32 56.63 ±1.321)VP1 protein 8.91 ±1.31 47.86 ±1.37 70.79 ±1.311)2)
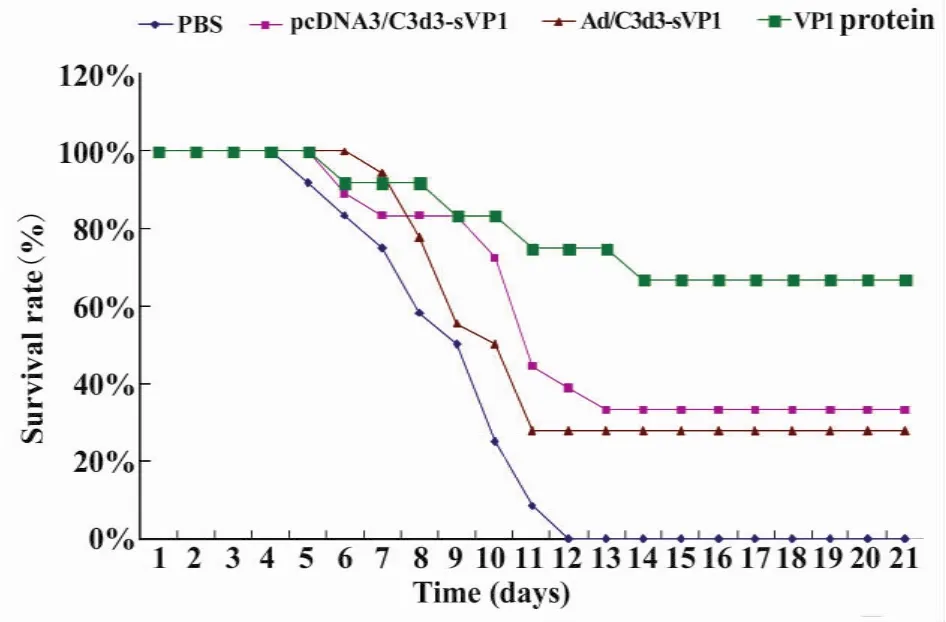
图4 4LD50攻击后小鼠生存曲线Fig.4 Survival curve of BALB/c mice challenged with 4LD50 CVB3
2.6 特异性CTL杀伤活性 当效靶比为40∶1时,小鼠脾脏特异性杀伤活性分别为:PBS组(24.53±4.65)%、pcDNA3/C3d3-sVP1 组(36.33 ±2.52)%、rAd/C3d3-sVP1组(67.31 ±2.54)% 和 VP1 组(47.39±4.01)%。结果显示,各实验组小鼠脾细胞CTL杀伤活性均高于PBS组(P<0.05);rAd/C3d3-sVP1组高于pcDNA3/C3d3-sVP1组和VP1蛋白组(P <0.05)。
2.7 血中病毒滴度 与PBS对照组(5.67±0.15)相比,其余各组小鼠血中病毒滴度显著降低(P<0.01),且 VP1 蛋白组(2.27 ±0.21)明显低于 pcDNA3/C3d3-sVP1 组(2.98 ±0.66)和 rAd/C3d3-sVP1组(2.93±0.14),提示VP1蛋白能显著降低受感染小鼠血中的病毒含量。
2.8 小鼠保护率 小鼠在接种CVB3第3天起开始发病,第4天开始死亡。各组21天生存率分别为:pcDNA3/C3d3-sVP1 组 33.33%,rAd/C3d3-sVP1组27.78%,VP1组66.67%,PBS组无生存。根据各组小鼠存活的情况(图4),用Kaplan-Meier生存分析表明,3种疫苗都能明显提高对病毒攻击后小鼠的保护率,但VP1蛋白组生存状况优于pcDNA3/C3d3-sVP1组和Ad/C3d3-sVP1组(P<0.05)。
3 讨论
C3d是补体C3不能水解的最小片段,能与B细胞等抗原提呈细胞细胞膜受体结合,促进通过MHCⅡ类途径的抗原提呈。本室前期将3个片段的C3d(C3d3)与带有IL-2信号肽的CVB3VP1基因拼接,构建靶向B细胞的分泌型核酸疫苗pcDNA3/C3d3-sVP1。其后,又利用AdEasy系统,构建包装了重组腺病毒rAd/C3d3-sVP1。本研究将这二种疫苗进行比较,发现末次免疫后rAd/C3d3-sVP1能诱导出较强的特异性IgG抗体和中和抗体以及较高水平的脾脏淋巴细胞特异性CTL杀伤活性,明显高于质粒载体疫苗pcDNA3/C3d3-sVP1组,但致死量病毒攻击后小鼠生存率却没有显著提高。推测与腺病毒疫苗主要倾向于CD8+T细胞介导的免疫应答有关[4]。当致死量病毒攻击小鼠后,未被中和的病毒感染心肌细胞后,较强的CTL杀伤活性会加重心肌损伤,导致 rAd/C3d3-sVP1组小鼠生存率降低。Schirmbeck等[5]曾将乙肝病毒s基因构建到不同载体的疫苗免疫B淋巴细胞缺陷小鼠,发现腺病毒疫苗较核酸疫苗可以诱导更高更持久的CD8+T细胞免疫反应;Singh等[6]的研究也得出相同结论。T细胞分化的倾向对小鼠病毒性心肌炎发病起到很重要的作用,Henke等[7]研究发现用CVB3感染CD8+T细胞缺陷小鼠可以增加小鼠存活率,减少晚期严重病毒性心肌炎的发生,而感染CD4+T细胞缺陷小鼠虽发病时间推迟,但死亡率增加。故选择合适的疫苗增强免疫后的体液免疫水平是CVB3疫苗的目标。
亚单位疫苗是利用蛋白质等抗原来诱导免疫应答的,不含感染性组分,无须灭活,也无致病性。本研究将原核表达质粒pET-his/VP1转入大肠杆菌中表达CVB3 VP1蛋白,纯化后免疫小鼠,结果显示相对于另二种疫苗,VP1蛋白可诱导机体产生更高水平的特异性IgG抗体和中和抗体,显著降低CVB3感染后小鼠血中病毒滴度,提高动物存活率和存活时间;提示亚单位疫苗VP1蛋白可诱导出较强的体液免疫,而在保护小鼠免受致死量病毒的攻击时体液免疫可能发挥更重要作用。最近一些研究显示[8],通过抑制Th1类细胞增殖及其细胞因子的表达,增强了体液免疫应答,可明显减轻CVB3感染小鼠的心肌炎症,增加存活率。而Cihakova等[9]的研究从另一方面也得到类似的结论,通过敲除IL-4和IL-13基因的小鼠,减少了Th2类细胞因子产生,可导致效应T细胞活化减少,加重CVB3诱导的病毒性心肌炎。
本研究中发现三种基因工程疫苗虽然均能不同程度提高小鼠的细胞免疫和体液免疫功能,一定程度上保护免疫小鼠免受致死量CVB3攻击,但VP1蛋白亚单位疫苗明显优于靶向基因疫苗,为进一步研制高效预防CVB3感染的疫苗奠定了实验基础。
1 赵 娜,韩小艳,王晓凌et al.C3d对分泌型柯萨奇病毒 B组3型VP1 DNA疫苗的免疫增强作用[J].中华医学杂志,2007;87(36):2561-2563.
2 李 嘉,李 剑,羡 鲜et al.CVB3腺病毒载体Ad/sVP1 C3d3的构建及免疫效果研究[J].细胞与分子免疫学杂志,2011;27(1):47-50.
3 李 伟,蓝佳明,李 剑 et al.柯萨奇病毒 B组3型 VP1蛋白的原核表达及免疫效果研究[J].中国免疫学杂志,2009;25(4):291-298.
4 Casimiro D R,Chen L,Fu T M et al.Comparative immunogenicity of rhesus monkeys of DNA plasmid,recombinant vaccinia virus,and replication-defective adenovirus vectors expressing a human immunodeficiency virus type 1 gag gene[J].J Virol,2003;77(11):6305-6313.
5 Schirmbeck R,Reimann J,Kochanek S et al.The immunogenicity of adenovirus vectors limits the multispecificity of CD8 T-cell responses to vector-encoded transgenic antigens[J].Mol Ther,2008;16(9):1609-1616.
6 Singh S,Toro H,Tang D C et al.Non-replicating adenovirus vectors expressing avian influenza virus hemagglutinin and nucleocapsid proteins induce chicken specific effector,memory and effector memory CD8(+)T lymphocytes[J].Virology,2010;405(1):62-69.
7 Henke A,Huber S,Stelzner A et al.The role of CD8 T lymphocytes in coxsackievirus B3-induced myocarditis[J].J Virol,1995;69(11):6720-6728.
8 Yue Y,Gui J,Ai W et al.Direct gene transfer with IP-10 mutant ameliorites mouse CVB3-induced myocarditis by blunting Th1 immune responses[J].PLoSOne,2011;6(3):e18186.
9 Cihakova D,Barin J G,Afanasyeva M et al.Interleukin-13 protects against experimental autoimmune myocarditis by regulating macrophage differentiation[J].AJP,2008;172(5):1195-1208.
