Th17细胞在Graves’病中的变化及意义①
2012-07-30张玉娜周喜娜朱铁年赵瑞景河北医科大学免疫学教研室石家庄050017
张玉娜 周喜娜 安 杰 朱铁年 赵瑞景 (河北医科大学免疫学教研室,石家庄050017)
Graves’病(Graves’disease,GD)是一种以甲状腺功能亢进和甲状腺弥漫性增大为特征,并导致全身多系统高代谢表现的器官特异性自身免疫性疾病[1]。流行病学调查显示,其在普通人群中患病率约为1%,并有逐年增加的趋势,女性多见。虽然公认其发生与自身免疫有关,但迄今为止GD确切的发病机制仍未完全阐明。本研究通过测定GD患者外周血单个核细胞(Peripheral blood mononuclear cells,PBMC)接受抗CD3和抗 CD28抗体刺激后其中CD4+IL-17+T(Th17)细胞的数量、培养上清中IL-17 的水平、PBMC 中ROR-γt、IFN-γ 和IL-4 mRNA 的表达,以及甲状腺组织中IL-17+细胞的分布情况,旨在探讨Th17细胞在中国人GD发病中的作用。
1 材料与方法
1.1 材料
1.1.1 研究对象 来自于2010年4月至2011年3月在白求恩国际和平医院内分泌科门诊新确诊未经任何治疗的GD患者30例。其中男8例,女22例,年龄22~45岁,平均33.6岁,病程1周~5年;免疫组化标本来自具有手术指征的6例GD患者手术切除的甲状腺组织和3例创伤死亡的正常甲状腺组织。Graves’病诊断标准参照《中国甲状腺疾病诊治指南》(中华医学会内分泌学会,2008年)。排除其他原因引起的甲状腺功能亢进及其他自身免疫性疾病。30例健康对照者均来自白求恩国际和平医院健康体检的无血缘关系、无甲状腺疾病家族史的人群,其中男10例,女20例,年龄25~50岁,平均36.1岁。疾病组和对照组在性别、年龄分布上无统计学差异。全部研究对象均签定知情同意书。该研究已经过白求恩国际和平医院伦理委员会批准。
1.1.2 主要试剂 人淋巴细胞分离液购自北京索莱宝科技有限公司;抗人CD4-FITC购自美国Beckman Coulter公司;抗人CD3及CD28抗体、抗人IL-17-PE单克隆抗体、人 IL-17 ELISA试剂盒购自eBioscience公司;兔抗人 IL-17单克隆抗体购自Santa Cruz公司;逆转录及Real-time PCR试剂盒购自大连宝生物工程有限公司;二步法免疫组化检测试剂购自北京中杉金桥公司。
1.2 方法
1.2.1 甲状腺功能检测 空腹采集2 ml静脉血,室温静置1小时后,1 000 r/min离心5分钟,留取血清。应用电化学发光法测定血清中促甲状腺激素(TSH)、游离三碘甲腺原氨酸(FT3)、游离甲状腺激素(FT4)、甲状腺球蛋白抗体(TgAb)和甲状腺过氧化酶抗体(TPOAb)的水平。
1.2.2 外周血中Th17细胞数量检测 空腹采集肝素抗凝外周静脉血5 ml,迅速分离PBMC,加入抗人CD3 mAb、抗人CD28 mAb(终浓度均为1μg/ml)后放入5%CO2饱和湿度培养箱培养24小时,取2×105个PBMC加入抗人CD4-FITC,室温避光孵育20分钟后,破膜后加入IL-17-PE抗体,再次室温避光孵育20分钟后,1 500 r/min离心5分钟,弃上清,细胞沉淀用500μl PBS缓冲液重悬混匀,上流式细胞仪(美国Beckman Coulter公司)检测,数据采用CellQuest软件进行分析。
1.2.3 ELISA检测PBMC培养上清中IL-17的水平 室温平衡反应试剂30分钟后,每孔加入100μl样品稀释液,标准品孔加入IL-17标准品进行系列稀释,样品孔中加入100μl培养上清,室温避光孵育1小时后,每孔加入50μl Biotin-抗IL-17抗体,室温避光孵育2小时,洗涤3次,所有孔中均加入Streptavidin-HRP,18~25℃室温避光孵育1小时,弃上清,洗涤3次后,加入TMB底物溶液,室温避光孵育5分钟后终止反应,于450nm测定OD值并计算IL-17含量。
1.2.4 PBMC 中 ROR-γt、IFN-γ、IL-4 mRNA 的表达收集经抗CD3和抗CD28单抗刺激培养24小时的PBMC,严格按照试剂说明提取细胞总RNA,反转录为cDNA,加入25μl Real-time PCR反应体系中,检测 ROR-γt、IFN-γ、IL-4 mRNA 的相对表达量,人GAPDH作为管家基因。采用Primer Express3.0软件设计引物序列如下:人ROR-γt:上游引物:5'-CCGATGTGGACTTCGTTTTGA-3';下游引物:5'-CGGTGTGCTGCGGAAACT-3'。人 IFN-γ:上游引物:5'-GAATGTCCAACGCAAAGCAA-3';下游引物:5'-CGACCTCGAAACAGCATCTG-3'。人 IL-4:上游引物:5'-TGTGCTCCGGCAGTTCTACA-3';下游引物:5'-GTCGAGCCGTTTCAGGAATC-3'。扩增条件:预变性95℃ 30秒,然后变性95℃ 5秒,退火延伸60℃30秒,共45个循环。反应结束后根据扩增曲线和溶解曲线判断反应质量,用2-△△Ct法比较GD患者组和正常对照组间 ROR-γt、IFN-γ、IL-4 mRNA 表达水平的差异。
1.2.5 免疫组化染色检测甲状腺组织中IL-17+细胞的分布 将石蜡包埋的甲状腺组织切片,脱蜡至水,0.1 mol/L 枸橼酸(pH6.0)高温修复抗原 5 分钟,冷却至室温,10%山羊血清37℃封闭1小时后,弃血清,滴加10%山羊血清稀释的抗人IL-17Ab(1∶100),湿盒内4℃冰箱过夜,洗涤3次,滴加二抗,湿盒内37℃孵育30分钟,洗涤,DAB显色5~10分钟,自来水终止显色,复染,封片,显微镜观察并拍照。
1.3 统计学处理 采用SPSS13.0统计软件分析。计量资料以±s表示,对呈正态分布、方差齐的数据,两组间差异用两样本均数的t检验进行比较。不呈正态分布或方差不齐的数据采用Kruskal-Wallis检验和Mann-Whitney U检验。两组间采用双变量相关分析进行相关性检验,P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺功能 收集的30例初发GD组患者血清中TSH浓度降低,甲状腺激素FT3、FT4和自身抗体TgAb、TPOAb水平升高,符合GD的诊断标准(表1)。
2.2 PBMC中Th17细胞的数量 与正常对照组(11.77 ±4.18)% 比较,初发 GD 组(20.59 ±4.63)%外周血PBMC在经抗CD3和抗CD28刺激培养24小时后,其中Th17细胞占CD4+T细胞的比例明显升高(P <0.01,图1)。
2.3 PBMC培养上清中IL-17水平 将来自两组的PBMC经抗CD3和抗CD28刺激培养24小时后,应用ELISA检测其培养上清中IL-17的水平,初发GD组培养上清中 IL-17 的含量为(83.22 ±34.28)pg/ml,明显高于正常对照组(19.74 ±5.99)pg/ml(P <0.01,图2)。
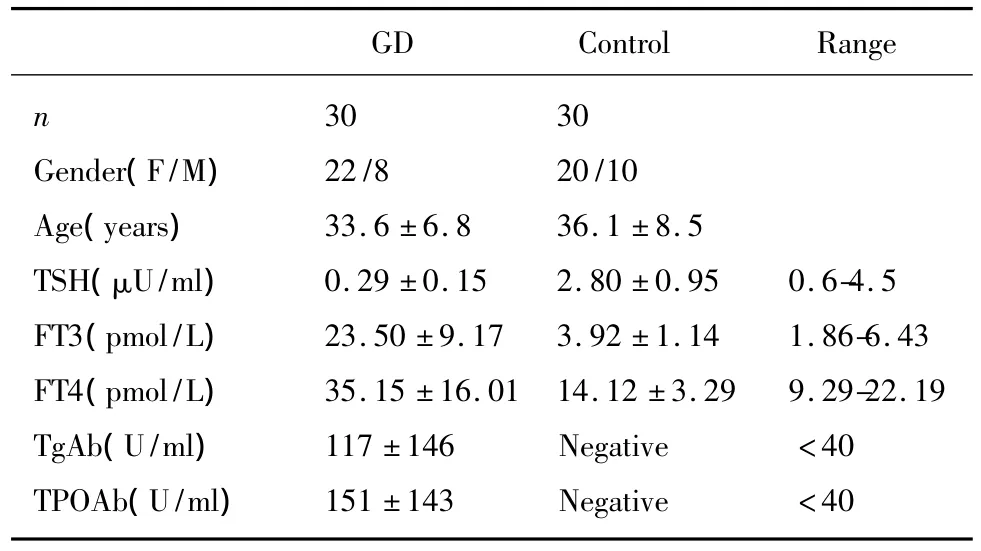
表1 初发GD组和正常对照组甲状腺功能Tab.1 Thyroid function of GD and health control groups
2.4 PBMC 中 ROR-γt、IFN-γ、IL-4 mRNA 的表达初发GD组PBMC在经抗CD3和抗CD28抗体刺激活化后,ROR-γt mRNA 的表达水平(1.67 ±0.98)与正常对照组(0.92±0.18)比较明显增高(P<0.05)。而 IFN-γ mRNA(0.31 ±0.07)、IL-4 mRNA(2.53 ±0.70)均较正常对照组(分别为 0.70 ±0.20和 7.11 ±1.41)明显降低(P <0.01,表 2)。
2.5 初发GD组患者PBMC中Th17细胞百分率与ROR-γt、IFN-γ 和 IL-4 mRNA 表达的相关性分析初发GD组患者,Th17细胞百分率与ROR-γt mRNA表达量呈正相关(r=0.5047,P=0.01);与 IFN-γ mRNA 表达量呈负相关(r=-0.5085,P <0.01);与IL-4 mRNA表达量呈负相关(r=-0.5372,P<0.01),见图3。

图1 外周血中CD4+IL-17+T(Th17)细胞占CD4+T细胞的比例Fig.1 Comparison of CD4+IL-17+T(Th17)proportion between two groups

图2 初发GD组和正常对照组PBMC培养上清中IL-17水平Fig.2 The level of IL-17 in PBMC culture supernatant from health control and GD patients
表2 初发GD组和正常对照组 PBMC中 ROR-γt、IFN-γ、IL-4 mRNA表达水平比较(x±s)Tab.2 Comparison of the ROR-γt,IFN-γ,IL-4 mRNA expression in GD and health control groups(±s)
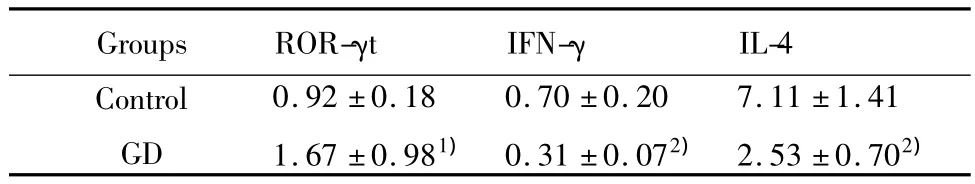
表2 初发GD组和正常对照组 PBMC中 ROR-γt、IFN-γ、IL-4 mRNA表达水平比较(x±s)Tab.2 Comparison of the ROR-γt,IFN-γ,IL-4 mRNA expression in GD and health control groups(±s)
Note:1)P <0.05;2)P <0.01 vs control.
IL-4 Control GD Groups ROR-γt IFN-γ 0.92 ±0.18 1.67 ±0.981)0.70 ±0.20 0.31 ±0.072)7.11 ±1.41 2.53 ±0.702)
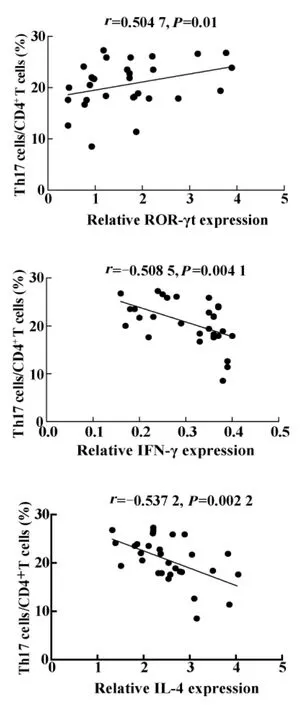
图3 初发GD患者CD4+IL17+T(Th17)细胞百分率与ROR-γt、IFN-γ和 IL-4 mRNA 表达相关性分析Fig.3 Correlation analysis between the CD4+IL17+T(Th17)cells proportion and the expression levels of ROR-γt,IFN-γ and IL-4 mRNA in PBMC from patients with GD
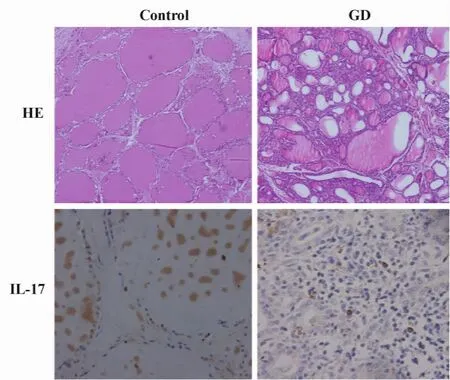
图4 GD组和正常对照组甲状腺组织HE染色及IL-17的表达(HE,×100;IL-17,×400)Fig.4 H&E staining and the expression of IL-17 in thyroid gland from healthy controls and GD patients(HE,×100;IL-17,×400)
2.6 甲状腺组织形态学观察 手术切除的GD组甲状腺组织中,滤泡上皮细胞增生,呈高柱状或立方状,滤泡腔内的胶质减少或消失,滤泡间可见不同程度的淋巴细胞浸润(图4)。免疫组化结果:胞浆中出现棕黄色颗粒者判定为IL-17+细胞。正常对照组未见IL-17+细胞。GD组甲状腺组织滤泡间质内可见散在的IL-17+细胞(图4)。
3 讨论
传统观点认为Th1细胞主要通过分泌IFN-γ等细胞因子介导细胞免疫,Th2细胞则主要通过分泌IL-4等细胞因子介导体液免疫。因为GD主要由自身抗体引起,所以在相当长时间里人们认为GD是由Th2细胞介导的。但随着对GD患者和小鼠GD模型的深入研究,这一概念遇到了挑战。近年来的研究发现,许多病人体内的TSAbs属于IgG1(其产生与Th1亚群相关)[2]。在所有小鼠 GD模型中,Th1和Th2均能引起抗TSHR抗体的产生,而且产生的TSAbs大部分属于与Th1亚群相关的IgG1。小鼠脾细胞在TSHR抗原的刺激下可分泌Th1类细胞因子如IFN-γ。在用不同方法诱导的小鼠GD模型中,Th1和Th2所起的作用不同,如用表达TSHR和MHCⅡ类分子的纤维母细胞或B细胞诱导的模型中,Th2细胞起着重要作用;而在用质粒、腺病毒、或表达TSHR的树突状细胞诱导的模型中,Th1细胞则起着关键作用[3]。上述这些有争议的结果说明GD的发生可能与除Th1和Th2细胞以外的免疫反应有关。
Th17是新近发现主要产生IL-17的另一CD4+T细胞亚群[4,5]。尽管在很长一段时间里 Th1和Th2细胞在许多自身免疫病发生中的作用存在争议,但近年来许多的研究证实,Th17在许多自身免疫病如多发性硬化、实验性自身免疫性脑炎(EAE)、碘诱导的非肥胖糖尿病小鼠自身免疫性甲状腺炎、葡萄膜炎、类风湿性关节炎、重症肌无力和银屑病等(这些自身免疫病在以前均被认为是由Th1细胞介导的)的发生中均发挥重要作用[6,7]。Figueroa-Vega等[8]的研究证实,西班牙桥本氏甲状腺炎病人体内Th17细胞数量明显增加。Horie[9]与其同事最近的研究发现,IL-17+/+和IL-17-/-BALB/c小鼠发生Graves’病甲状腺功能亢进的几率是相同的,而在 NODH2 小鼠,只有 IL-17 小鼠出现Graves’病甲状腺功能亢进,而IL-17-/-NODH2h4小鼠不发生Graves’病甲状腺功能亢进,表明Th17在Graves’病甲状腺功能亢进发生中的作用尚与遗传背景有关[9]。为此本研究探讨了 Th17在中国人GD发生中的作用。
本研究发现,GD病人外周血单个核细胞在抗CD3和抗CD28刺激活化后ROR-γt的表达、分化形成的Th17细胞以及培养上清中IL-17的水平均较正常人明显增加。ROR-γt作为Th17细胞的特异性核转录因子,对Th17细胞的分化、发育和功能起决定性作用[10]。Th17细胞主要通过产生 IL-17(IL-17A)发挥生物学作用,IL-17可增强趋化性细胞因子、IL-1、IL-6、TNF-γ、细胞黏附分子和其他炎症因子的表达,促进淋巴细胞向炎症部位迁移[11]。因此,GD病人外周血中产生IL-17的Th17细胞的增加将有助于淋巴细胞向甲状腺组织浸润。
淋巴细胞浸润是自身免疫性甲状腺疾病的重要特征,我们对GD病人甲状腺组织的形态学观察也证实,GD病人甲状腺组织中有散在的淋巴细胞浸润。免疫组化结果显示,在浸润的淋巴细胞中可见散在的IL-17+细胞(Th17)。
Th1细胞主要通过分泌IFN-γ等细胞因子介导细胞免疫,Th2细胞则主要通过分泌IL-4等细胞因子介导体液免疫。IFN-γ能够促进自身的表达以及Th1细胞的分化,并抑制Th17细胞的分化。类似的,IL-4能够促进自身表达以及Th2细胞的分化,且抑制Th17细胞的分化。但IL-17却不能直接促进Th17细胞分化,也不能抑制Th1细胞、Th2细胞的分化发育。由于 IFN-γ、IL-4抑制 Th17细胞的分化,Th1细胞、Th2细胞可以在一定程度上调节Th17细胞的发育[12]。本研究通过应用qRT-PCR方法,检测 PBMC 中 ROR-γt、IFN-γ 及 IL-4 mRNA 的表达量,进一步探讨CD4+T细胞亚群在Graves'病发病机制中的作用。结果发现初发Graves'病患者组ROR-γt mRNA的表达量显著增高,而IFN-γmRNA与IL-4 mRNA的表达量均明显低于正常对照组。相关性分析显示,初发GD患者组Th17细胞百分率与PBMC中ROR-γt mRNA表达量呈正相关,与PBMC中IFN-γ、IL-4 mRNA表达量均呈负相关。这表明PBMC中的CD4+T在接受刺激活化后核转录因子ROR-γt表达增多诱导其向Th17细胞分化发育,同时也证明IFN-γ、IL-4细胞因子抑制Th17细胞的分化,或者说Th1细胞、Th2细胞拮抗Th17细胞的分化。由于机体内CD4+T细胞各亚群的发育、分化及调节之间存在着错综复杂的关系,与之相关的细胞因子网络关系亦尚未完全明确。我们以前的研究曾发现,GD病人PBMC中与CD4+CD25+调节性T细胞发育及功能相关的Foxp3和TGF-γmRNA表达明显降低[13],提示调节性T细胞的功能缺陷在GD的发生中可能也起一定的作用,因此,有关GD发生的详细免疫学作用机制尚需进一步深入研究。
1 Jacobson E M,Tomer Y.The genetic basis of thyroid autoimmunity[J].Thyroid,2007;17(10):949-961.
2 Latrofa F,Chazenbalk G D,Pichurin P et al.Affinity-enrichment of thyrotropin receptor autoantibodies from Graves’patients and normal individuals provides insight into their properties and possible origin from natural antibodies[J].J Clin Endocrinol Metab,2004;89(9):4734-4745.
3 McLachlan SM,Nagayama Y,Rapoport B.Insight into Graves’hyperthyroidism from animal models[J].Endocr Rev,2003;26(6):800-832.
4 Harrington L E,Hatton R D,Mangan PR et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005;6(11):1123-1132.
5 Park H,Li Z,Yang X O et al.A distinct lineage of CD4 Tcells regulates tissue inflammation by producing interleukin 17[J].Nat Immunol,2005;6(6):1133-1141.
6 Komiyama Y,Nakae S,Matsuki T et al.IL-17 plays an important role in the development of experimental autoimmune encephalomyelitis[J].J Immuno,2006;177(1):566-573.
7 Horie I,Abiru N,Nagayama Y et al.T helper type 17 immune response plays an indispensable role for development of experimental autoimmune thyroiditis in NOD-H2h4 mice [J].Endocrinology,2009;150(11):5135-5142.
8 Figueroa-Vega N,Alfonso-Perez M,Benedicto I et al.Increased circulating pro-inflammatory cytokines and Th17 lymphocytes in Hashimoto’s thyroiditis[J].J Clin Endocrinol Metab,2010;95(2):953-962.
9 Horie I,Abiru N,Saitoh O et al.Distinct role of T helper type 17 immune response for Graves’hyperthyroidism in mice with different genetic backgrounds[J].Autoimmunity,2011;44(2):159-165.
10 IvanovⅡ,McKenzie B S,Zhou L et al.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+T cells[J].Immunol,2006;126(6):1121-1133.
11 Kom T,Oukka M,Kuchroo V et al.Th17 cells:effector T cells with inflammatory properties[J].Sem in Immunol,2007;19(6):362-371.
12 Harrington L E,Mangan P R,Weaver CT.Expanding the effector CD4 T-cell repertoire:the Th17 lineage[J].Curr Opin Immunol,2006;18(3):349-356
13 高书涛,朱铁年,张玉娜 et al.CD4+CD25+调节性T细胞在自身免疫性甲状腺疾病中数量和功能变化[J].中国免疫学杂志,2011;27(1):92-96.
