调节性T细胞及其分泌的细胞因子在再生障碍性贫血中的意义①
2012-07-30黄国清刘秋爽程永红郭强忠李文郎
黄国清 刘秋爽 程永红 黎 阳 郭 敏 郭强忠 金 鑫 李文郎
(深圳市宝安区观澜人民医院,深圳518110)
获得性再生障碍性贫血 (Acquired Aplastic Anema,AA.简称:再障)是一种较为少见的血液系统疾病,约有一半的患者为三十岁以下的青年,在西方发病率约为每百万分之二,在亚洲的发病率约为西方的2~3倍[1-3]。再生障碍性贫血是由多种原因引起的造血干细胞数量下降和功能的异常,导致骨髓衰竭而引起的全血细胞减少的一种异质性疾病。其发病机制通常认为与造血干细胞的损伤、骨髓微环境的异常以及免疫功能紊乱。而免疫异常是近10年来有关再障病因和发病机制研究中最活跃的领域,本研究的目的在于通过研究再障患者外周血辅助性 T细胞(Th,相当于 CD4+T),细胞毒性T细胞(Tc,相当于 CD8+T),CD4+/CD8+,NK 细胞,NKT细胞,调节性T细胞(regulatory T cell,Treg)和Treg细胞相关的细胞因子含量变化,进一步探讨再障的发病机制,为再障以及自身免疫疾病的细胞靶向治疗和免疫治疗提供理论基础及新思路。
1 材料与方法
1.1 临床资料 收集2010年3月至2012年2月经深圳市观澜人民医院、湛江中心人民医院、广东省人民医院诊治的初发重型再障患者20例,其中男性11例,女性9例,年龄16~31岁,平均年龄21.3岁,病例诊断符合2007年修订的血液病诊断及疗效标准[6];收集再障经免疫治疗及输血治疗后骨髓象、血象及网织红细胞比例提示造血恢复的患者21例,男性9例,女性12例,年龄20~35岁,平均年龄22.3岁;同时收集20例正常志愿者外周血标本,男性9例,女性 11例,年龄 20~27岁,平均年龄20.6 岁。
1.2 主要试剂 流式细胞检测用抗体和红细胞裂解液均为美国BD公司产品;胎牛血清购自杭州四季青生物工程材料有限公司;淋巴细胞分离液购自上海华精生物高科技有限公司;分选细胞用磁珠购自德国美天旎生物技术有限公司。
1.3 方法
1.3.1 流式细胞检测T细胞亚群 取待检静脉全血100μl,加入上样管中,采用双色和三色标记法根据检测项目的不同分别加入以下抗体组合:CD3 PerCP-Cy5.5、CD4 FITC;CD3PerCP-Cy5.5、CD8 PE;CD3 FITC、CD16+56 PE;CD4 FITC、CD25 APC、CD127 PE;CD3 FITC、CD19 PE,震荡混匀,常温孵育20分钟,加红细胞裂解液850μl裂解10分钟,1 500 r/min离心7分钟,PBS冲洗一次,加 200μl PBS悬浮细胞,上机检测,采用FACS Diva软件对数据结果进行分析。
1.3.2 免疫磁珠法分选Treg细胞 取再生障碍性贫血患者,正常志愿者的静脉全血4~8 ml,利用细胞分离液Focil分离外周血单个核细胞(PMNC),按照使用说明书进行免疫磁珠分选CD4+CD25+Treg细胞。
1.3.3 酶联免疫吸附法检测细胞因子 将分选好的细胞以1×106cell L-1接种于24孔板,每组设5个复孔,并加PHA(5 mg/ml)刺激培养,置于5%的CO2培养箱中培养,于24小时、48小时后收集各组上清,用酶联免疫吸附试验进行IL-10、IL-35、TGF-β的检测。
1.4 统计学处理 采用SPSS17.0软件包进行统计分析各组 CD4+、CD8+、NK、NKT、Treg 的数值,所有正态分布数据均以x±s表示,组间比较单因素方差分析(One-way ANOVA)比较,以P<0.05为有显著的统计学差异。
2 结果
2.1 初发再障组、治疗后造血恢复组及正常组T细胞亚群检测 利用流式细胞仪检测初发再障组,治疗后造血功能恢复组,正常组中CD4+、CD8+、NK、NKT、Treg细胞比例,结果显示,其中 CD4+、Treg的表达在初发再障组比恢复组及正常组均低(P<0.05),而CD8+细胞的比例比其他二组均明显增高(P<0.05),NK、NKT细胞比例无明显变化,结果无统计学差异(P>0.05)详见表1,各组流式图见图1。
表1 各组CD4+、CD8+、NK、NKT、Treg细胞比例(%±s)Tab.1 The ratio expression of CD4+,CD8+,NK,NKT,Treg cells(%±s)

表1 各组CD4+、CD8+、NK、NKT、Treg细胞比例(%±s)Tab.1 The ratio expression of CD4+,CD8+,NK,NKT,Treg cells(%±s)
Note:1)P <0.05 vs control.
NK NKT Treg Aplastic anemia group 26.01 ±3.01) 49.35 ±5.31) 15.56 ±3.65 4.37 ±0.09 3.16 ±1.021)Groups CD4+ CD8+9.96 ±5.12 5.12 ±0.12 6.08 ±1.47 Hematopoietic recovery group 35.46 ±2.96 32.03 ±4.32 18.12 ±2.78 4.82 ±1.83 5.86 ±1.51 Normal control group 39.63 ±7.62 28.54 ±7.54 1

图1 再障组患者T细胞亚群细胞流式图Fig.1 The proportion of CD4+,CD8+,NK,NKT,Treg cells by FACS
表2 各组IL-10、IL-35、TGF-β的表达水平(ng/L±s)Tab.2 The ratio expression of IL-10,IL-35,TGF-β(ng/L±s)
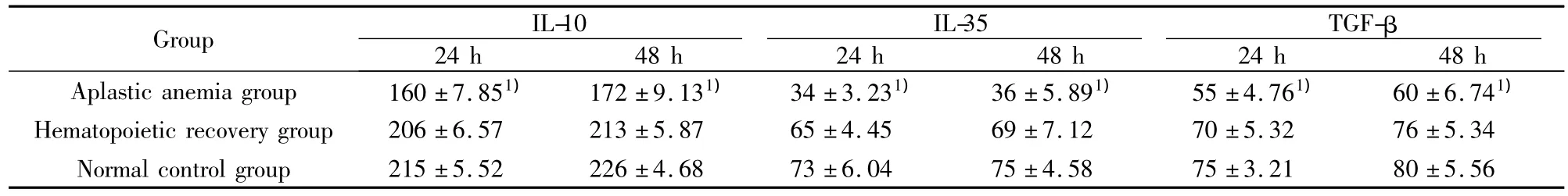
表2 各组IL-10、IL-35、TGF-β的表达水平(ng/L±s)Tab.2 The ratio expression of IL-10,IL-35,TGF-β(ng/L±s)
Note:1)P <0.05 vs control.
24 h 48 h 24 h 48 h 24 h 48 h Aplastic anemia group 160 ±7.851) 172 ±9.131) 34 ±3.231) 36 ±5.891) 55 ±4.761) 60 ±6.741)Group IL-10 IL-35 TGF-β 04 75 ±4.58 75 ±3.21 80 ±5.56 Hematopoietic recovery group 206 ±6.57 213 ±5.87 65 ±4.45 69 ±7.12 70 ±5.32 76 ±5.34 Normal control group 215 ±5.52 226 ±4.68 73 ±6.
2.2 Treg细胞分泌的相关细胞因子的表达水平分离培养Treg细胞24、48小时后,收获初发再障组、再障造血恢复组和正常组的细胞上清液,用酶联免疫吸附试验(ELISA)检测 IL-10、IL-35、TGF-β 的表达,结果显示:初发再障组的上清液中,IL-10、IL-35、TGF-β的表达量比恢复组及正常组表达量显著低下(P<0.05)。恢复组与正常组比较无明显差异(P >0.05),见表2。
3 讨论
再障的显著特点是骨髓造血细胞衰竭引起的全血细胞减少,患者常常表现出明显的贫血症状,在常规药物治疗无法达到预期结果的情况下,往往需要依靠输注红细胞或者成份血来维持,但其往往也带来很多副作用[1]。过去多年对再障的研究主要是集中两个方面:一是“种子”学说,即造血干细胞的研究,主要集中在造血干细胞的水平;另一方面则是所谓的“土壤”学说,即造血微环境的变化,但究竟谁是主要的病因,两者是否存在相关性目前并没有一个十分确定的结论,这同时也证实了再障发病机制是一个难点[2]。作为一种自身免疫性疾病,其T细胞免疫功能的异常成为近年来研究的热点。
目前的研究已经证实,再障与其它自身免疫性疾病一样存在CD4+T淋巴细胞、CD8+T淋巴细胞、Treg细胞的缺陷及功能异常[3]。我们的第一部分研究结果表明,在再障患者的体内,CD4+T淋巴细胞、Treg细胞的表达水平明显低于恢复组和正常对照组,而这正好与CD4+T淋巴细胞的功能相符合,CD4+T淋巴细胞主要促进免疫细胞的增殖与分化,在细胞分化过程中起到正向的调控作用;而研究结果同时发现,患者体内的CD8+T淋巴细胞却比正常组,和治疗恢复组明显增高,这从一个侧面说明,CD8+T淋巴细胞可能在再障发病机制中扮演着负向的调控作用,因为已有的研究表明,CD8+T淋巴细胞不断对骨髓造血细胞具有直接抑制作用,还激活与异常免疫有关的细胞毒T淋巴细胞,释放γ干扰素(IFN-γ)和肿瘤坏死因子 α(TNF-α)等造血负调控因子[4]。
我们的第二部分研究结果表明,再障患者体内的IL-10、IL-35、TGF-β 均比正常人低,说明再障患者调节性T细胞分泌的细胞因子低,而它们又是Treg细胞主要分泌因子,它们可以直接作用于T细胞和骨髓细胞的应答,从而调控相关免疫。此结果和第一部分的结果具有相关性,说明在再障患者体内确实存在着免疫系统的功能紊乱。但是,它们具体是如何调控的目前还没有一个明确的结论[5]。
当前,再障的发病机制研究已渐集中到免疫学机制研究,研究表明,再生障碍性贫血与众多自身免疫性疾病一样有CD4+T淋巴细胞、CD8+T淋巴细胞、Treg细胞的异常[6]。而T淋巴细胞是细胞免疫中的主要效应细胞,研究发现再生障碍性贫血患者不仅存在T细胞数量异常,也存在功能和表型改变[7],其外周血T细胞亚群失衡,辅助性 T细胞减少,抑制性 T细胞增多,CD4+/CD8+降低或倒置等[8]。因此,对再生障碍性贫血免疫学机制研究对于了解再障患者中的免疫细胞功能以及和其他免疫细胞之间的关系,以及为未来开展靶向免疫治疗均具有非常重要的意义。
1 Kaufman D W,Kelly JP,Levy M et al.The drug etiology of agranulocytosis and aplastic anemia[J].Blood,1991;36:1102-1108.
2 Hamerschlak N,Maluf E,Pasquini R et al.Incidence of aplastic anemia and agranulocytosis in Latin America:the LATIN study[J].[J]Sao Paulo Medical Journal,2005;123(3):101-104.
3 Young N S,Calado R T,Scheinberg P.Current concepts in the pathophysiology and treatment of aplastic anemia[J].Blood,2006;108(8):2509-2519.
4 邵宗鸿,袁 烨.再生障碍性贫血免疫发病机制及免疫治疗[J].中国实用内科杂志,2006;26(2):252-255.
5 Liu W,Putnam A L,Xu-Yu Z et al.CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+T reg cells[J].JExp Med,2006;203(7):1701-1711.
6 张之南,沈 悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2007:20-163.
7 童 勇,马 莉,曾小菁.再生障碍性贫血患者Th及NKT细胞IFN-γ和 IL-4的表达及意义[J].中国免疫学杂志,2011;27(9):840-843.
8 Vignali D A,Collison L W,Workman C.How regulatory T cells work[J].Nature Review,2008;8(7):523-532.
