重组金黄色葡萄球菌肠毒素C3生物学活性的初步研究①
2012-07-30李先平中南大学湘雅二医院检验科长沙410011
李先平 王 敏 武 婷 梅 城 曹 虹 (中南大学湘雅二医院检验科,长沙410011)
金黄色葡萄球菌肠毒素C(SEC)是金黄色葡萄球菌产生的一种肠毒素,作为超抗原,它可多克隆活化T细胞,诱发强烈的细胞免疫应答[1]。我国开发的已用于肿瘤临床治疗的金葡液制剂,其有效成分被证明为 SEC[2]。其中 SEC 又分为 SEC1、SEC2、SEC3 3个亚型[3]。SEC 3个亚型的成熟蛋白氨基酸序列高度同源,在239个氨基酸中,SEC1与SEC2相似度为 97.2%,而 SEC1与 SEC3的相似度为97.1%[4]。3个亚型间序列的关联决定了各亚型特异性抗原决定簇的关联,尤其是其高度保守的羧基端决定了SEC的生物学活性和亚型间免疫交叉反应的抗原决定簇。本课题组已将SEC3基因成功克隆到表达质粒内并实现了可溶性表达[5],为进一步研究其生物学活性,本研究从rSEC3、刺激人外周血单个核细胞增殖情况和抑制肿瘤细胞生长这两方面进行了观察,现将结果报告如下。
1 材料与方法
1.1 主要试剂 pET-32a(+)-SEC3复合DNA质粒[5]、E.coli BL21菌株均为本课题组保存。PCR 试剂购自北京天根生化科技有限公司,PCR扩增引物(上游引物CCCT 3',下游引物TTGTTGT 3')的合成和基因测序由上海生工生物技术服务有限公司完成。150 bp DNA Ladder Marker购自大连宝生物工程公司;预染蛋白质分子量标准(P7708)、IPTG购自 New England Biolabs公司。His-bind Ni2+亲和层析柱购自美国Novogen公司。SEC单克隆抗体购自北京博迈世纪生物技术有限公司。羊抗鼠IgG购于美国PIERCE公司。人淋巴细胞分离液购自天津灏洋生物制品公司。RPMI1640细胞培养基,牛血清白蛋白(BSA)购自Gibco公司。四甲基偶氮噻唑蓝(MTT),植物血凝素(PHA)为美国Sigma公司产品。Hela细胞、KYSE细胞均由本院肿瘤中心提供。
1.2 主要仪器 JY 92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司);PCR扩增仪为Gene-Amp PCR system 9700 Applied Biosystems;电泳仪为德国Biometra公司产品;Fluor Chem FC2凝胶数字图像分析系统为Cell Biosciences公司产品;酶标仪为Thermo Scientific Multiskan Spectrum全波长酶标仪。
1.3 rSEC3阳性菌的鉴定 将转化有 pET-32a(+)-SEC3重组质粒的大肠杆菌BL21接种于血平板,于37℃分纯培养24小时之后挑取血平板上的单个菌落进行菌落PCR鉴定。PCR产物用1.5%琼脂糖凝胶电泳进行分析。
1.4 rSEC3蛋白的诱导表达 将阳性菌接种于LB液体培养基中,37℃培养至吸光度值(OD600)为0.6时,取出1 ml菌液并收集菌体,作为诱导表达前的对照。其余菌液中加IPTG至终浓度为1 mmol/L,继续诱导培养4小时,4℃离心收集细菌沉淀。将细菌沉淀悬浮于缓冲液A(50 mmol/L Tris-HCl,pH 8.0)中,经反复冻融及超声破碎使细菌裂解,4℃离心收集上清与细菌沉淀,沉淀再溶于含8 mol/L尿素的缓冲液A中,进行SDS-PAGE电泳。
1.5 SDS-PAGE电泳鉴定rSEC3蛋白的分子量配制12%的分离胶,5%的浓缩胶。取一定体积的菌液,加入等体积的2×SDS上样缓冲液,煮沸3~4分钟。样品冷却后取20μl上样。电泳:起始电压90 V,待样品在浓缩胶下缘浓缩成一条线后,加大电压至140 V,等溴酚蓝达到凝胶底部即可停止电泳。撬开两层玻璃板,剥离凝胶至考马斯亮蓝染色液中,染色30分钟~1小时。脱色至背景干净,条带清晰,凝胶成像仪拍照。
1.6 重组SEC3蛋白的纯化和鉴定 取超声裂解的上清液上样至预平衡的Ni2+亲和层析柱内,用平衡缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH7.9)平衡至基线,洗脱缓冲液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,20 ~300 mmol/L 咪唑,pH 7.9)梯度洗脱,收集最后的洗脱液即为纯化后的rSEC3蛋白。12%SDS-PAGE电泳分析样品。SDSPAGE后,电转印至 PVDF膜上,经过5%BSA封闭,PBST漂洗后,加入含抗 SEC抗体(1∶1 000稀释)的 PBS,37℃反应1小时,PBST漂洗,加入含HRP标记的羊抗鼠IgG(1∶5 000稀释)的PBS,温育1小时,PBST洗膜后,增强型化学发光(ECL)自显影,洗片显带。
1.7 人外周血单个核细胞(PBMC)的分离 取健康成人外周血,加入抗凝剂后与等量Hanks液充分混匀,加入含淋巴细胞分离液的试管中(稀释液与淋巴细胞分离液的比例为2∶1),水平离心2 000 r/min×20分钟。收集白膜层,用无血清的RPMI-1640培养基洗涤3次,每次2 000 r/min离心10分钟,最后用完全培养基配成3×106ml-1的细胞悬液。
1.8 rSEC3对PBMC的促增殖作用 将PBMC悬液加入96孔细胞培养板中,每孔1.5×105个细胞。加入终浓度分别为 0.1、0.5、1、5、10、50、100 μg/ml的rSEC3溶液(用含10%小牛血清的RPMI1640培养基稀释)。每个浓度设3个平行孔。同时设终浓度为100μg/ml PHA的阳性对照及等体积培养基的空白对照。置37℃、5%CO2培养箱中孵育,每天取出震荡混匀2次。培养至第68小时,每孔加入5 mg/ml的MTT 20μl,混匀后继续置培养箱中孵育4小时。取出后弃上清,每孔加200μl二甲亚砜(DMSO)溶解其中的蓝紫色颗粒,震荡混匀,置酶标仪上测定吸光值。测定波长570 nm,参考波长630 nm。
1.9 rSEC3的体外抑瘤活性 以PBMC为效应细胞,Hela细胞和 KYSE细胞分别为靶细胞,测定rSEC3刺激效应细胞后对靶细胞的杀伤作用。设调零孔(仅含培养基)、靶细胞对照孔(含培养基和靶细胞)、效应细胞本底释放孔[含空白孔(含培养基、效应细胞)、阳性对照孔(含培养基、效应细胞、PHA)和实验孔(含培养基、效应细胞、3个不同浓度的rSEC3)]以及实验孔(在上述效应细胞本底释放孔中分别对应加入靶细胞),每种设3个平行孔。其中PHA终浓度为100μg/ml,rSEC3终浓度分别为0.5、1、5μg/ml。效应细胞本底释放孔中细胞数为1.5 ×105/孔,实验孔中每孔含 1.5 ×105个效应细胞和1×104个靶细胞。37℃、5%CO2条件下培养44小时。吸收值测定方法同MTT法。按下式计算抑瘤率:抑瘤率(%)=100-[(实验孔-效应细胞本底释放孔)/靶细胞对照孔]×100%。
1.10 统计学分析 采用SPSS17.0统计学软件分析实验数据。促淋巴细胞增殖实验OD值、肿瘤细胞生长抑制实验抑瘤率以x±s表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 重组菌的鉴定 观察血平板上菌落生长情况,用SEC3的引物对随机挑取的单个菌落进行菌落PCR鉴定,电泳结果显示有720 bp大小的条带(图1)。证明重组质粒成功转化至宿主菌。
2.2 rSEC3的纯化和鉴定 转化有pET-32a(+)-SEC3重组质粒的宿主菌经IPTG诱导后,超声裂解菌体,上清纯化液经SDS-PAGE分析,结果如图2。从图中可以发现,纯化后上清与纯化前相比非特异性条带明显减少,说明纯化效果好。纯化后上清在相对分子质量约47 kD处出现明显的特异条带,与预期的融合蛋白大小一致。并且目的蛋白存在于超声裂解液的上清中,表明重组SEC3蛋白是以可溶性蛋白的形式表达。
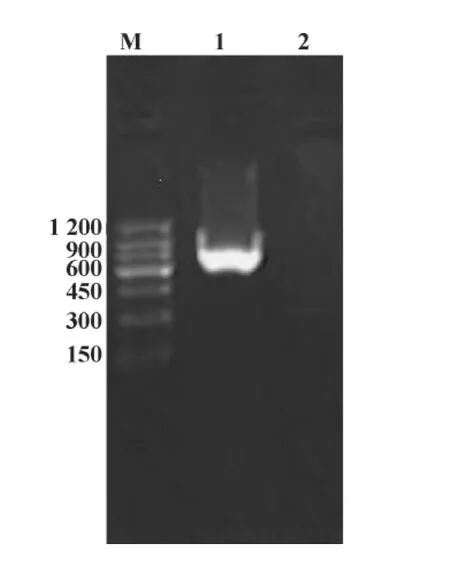
图1 菌落PCR鉴定重组质粒Fig.1 Identification of recombinant plasmid with colony PCR
2.3 rSEC3的Western blot鉴定 免疫印迹结果显示,重组SEC3蛋白能被抗SEC抗体识别,说明重组SEC3蛋白具有良好的抗原性(图3)。
2.4 rSEC3对PBMC的促增殖作用 用终浓度分别为 0.1、0.5、1、5、10、50、100 μg/ml的 rSEC3 作用PBMC,37°C、5%CO2条件下培养 68 小时后,MTT法测定吸光度值(见图4)。空白对照为等体积RPMI1640培养基,阳性对照为100μg/ml PHA。用SPSS17.0统计学软件分析结果得知:与空白对照相比,0.1~100μg/ml的 rSEC3对 PBMC均有显著的促增殖作用(P<0.05);且浓度为1μg/ml时,促增殖作用最强(OD 值为 0.388 ±0.003,t=113.851,P=0.000);和 100μg/ml的 PHA作用相似(t=0.693,P=0.527)。
2.5 rSEC3刺激PBMC后对Hela细胞、KYSE细胞的抑制作用 用MTT法观察终浓度分别为0.5、1、5 μg/ml的rSEC3刺激PBMC后对Hela细胞和KYSE细胞的抑制作用结果见图5。空白对照为等体积培养基,阳性对照为100μg/ml PHA。结果用SPSS17.0软件分析,以Hela细胞为靶细胞,与空白对照相比,0.5、1、5 μg/ml的 rSEC3 均有显著的抑瘤作用(P <0.05);rSEC3浓度为5μg/ml时抑制作用最强[抑瘤率为(103.40 ± 6.65)%,t=10.25,P=0.000]。以KYSE细胞为靶细胞,与空白对照相比,3个浓度的rSEC3也都有显著的抑瘤作用(P<0.05);且rSEC3浓度为1μg/ml时抑制作用最强,抑瘤率为[(46.62 ±4.17)%,t=20.96,P=0.000]。
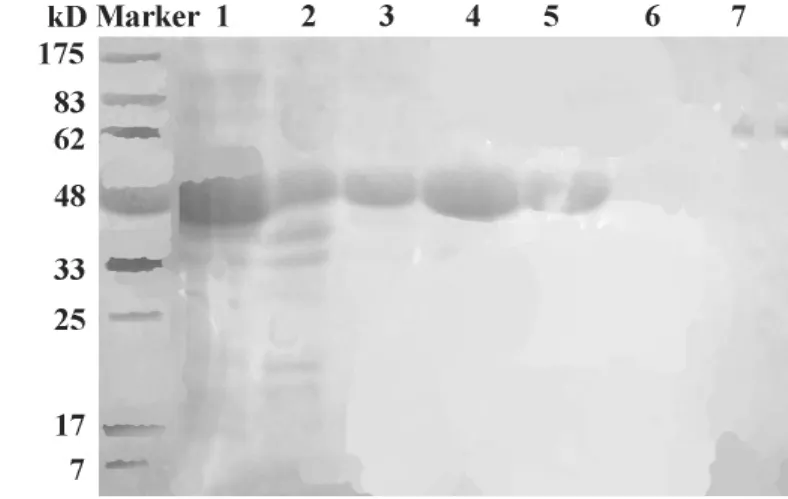
图2 SEC3重组蛋白大量表达的SDS-PAGE结果Fig.2 Identification of recombinant SEC3 using SDSPAGE

图3 重组SEC3蛋白的Western blot分析Fig.3 Western blot analysis of recombinant SEC3 protein
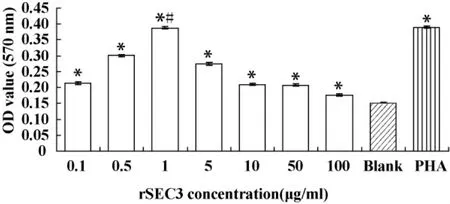
图4 不同浓度的r SEC3对PBMC的促增殖作用Fig.4 Proliferation of PBMC by different concentration of recombinant SEC3
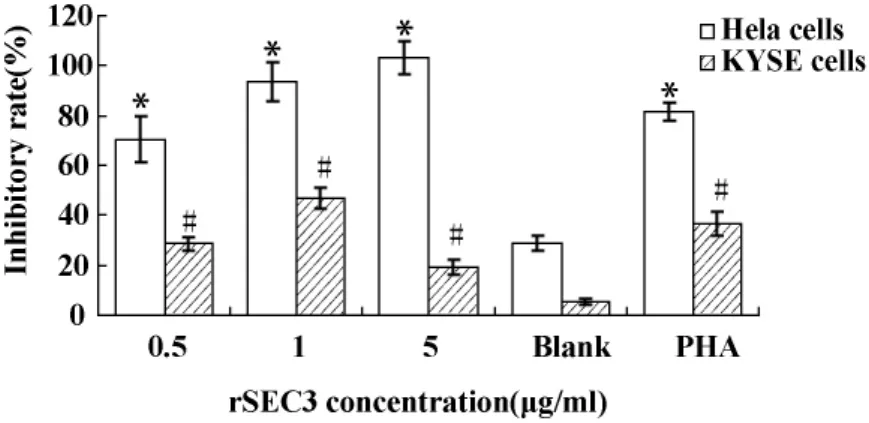
图5 r SEC3作用PBMC后对Hela细胞、KYSE细胞的抑制作用Fig.5 Anti-tumor activity of recombinant SEC3 by activating PBMC
3 讨论
金黄色葡萄球菌肠毒素是由金黄色葡萄球菌分泌的一种细菌性超抗原,具有多种生物学活性[6-8]。超抗原可直接与MHCⅡ类分子及TCR-β链的V区结合,选择性地大量扩增和激活T细胞,激活的T细胞能对表达MHCⅡ类分子的靶细胞产生细胞毒作用[9]。与此同时还能诱导肿瘤敏感性细胞因子如 IFN-γ、TNF-α、IL-2 的产生,从而达到间接杀伤肿瘤细胞、抑制肿瘤生长的作用[10]。与普通抗原相比,超抗原不需APC的处理,亦不受MHCⅡ类分子的限制,又由于Vβ基因的多态性,针对某一特定的超抗原,在T细胞库中约有2% ~30%细胞可发生反应。因此,肠毒素作为超抗原是一种极好的免疫调节剂和细胞因子诱导剂,成为潜在的肿瘤免疫治疗药物[11],也成为免疫学研究的一个重要方向。
由于天然肠毒素产量低,纯化困难,近年来融合蛋白表达系统被广泛应用于重组肠毒素蛋白的制备。目前,已有多种肠毒素蛋白实现重组表达并完成了生物学活性实验[12-15]。本课题组研究构建了SEC3基因的表达载体并实现了重组SEC3蛋白的可溶性表达。SEC3与MHCⅡ类分子作用的关键氨基酸残基为43~47位[16],野生型SEC3由275个氨基酸组成,分子量约为31.4 kD,而重组的SEC3蛋白由239个氨基酸组成,分子量27.6 kD,由于添加了Trx,S,His编码序列,因此产物是一融合蛋白,分子量约47 kD。通过Swiss-PdbViewer软件分析发现改变的氨基酸对SEC3的生物学活性影响较小。
PBMC主要含T、B淋巴细胞、NK细胞和单核细胞,超抗原可在B细胞和单核细胞的辅助下激活表达相应TCR-Vβ的T细胞,使大量的CD4+、CD8+T细胞被活化。在余德厚等[17]对SEA的研究中,发现SEA浓度为1μg/ml时,T细胞表现了最大的增殖活性,但细胞增殖活性与SEA浓度无正相关性。李明等人[18]对 SEB的研究发现,在0~1μg/ml的剂量范围内,SEB促T细胞增殖活性的差异无显著性。本实验中,我们采用 MTT法检测 rSEC3对PBMC的促增殖作用,结果显示在1μg/ml时,rSEC3对T细胞产生了最大的促增殖作用,但随着rSEC3浓度的增加,T细胞增殖活性并未增加。以上研究结果均表明,肠毒素SEC3浓度与T细胞的增殖无正相关性。
在体外抑瘤实验中,0.5、1、5 μg/ml的 rSEC3均能显著增强淋巴细胞对Hela细胞和KYSE细胞的杀伤活性。但对Hela细胞的抑瘤率总体高于KYSE细胞,这可能是由于针对不同的肿瘤细胞,rSEC3发挥杀伤作用的主要机制不同[19-21]。以Hela细胞为靶细胞时,5μg/ml rSEC3作用淋巴细胞后抑瘤率超过100%,在重组SEC2的研究中也出现了类似的结果[14]。抑瘤率超过100%即实验孔的吸光度值小于效应细胞本底释放孔,说明测定时实验孔内活细胞数量小于效应细胞本底释放孔。这可能因为在免疫应答晚期,由于大量肿瘤细胞被清除,淋巴细胞所接受的抗原刺激及所产生的生长因子均减少,导致胞内线粒体释放细胞色素C,通过caspase级联反应而致细胞凋亡[22]。
另外,本研究中当rSEC3浓度为1.0μg/ml时,促T细胞增殖作用最强;据此推断,在1μg/ml时抑瘤活性也应该最高。以KYSE细胞为靶细胞时确实如此,但以Hela细胞为靶细胞时,抑瘤活性最高的浓度为5μg/ml,与促T细胞增殖实验结果并不平行。这可能是由于rSEC3发挥抑瘤活性包含多种机制,除了促进T细胞增殖外,还能够促进淋巴细胞分泌细胞因子;且IFN-γ、IL-2等多种细胞因子能够强化NK细胞的杀伤力度,使原先对NK细胞有耐受性的肿瘤细胞也被杀伤[19-21]。因此促T细胞增殖活性最高的浓度未必就是抑瘤活性最高的浓度。
本研究中通过检测rSEC3的超抗原活性,结果表明,rSEC3能有效刺激PBMC增殖,并显著增强PBMC对Hela细胞、KYSE细胞的杀伤作用。另外,本研究还将金黄色葡萄球菌CMCCB(26002)进行了产毒培养,将粗提的肠毒素蛋白(SEs)与rSEC3进行比较,发现rSEC3的超抗原活性优于粗提肠毒素蛋白(结果另发)。
综上,本研究成功表达并纯化了重组SEC3蛋白,且rSEC3蛋白具有典型的超抗原活性。为进一步制备单克隆抗体,构建靶向抗肿瘤融合蛋白奠定了基础。
1 Dinges M M,Orwin P M,Schlievert P M.Exotoxins of Staphylococcus aureus[J].CIin Micro-biol Rev,2000;13(1):16-34.
2 Mead P S,Slutsker L,Dietz V et al.Food-related illness and death in the United States[J].Emerg Infect Dis,1999;5(5):607-625.
3 Baker M D,Acharya K R.Superantigens:structure-function relationship[J].Int J Med Microbial,2004;293(7-8):529-537.
4 徐明恺,张成刚,周亚凤et al.金黄色葡萄球菌肠毒素C2的基因克隆表达及其生物学活性[J].生物化学与生物物理进展,2005;32(3):275-280.
5 王 敏,曹 虹,李先平et al.金黄葡萄球菌肠毒素C3基因的克隆及原核表达[J].中国生物制品学杂志,2010;23(3):256-260.
6 张 伟,潘映秋,陈枢青et al.金黄色葡萄球菌肠毒素E的克隆表达及其生物活性研究[J].中国药学杂志,2008;43(5):331-335.
7 Pepe O,Blaiotta G,Bucci F et al.Staphylococcus aureus and staphylococcal enterotoxin A in breaded chicken products:detection and behavior during the cooking process [J].Appl Environ Microbiol,2006;72(11):7057-7062.
8 贺子彪,杨伟阴,焦保庭et al.体外联合抗原修饰的树突状细胞的抗癌效应[J].世界华人消化杂志,2008;16(1):105-108.
9 Fraser JD,Proft T.The bacterial superantigen and superantigen-like proteins[J].Immunol Rev,2008;22(5):226-243.
10 Terman D S,Bohach G,Vandenesch F et al.Staphylococcal superantigens of the enterotoxin gene cluster(egc)for treatment of stageⅢb non-small cell lung cancer with pleural effusion[J].Clin Chest Med,2006;27(2):321-334.
11 李 云,韩秀兰.超抗原-SE抗肿瘤作用的研究进展[J].免疫学杂志,2005;21(3):60-64.
12 王丽婵,张庶民,余模松et al.金黄色葡萄球菌肠毒素 A基因克隆、表达、纯化与鉴定[J].中国生物制品学杂志,2006;19(2):120-123.
13 徐水凌,王兆丰,漆秋兰et al.重组葡萄球菌肠毒素B突变体蛋白D9N的表达、纯化及生物学活性的研究[J].中国药学杂志,2009;44(11):810-814.
14 应跃斌,李丹曦,潘映秋et al.重组金黄色葡萄球菌肠毒素C2的表达及生物学活性分析[J].免疫学杂志,2007;23(2):144-147.
15 潘映秋,丁 丁,孙红颖et al.重组金葡菌肠毒素O的克隆表达及生物学活性分析[J].药学学报,2007;42(9):943-948.
16 Sundberg E J,Sawicki M W,Southwood S et al.Minor structural changes in a mutated human melanoma antigen correspond to dramatically enhanced stimulation of a CD4+tumor-infiltrating lymphocyte line[J].J Mol Biol,2002;319(2):449-461.
17 余德厚,陆洪光,程 波et al.超抗原金黄色葡萄球菌肠毒素A对人外周血T细胞活化作用的观察[J].贵州医药,2002;27(7):583-585.
18 李 明,邢飞跃,李 岩.超抗原SEB或SEC对T细胞增殖和活化的影响[J].实用医学杂志,2005;21(15):1612-1614.
19 Dohlsten M,Lando PA,Hedlund G et al.Targeting of human cytotoxic T lymph-ocytes to MHC class-Ⅱexpressing cells by staphylococcal enterotoxins[J].Immunology,1990;71(1):96-100.
20 Dohlsten M,Sundstedt A,Björklund M et al.Superantigen-induced cytokines suppress growth of human colon carcinoma cells[J].Int Cancer,1993;54(3):482-488.
21 Rosendahl A,Kristensson K,Hansson J et al.Perform and IFN-gamma are involved in the antitumor effects of antibody-targeted superantigens[J].Immunol,1998;160(11):5309-5313.
22 Murakami K,Liadis N,Sarmiento J et al.Caspase3 is not essential for the induction of anergy or multiple pathways of CD8+T-cell death[J].Eur JImmunol,2010;40(12):3372-3377.
