慢病毒介导的RNA干扰沉默Slug基因对结肠癌HCT116细胞增殖和凋亡的影响①
2012-07-30陈旺盛文坤明傅仲学重庆医科大学附属第一医院普通外科重庆400016
钱 江 陈旺盛 文坤明 傅仲学 (重庆医科大学附属第一医院普通外科,重庆400016)
结直肠癌(Colorectal cancer,CRC)是常见的消化系统肿瘤之一,在全球范围内排第三位的恶性肿瘤,其死亡率占第四位[1]。目前虽然手术,放化疗等传统治疗方式取得了长足的进步和发展,但仍有大量恶性肿瘤患者死于肿瘤复发或转移,因此,寻找一种崭新的有效的治疗方法和途径,提高患者生存质量有着重要的意义。锌指转录因子Slug作为E-钙粘蛋白的转录抑制因子,在许多种恶性肿瘤的发生、发展和转移中起重要作用。Yang等[2]研究发现Slug基因在恶性肿瘤中过度表达,并与肿瘤的发生、发展及患者预后有关。本实验通过构建Slug基因shRNA慢病毒表达载体,转染人结直肠癌HCT116细胞,观察其在体外对细胞增殖活性和细胞凋亡周期的影响,为结直肠癌基因靶向治疗提供实验依据。
1 材料与方法
1.1 材料和试剂 人结肠癌细胞株HCT116购自中科院上海细胞研究所;慢病毒载体系统pGCSILGFP Vector、pHelper1.0、pHelper2.0、大肠埃希菌菌株DH5、polybrene购自上海吉凯基因化学技术有限公司;Taq DNA聚合酶、Pyrobest®DNA聚合酶购自大连宝生物工程有限公司(TaKaRa);MTT试剂盒、蛋白裂解液和电化学发光(Electrochemilum-inescence,ECL)试剂盒购自上海碧云天生物技术有限公司;膜连蛋白 V-异硫氰酸荧光素(Annexin VFITC)细胞凋亡检测试剂盒购自南京凯基公司;RPMI1640和高糖DMEM培养基购自Hyclone公司;胎牛血清为PAA原装进口;胰蛋白酶购自Gibco公司;LipofectaminTM2000和Opti-MEM培养基购自Invitrogen公司;蛋白裂解液RIPA和蛋白酶抑制剂PMSF购自上海申能博彩生物科技有限公司;BCA蛋白含量检测试剂盒购自南京凯基生物科技发展有限公司;GAPDH、GFP抗体和HRP标记的鼠二抗均购自Santa Cruz公司;增强型化学发光检测试剂盒购自Pierce公司;SYBR Real-time PCR试剂盒购自大连宝生物公司;Slug抗体购自美国CST公司。
1.2 方法
1.2.1 细胞培养和转染 将人结肠癌HCT116细胞以1×106个/孔接种于6孔板,用含10%胎牛血清的RPMI1640培养液培养于CO2体积分数为5%的37℃培养箱中。当细胞培养至50% ~70%融合度时,参考Translipid说明书,用脂质体Translipid分别转染各种siRNA(50 nmol/L)。实验分组为:空白对照(non interference)组,阴性siRNA(negative siRNA)组和Slug siRNA干扰组。
1.2.2 Real-time PCR检测Slug基因mRNA的表达 细胞分为空白对照(non interference)组,阴性siRNA(negative siRNA)组和Slug siRNA三组。Trizol抽提细胞RNA,采用Oligo(dT)引物和随机引物进行逆转录,以各组细胞cDNA作为模板,每个组设立三个复孔进行Real-time定量PCR检测。GAPDH上游引物为:5'-TGACTTCAACAGCGACACCCA-3',下游引物为:5'-CACCCTGTTGCTGTAGCCAAA-3';Slug基因上游引物为:5'-CAAGGACACATTAGAACTCACAC-3',下游引物为:5'-CTACACAGCAGCCAGATTC-3'。PCR的反应条件:95℃ 2分钟;95℃ 20秒,60℃ 30秒,72℃ 30秒 (40个循环),反应完成后,得出Ct值,然后计算出相应Ct值,分析各组之间Slug基因的mRNA表达水平的差异。
1.2.3 Western blot法检测 HCT116 结肠癌细胞中Slug的表达 细胞分为空白对照(non interference)组,阴性siRNA(negative siRNA)组和Slug siRNA三组。收集转染后的三组细胞浓度为1×107cells/ml,加入裂解液进行蛋白的抽提,BCA法行蛋白的定量。每个样品抽取20μg进行凝胶电泳,经转膜、封闭一抗 (1∶100)稀释后,4℃过夜孵育(内参GAPDH抗体),洗膜后用二抗(1∶500)在室温下杂交1小时,洗膜,ECL发光,显影定影。
1.2.4 MTT法测定HCT116细胞增殖活性 胰酶消化对数生长期细胞,制备浓度为5×104cells/ml单细胞悬液,96孔板中每孔接种100μl,基因沉默方法同前,测定转染后1、2、3、4、5、6 和 7 天细胞增殖活性。在距离时间点结束4小时时小心吸去上清,加入80μl无血清opti-MEM培养液,再加入20 μl MTT溶液(5 g/L),继续培养4小时,然后吸掉上清,每孔加入150μl二甲基亚砜,置摇床上低速振荡10分钟,使结晶物充分溶解,混匀后以酶标仪490nm处读取各孔吸光度值(A490),每组设定3个复孔,按下面公式计算细胞生长抑制率,细胞生长抑制率(%)=[1-(实验组A490均值/对照组A490均值)]×100%,以时间为横坐标轴,吸光度值为纵坐标轴进行绘图。
1.2.5 流式细胞术检测细胞周期 胰酶消化慢病毒转染后处于对数生长期细胞,使细胞完全分散变为单个细胞,用预冷的PBS液洗涤3次,1 500 r/min离心10分钟后收集细胞,弃上清,加入1 ml预冷PBS液重悬细胞,加入 PI(1∶100)及 RNase(1∶100)避光冰浴10分钟,流式细胞仪检测细胞周期,具体操作按照流式细胞周期分析试剂盒产品说明书进行操作。
1.3 统计学分析 各项数据均采用SPSS17.0统计学软件进行统计分析处理,实验数据服从正态分布,以±s表示,组间比较采用方差检验,P<0.05表示差异有统计学意义。
2 结果
2.1 shRNA慢病毒感染HCT116细胞株的转染效率 慢病毒(Slug-pGC-GFP)当MOI值为1时,感染人结肠癌HCT116细胞,于感染至3天后在荧光显微镜下观察到细胞绿色荧光表达强度高,细胞生长状态良好,表明shRNA慢病毒已稳定感染,其感染效率约为90%(图1)。
2.2 Real-time PCR检测Slug基因的表达 病毒感染HCT116结肠癌细胞后,通过Real-time PCR检测可见转染组Slug基因表达明显低于空白对照组和阴性对照组细胞中Slug基因的表达水平,有明显的抑制作用(P <0.05,图2)。
2.3 Western blot检测Slug基因在HCT116结肠癌细胞中的表达 pGCSIL-GFP-shSlug慢病毒对Slug蛋白表达的变化,与空载体组对照相比,转染组Slug蛋白的表达量显著降低。见图3。
2.4 MTT法检测HCT116细胞增殖 HCT116细胞增殖能力在转染pGCSIL-GFP-shSlug沉默Slug基因后明显降低,且干扰组细胞增殖生长速度较另外两组细胞缓慢,在第4、5、6和7天,显著差异(n=3,P<0.05),而阴性对照组与空白组间吸光度值无显著差异(n=3,P>0.05)。实验结果表明,转染pGCSIL-GFP-shSlug慢病毒载体后,对结肠癌细胞HCT116的生长具有明显抑制作用(图4)。
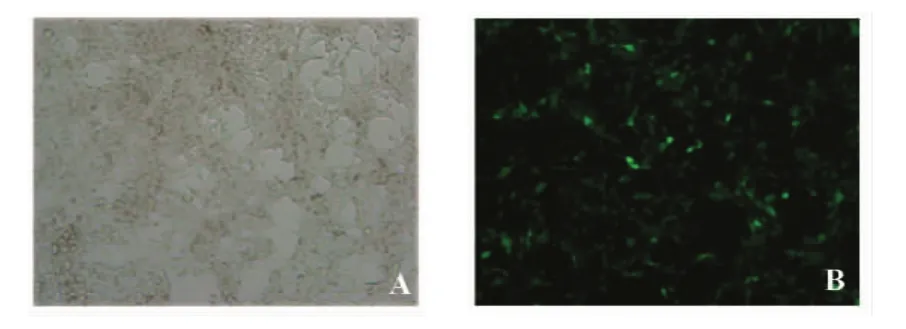
图1 HCT116细胞于慢病毒感染后在荧光显微镜下发出的绿色荧光(×100)Fig.1 HCT116 cells emitted green fluorescence under the fluorescence microscope after virus infection(×100)
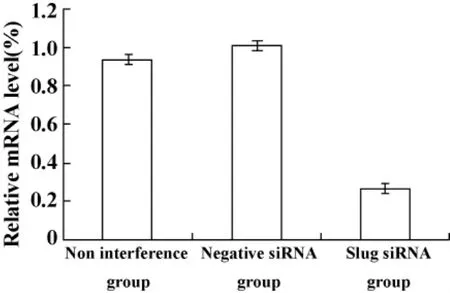
图2 Slug基因沉默在结肠癌HCT116细胞Slug mRNA表达Fig.2 Expression of Slug mRNA in HCT116 cells after Slug gene RNAi
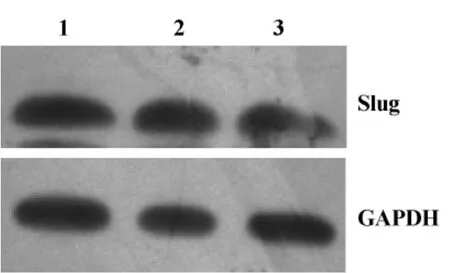
图3 Slug基因沉默在结肠癌HCT116细胞Slug蛋白表达Fig.3 Expression of Slug protein in HCT116 cells after Slug gene RNAi
2.5 流式细胞术检测细胞周期 HCT116细胞周期在Slug基因沉默后发生变化,Slug干扰组G0/G1期细胞百分比(52.3 ±0.6)与对照组(45.1 ±0.3)相比,明显增加(P<0.05),S期细胞百分比(16.6±0.5)和对照组(23.2 ±0.6)比较,有所减少,G2/M期细胞百分比(27.1±0.4)低于对照组(32.6±0.7)。上述结果表明:沉默Slug基因能够将细胞阻滞于G0/G1期,细胞分裂明显减缓(表1、图5)。

表1 三组结肠癌HCT116细胞周期各期百分率比较Tab.1 Comparison of the percentages of HCT116 cells at different phases of cell cycle between three groups
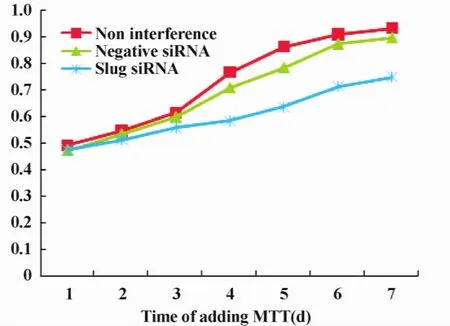
图4 MTT法检测Slug基因抑制后HCT116细胞增殖Fig.4 The proliferation of HCT116 cells after Slug silence detected with MTT

图5 流式细胞仪检测细胞周期Fig.5 The cell detected with flow cytometry
3 讨论
RNA干扰技术(RNA interference,RNAi)能抑制肿瘤细胞中某些癌基因的表达,同时也能抑制肿瘤的增殖和转移,从而达到预防和治疗肿瘤的目的。在构建慢病毒RNAi表达载体过程中,转录发卡样RNA主要是由慢病毒载体骨架和shRNA表达框构成。慢病毒感染宿主细胞后,使shRNA表达框在细胞内被RNA酶整合、转录后诱导合成RNA干扰,培养持续表达shRNA的稳定细胞株,就可以执行RNA干扰作用。
上皮-间质转化(Epithelial-mesenchymal transitions,EMT)参与了胚胎发育和正常生理作用,参与了肿瘤的发生和发展,并且还与肿瘤细胞的原位侵袭和远处转移密切相关[3]。EMT最重要的标志性变化指标为上皮细胞钙粘蛋白(E-cadherin)的减少或丢失,而E-钙粘蛋白作为细胞间重要的粘附分子,具有抑制肿瘤侵袭转移的作用[4],Thiery 等[5]在对E-钙粘蛋白表达调控及细胞信号通路的研究中发现,锌指转录因子Snail在转录水平对E-钙粘蛋白的调节为EMT的中心环节。锌指转录因子Slug作为Snail基因超家族中的一员,最早发现于原肠形成和神经脊形成过程中的中胚层细胞。在EMT过程中是一个非常重要的调节因子。相关研究发现,Slug基因作为E-cadherin的一个强有力的抑制因子,参与并调控胚胎发育、创口愈合、肿瘤发生与转移、组织纤维化等生物学过程。Slug基因有高度保守的C2H2-型锌指结构域,可以通过与E-box结构域结合从而抑制靶基因的转录,Slug基因作为Snail家族成员之一,能下调E-钙粘蛋白,从而诱导发生EMT[6,7]。许多实验研究表明,Slug 基因过度表达在胃癌、结肠癌、乳腺癌、卵巢癌等多种肿瘤的发生、发展和转移过程中起着重要作用[8-11]。为了证实Slug基因在结肠癌细胞中增殖能力和细胞凋亡周期中的作用,本研究在结肠癌HCT116细胞应用RNA干扰技术,下调Slug基因的表达,shRNA慢病毒载体转染后,结肠癌HCT116细胞中Slug mRNA和蛋白表达量明显减少,本实验表明,干扰Slug基因转录水平和蛋白表达后可明显抑制结肠癌细胞的增殖。Slug基因沉默后,HCT116细胞在G0/G1期出现阻滞,提示沉默Slug基因后可以抑制细胞分裂,Slug基因可能是引起细胞周期改变,从而在结肠癌的恶性增殖中起着重要作用。
本实验研究结果证实了采用RNA干扰技术可有效地下调与恶性肿瘤密切相关基因的表达,初步探讨了以Slug基因为靶点在结直肠癌基因治疗方面的可行性,并为下一步的动物实验打下基础。
1 Weitz J,Koch M,Dehus J et al .Colorectal cancer[J].Lancet,2005;365(9454):153-165.
2 Yang A D,Camp ER,Fan F et al.Vascular endothelial growth factor receptor-1 activation mediates epithelial to mesenchymal transition in human pancreatic carcinoma cells[J].Cancer Res,2009;66(1):46-51.
3 Thiery JP.Epithelial-mesenchymal transitionsin development and pathologies[J].Curr Opin Cell Biol,2003;15(6):740-746.
4 Yu J,Ebert M P,Miehlke S et al.α-Catenin expression is decreased in human gastric cancers and in the gastric mucosa of first degree relatives[J].Gut,2000;46(5):639-644.
5 Thiery J P.Epithelial-mesenchymal transitions in tumor progression[J].Nat Rev Cancer,2002;2(6):442-454.
6 Lange-Sperandio B,Trautmann A,Eickelberg et al.Leukocytes induce epithelial to mesenchymal transition after unilateral ureteral obstruction in neonatal mice [J].Am J Pathol,2007;171(3):861-871.
7 Kurrey N K,Bapat SA.Snail and Slug are major determinants of ovarian cancer invasiveness at the transcription level[J].Gynecol Oncol,2005;97(1):155-165.
8 Chart A O.E-cadherin in gastric cancer[J].World J Gastroenterol,2006;12(2):199-203.
9 Shih J Y,Tsai M F,Chang T H et al.Transcription repressor Slug promotes carcinoma invasion and predicts outcome of patients with lung adenocarcinoma[J].Clin Cancer Res,2005;11(22):8070-8078.
10 Cme C,Magnino F,Bibeau F et al.Snail and Slug play distinct roles during breast carcinoma progression[J].Clin Cancer Res,2006;12(18):5395-5402.
11 Park S H,Cheung L W,Wong A S et al.Estrogen resulmes Snail and Slug in the down-regulation of E-cadherin and induces metastatic potential of ovarian cancer cells through estrogen receptor alpha[J].Mol Endocrinol,2008;22(9):2085-2098.
