AGEs通过RAGE促进Jurkat细胞分泌肿瘤坏死因子-α①
2012-07-30朱明理彭雪峰刘晓红刘礼斌
游 捷 朱明理 彭 伟 彭雪峰 刘晓红 刘礼斌
(福建医科大学协和临床学院,福建省内分泌研究所,福州350001)
晚期糖化终产物(AGEs)与晚期糖化终产物受体(RAGE)结合导致机体的病理改变在糖尿病加速动脉粥样硬化进程中起重要作用。动脉粥样硬化发生发展与免疫炎症反应密切相关,近年有关T淋巴细胞功能紊乱与动脉粥样硬化的关系引起人们的重视。氧化低密度脂蛋白、热休克蛋白等可引起T淋巴细胞活化而启动免疫反应,在动脉粥样硬化发病中起重要作用[1,2]。研究表明AGEs和氧化低密度脂蛋白一样能刺激树突状细胞成熟,促进单核巨噬细胞分泌炎症因子[3,4]。但目前AGEs对T淋巴细胞功能影响的研究还较少。本研究观察AGEs对Jurkat细胞(CD4+T细胞)表面RAGE表达及分泌炎症因子的影响。
1 材料与方法
1.1 材料 Jurkat细胞株购于中科院上海细胞库;RPMI1640培养粉购自Gibco公司;牛血清白蛋白(BSA)购自Sigma公司;PHA购自Amresco公司;胎牛血清购自杭州四季青公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、RIPA 裂解液、化学发光检测试剂盒(ECL)及蛋白浓度测定试剂盒(BCA)购自海门碧云天生物公司;人TNF-αELISA试剂盒购自武汉博士德公司;鼠抗人RAGE单克隆抗体,鼠抗人非特异IgG抗体购自Santa Cruz公司;兔抗人pp38MAPK、p38及pJNK、JNK多克隆抗体购自Cell Signaling Technology公司;兔抗人β-actin抗体及辣根过氧化物酶标记相应二抗购自北京中杉金桥生物公司。
1.2 方法
1.2.1 AGEs制备及细胞培养 按照文献[5]方法制备AGEs,常规进行荧光测定,内毒素测定。Jurkat细胞用含10%胎牛血清的RPMI1640培养基,在5%CO2、37℃、饱和湿度条件下常规培养,隔天换液。
1.2.2 MTT法检测细胞存活率 Jurkat细胞以1×105ml-1接种于96孔板,0.25μg/ml PHA预刺激24小时。予不同浓度的 AGEs或 BSA(0、50、100、200 μg/ml)作用24小时,加 MTT(5 mg/ml)10 μl,继续培养4小时后离心去上清,加二甲亚砜100μl,振荡10分钟,酶标仪上以波长490 nm测吸光度。
1.2.3 免疫印迹检测 RAGE的表达 Jurkat细胞以1×105ml-1接种于6孔板,PHA预刺激24小时。以不同浓度的 AGEs或 BSA(0、50、100、200 μg/ml)作用24小时后收集细胞,提取总蛋白,用BCA试剂盒测定蛋白浓度。配平各组蛋白,10%SDS-PAGE,鼠抗人RAGE单抗(1∶500)及兔抗人β-actin单抗(1∶1 000)孵育过夜,辣根过氧化物酶标记相应二抗(1∶1 500)室温1小时,ECL试剂盒处理,暗室曝光。以Image J软件分析各组灰度值,结果以目标蛋白除β-actin表示。
1.2.4 ELISA 检测 TNF-α 的表达 Jurkat细胞以1×105ml-1接种于24孔细胞培养板,PHA预刺激24小时。以不同浓度的 AGEs或 BSA(0、50、100、200μg/ml)作用24小时后收集培养液上清,-80℃保存。同时裂解细胞测总蛋白,平衡各组细胞数。按照ELISA说明书操作检测上清中TNF-α的浓度,结果以pg/mg表示。
1.2.5 免疫印迹检测pp38MAPK/p38MAPK、pJNK/JNK Jurkat细胞以1×105ml-1接种于6孔细胞培养板,PHA预刺激24小时。以200μg/ml AGEs作用0、10、20、30、40 分钟,然后收集细胞,提取总蛋白。Western blot检测p38MAPK、JNK磷酸化,一抗兔抗人 pp38MAPK,p38MAPK、pJNK ,JNK均为1∶1 000稀释,鼠抗兔二抗为1∶2 000稀释,结果以pp38MAPK/p38MAPK、pJNK/JNK表示。
1.2.6 阻断 RAGE、p38MAPK、JNK 对 TNF-α 的影响 为观察RAGE在AGEs促进TNF-α表达中的作用,用抗RAGE抗体(1μg/ml)预处理Jurkat细胞1小时,以200μg/ml的AGEs作用24小时后收集培养液上清,-80℃保存。同时设非特异抗体组为对照。另一部分实验200μg/ml AGEs作用前分别加入p38 MAPK、JNK阻滞剂SB203580(100μmol/L)、SP600125(30μmol/L)预孵育30分钟。按照ELISA说明书操作检测上清中TNF-α的浓度,结果以x±s,pg/mg表示。
1.3 统计学处理 每组实验重复3次,结果以x±s表示,采用SPSS16.0软件进行统计学分析。常规进行方差齐性检验,正态性检验,样本均数间的比较采用t检验和方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 AGEs对Jurkat细胞存活率的影响 PHA具有刺激淋巴细胞活化分裂的作用,为模拟T细胞活化的双信号机制,本实验选用低浓度(0.25μg/ml)PHA提供协同刺激信号。不同浓度的AGEs或BSA(0、50、100、200 μg/ml)作用24 小时,测定各组细胞的吸光度,结果显示AGEs和BSA对PHA预刺激后的Jurkat细胞的生长无明显影响(P>0.05)。
2.2 AGEs对Jurkat细胞RAGE表达的影响 为观察AGEs对Jurkat细胞表面RAGE表达的影响,我们应用Western blot检测AGEs作用于PHA预刺激的Jurkat细胞24小时后RAGE蛋白的表达,结果显示PHA预刺激的 Jurkat细胞表达RAGE,50~200 μg/ml AGEs明显上调RAGE表达,有浓度依赖关系(P﹤0.05~0.01)。不同浓度的BSA对RAGE蛋白的表达无明显影响,见图1。
2.3 AGEs对 Jurkat细胞分泌TNF-α 的影响 不同浓度AGEs或BSA作用于PHA预刺激的Jurkat细胞24小时后,ELISA检测TNF-α分泌。结果显示50μg/ml AGEs不影响PHA预刺激的Jurkat细胞分泌 TNF-α,而 100~200 μg/ml AGEs能促进 Jurkat细胞分泌TNF-α,与BSA组比较差异有统计学意义(P <0.05 ~0.01),见图2。
2.3 AGEs对Jurkat细胞内信号通路的影响 200 μg/ml AGEs与PHA预处理后的Jurkat细胞共培养0~40分钟后提取总蛋白,Western blot方法检测p38MAPK、JNK磷酸化与非磷酸化水平的变化。结果表明AGEs作用Jurkat细胞10分钟就能引起磷酸化p38MAPK表达增高,持续30~40分钟,40分钟后p38MAPK磷酸化有所下降,但仍较未刺激前明显增高。AGEs作用 Jurkat细胞10分钟后JNK磷酸化水平表达增高,30~40分钟后JNK磷酸化水平达高峰。在AGEs作用40分钟内非磷酸化 p38MAPK、JNK水平无明显改变(P<0.01,见图3)。
2.4 阻断 RAGE、p38MAPK、JNK 对 TNF-α的影响 为观察RAGE及其胞内信号分子在AGEs促进TNF-α表达中的作用,用抗RAGE抗体(1μg/ml)预处理Jurkat细胞,再加200μg/ml AGEs刺激细胞,结果显示抗RAGE抗体抑制AGEs刺激的TNF-α的分泌,而非特异抗体对AGEs刺激的TNF-α的分泌无影响。应用p38MAPK、JNK抑制剂能明显抑制AGEs刺激的 TNF-α 的分泌(P <0.01,图4)。
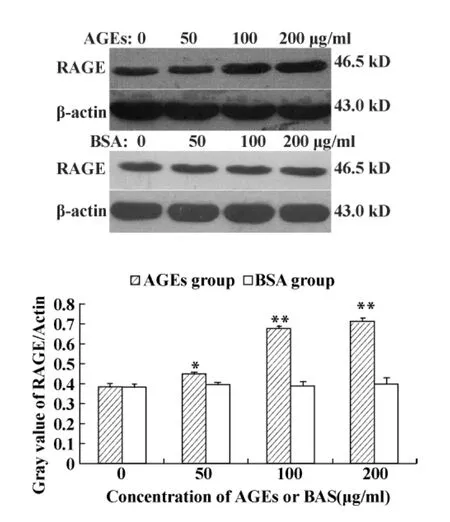
图1 Western blot检测AGEs对Jurkat细胞RAGE表达的影响Fig.1 Effect of AGEs on the expression of RAGE detected by Western blot
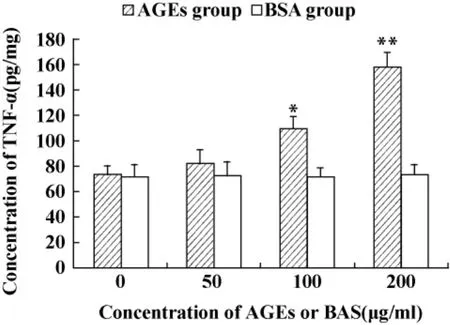
图2 ELISA检测AGEs对Jurkat细胞TNF-α分泌的影响Fig.2 Effects of AGEs on the secretion of TNF-α detected by ELISA
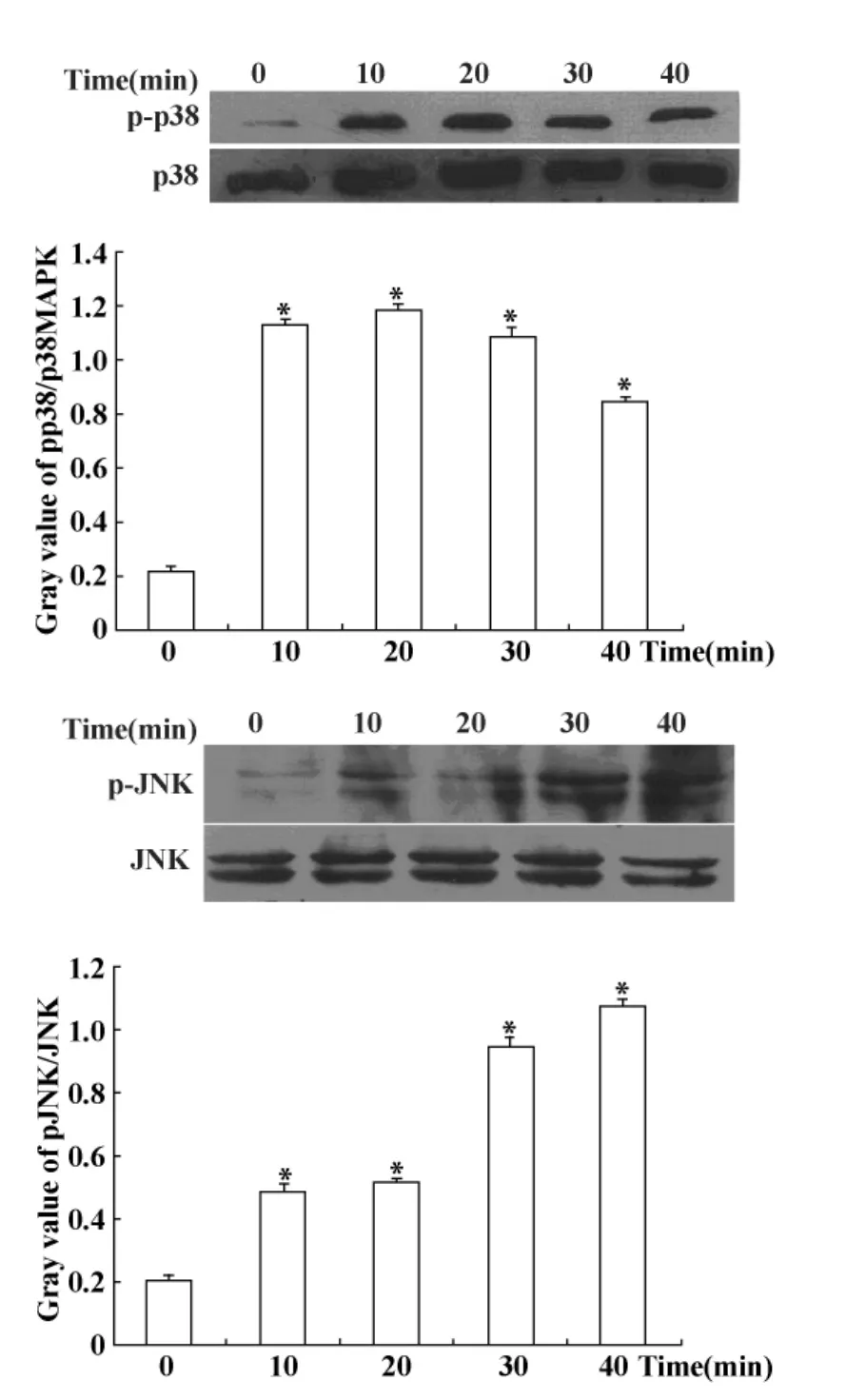
图3 Western blot方法检测AGEs对p38MAPK及JNK磷酸化蛋白表达的影响Fig.3 Effects of AGEs on p38MAPK and JNK phosphorylation detected by Western blot
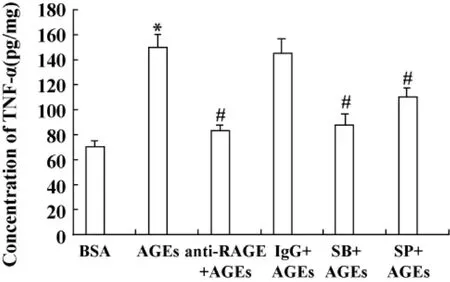
图4 抗RAGE抗体、p38 MAPK、JNK抑制剂对AGEs诱导TNF-α分泌的影响Fig.4 Effects of anti-RAGE,inhibitors of p38MAPK ,JNK on the secretion of TNF-αinduced by AGEs
3 讨论
已有研究发现RAGE优先表达于小鼠CD44+预激活的记忆池中的初始CD4+T细胞和CD8+T细胞,而CD44-细胞表达较少[6]。我们的研究证实了人CD4+T淋巴细胞Jurkat细胞表达RAGE,随着AGEs诱导的浓度递增,RAGE蛋白表达明显增加。这种配体-受体正反馈调节的现象在多种细胞上有相似的表现,如内皮细胞、神经细胞、树突状细胞和单核巨噬细胞等。其原因一方面与核转录因子(NF)-кB激活有关,AGEs可活化多种细胞的NF-κB转录,而NF-κB对RAGE基因启动子存在正向调控作用从而可增加RAGE在细胞表面的表达[7]。另一方面,研究认为RAGE是一种类似于Toll样受体(TLRs)的模式识别受体,内毒素、活性氧、TNF-α等能直接促进RAGE的表达[8]。RAGE和AGEs的其他受体不同,RAGE的作用并非清除体内的AGEs,而是作为传导AGEs信号的受体分子,介导了细胞对AGEs的大部分应答反应。这个特征使RAGE诱发了一种扩大的炎症免疫作用,引起细胞的持续活化,在炎症免疫性疾病中起重要作用。
我们进一步观察发现AGEs使PHA预刺激的Jurkat细胞分泌TNF-α增加,RAGE抗体干预明显抑制AGEs诱导的TNF-α的分泌。这个结果说明AGEs对 Jurkat细胞分泌 TNF-α的影响是通过RAGE介导。研究表明RAGE在T细胞正常免疫过程中起重要作用,Dumitriu等[9]用内源性高迁移率蛋白-1刺激抗-CD3和/或抗-CD28抗体预刺激的大鼠脾脏T细胞,可使T细胞大量增殖,表达更多的IFN-γ和IL-12,而抗RAGE抗体可使T细胞增殖和分化能力明显降低。Moser等[6]把 RAGE+/+或RAGE-/-源的CD4+T细胞转入同种异体RAGE-/-或RAGE+/+C57BL/6小鼠体内,给小鼠腹腔内注射鸡卵清蛋白,发现 RAGE+/+源 CD4+T细胞与RAGE+/+宿主都有利于T细胞的激活与增殖,并且使Th1型细胞因子IL-12和IFN-γ明显增多。Imani等[10]发现AGEs引起刀豆蛋白预刺激人外周血淋巴细胞粘附增加,并通过细胞表面65 kD的蛋白,促进人外周血淋巴细胞表达更多的IFN-γ。但他们的研究未明确该细胞表面蛋白的性质。我们的研究提示AGEs通过RAGE并促进Jurkat细胞分泌TNF-α增多,可能与糖尿病促进动脉粥样硬化的形成有关。
还有一个引起我们兴趣的发现是,抗RAGE抗体干预显著抑制AGEs诱导Jurkat细胞分泌TNF-α,提示抑制RAGE的作用可抑制T淋巴细胞免疫功能。其实已有多项研究提示抑制RAGE的作用起到免疫抑制的效果,Dunn等[11]给 IL-10阴性小鼠(慢性结肠炎龋齿类模型)腹腔注射sRAGE(RAGE可溶性片段,可结合RAGE的配体,起抑制RAGE的作用),6周后发现sRAGE能明显减少小鼠结肠黏膜下层出现淋巴细胞、巨噬细胞、嗜酸性粒细胞浸润,小鼠慢性结肠炎明显减轻。Yan等[12]发现自身免疫性脑脊髓膜炎小鼠的脊髓高表达RAGE及其配体S100,给小鼠腹腔注射sRAGE或抗RAGE抗体,能明显减少中枢神经系统炎症细胞的入侵;对小鼠发病症状进行临床评分,显示阻断RAGE使自身免疫性脑脊髓膜炎小鼠的病情明显减轻。新近研究发现RAGE还参与移植排斥免疫,阻断RAGE能明显推迟心脏移植后急性免疫排斥反应[13]。这些研究结果提示抑制RAGE的作用可能与免疫抑制有关,已有动物实验应用sRAGE或抗RAGE抗体可减少ApoE-/-小鼠动脉硬化的发生和发展,但是否与RAGE的免疫抑制作用有关,值得进一步研究[14]。
细胞因子和丝裂原等均可激活应激调节的蛋白激酶级联,通过激酶活化基序的磷酸化而活化p38 MAPK和JNK,进而激活NF-κB、AP-1等转录因子,调节炎症介质、炎症因子等多种基因的表达,参与炎症反应。Yeh等[15]发现 AGEs和 RAGE结合引起p38 MAPK磷酸化进而活化NF-κB促进人单核细胞(THP-1)表达炎症因子 TNF-α、IL-1、单核细胞趋化因子-1,与糖尿病血管并发症的发生与发展有关。Sun 等[16]发现 AGEs可通过 RAGE/p38MAPK/NF-κB途径引起人内皮祖细胞功能紊乱,促进动脉硬化的形成。研究还发现AGEs通过JNK途径使树突状细胞表面受体RAGE及CD83、CD86、MHCⅡ分子等表达增多,促进树突状细胞成熟,进一步提高T淋巴细胞增殖能力、表达更多的炎症因子IFN-γ、IL-12等,与动脉粥样硬化的形成有关[3]。本实验发现AGEs可引起p38MAPK、JNK磷酸化水平明显增高,表明p38MAPK,JNK途径已被激活;与 Yeh、Sun的研究一致。推测AGEs与其特异性受体RAGE结合,通过p38MAPK、JNK途径促进Jurkat细胞分泌炎症因子,在糖尿病血管病变中起作用。
动物实验研究证实sRAGE及抗RAGE抗体能阻断RAGE与配体反应,并在多种炎症免疫性疾病中起保护作用,但仅局限于细胞和动物实验,尚未应用于临床治疗。进一步明确RAGE在炎症免疫性疾病中的作用及其机制,寻找抑制RAGE的措施不但能减少糖尿病并发症带来的巨大危害,而且对其它与RAGE有关的慢性肾脏疾病、肿瘤、阿尔茨海默病等疾病防治也有好处。
1 Choi S H,Harkewicz R,Lee J H et al.Lipoprotein accumulation in macrophages via Toll-like receptor-4-dependent fluid phase uptake[J].Cir Res,2009;104(12):1355-1363.
2 Gong J,Zhu B,Murshid A et al.T cell activation by heat shock protein 70 vaccine requires TLR signaling and scavenger receptor expressed by endothelial cells-1[J].JImmunol,2009;183(5):3092-3098.
3 Ge J,Jia Q,Liang C et al.Advanced glycosylation end products might promote atherosclerosis through inducing the immune maturation of dendritic cells[J].Arterioscler Thromb Vasc Bio,2005;25(10):2157-2163.
4 Takahashi H K,Mori S,Wake H et al.Advanced glycation end products subspecies-selectively induce adhesion molecule expression and cytokine production in human peripheral blood mononuclear cells[J].JPharmacol Exp Ther,2009;330(1):89-98.
5 You J,Peng W,Lin X et al.PLC/CAMK IV-NF-kappaB involved in the receptor for advanced glycation end products mediated signaling pathway in human endothelial cells[J].Mol Cell Endocrinol,2010;320(1-2):111-117.
6 Moser B,Desai D D,Downie M P et al.Receptor for advanced glycation end products expression on T cells contributes to antigen-specific cellular expansion in vivo [J].J Immunol,2007;179(12):8051-8058.
7 Li J,Schmidt A M.Characterization and functional analysis of the promoter of RAGE,the receptor for advanced glycation end products[J].J Biol Chem,1997;272(26):16498-16506.
8 Lin L.RAGE on the Toll Road?[J].Cell Mol Immunol,2006;3(5):351-358.
9 Dumitriu I E,Baruah P,Valentinis B et al.Release of high mobility group box 1 by dendritic cells controls T cell activation via the receptor for advanced glycation end products[J].J Immunol,2005;174(12):7506-7515.
10 Imani F,Horii Y,Suthanthiran M et al.Advanced glycosylation end product-specific receptors on human and rat T-lymphocytes mediate synthesis of interferon gamma:role in tissue remodeling[J].JExp Med,1993;178(6):2165-2172.
11 Hofmann M A,Drury S,Fu C et al.RAGE mediates a novel proinflammatory axis:a central cell surface receptor for S100/calgranulin polypeptides[J].Cell,1999;97(7):889-901.
12 Yan SS,Wu Z Y,Zhang H P et al.Suppression of experimental autoimmune encephalomyelitis by selective blockade of encephalitogenic T-cell infiltration of the central nervous system [J].Nat Med,2003;9(3):287-293.
13 Moser B,Szabolcs M J,Ankersmit H J et al.Blockade of RAGE suppresses alloimmune reactions in vitro and delays allograft rejection in murine heart transplantation [J].Am J Transplant,2007;7(2):293-302.
14 Soro-Paavonen A,Watson A M,Li J et al.Receptor for advanced glycation end products(RAGE)deficiency attenuates the development of atherosclerosis in diabetes[J].Diabetes,2008;57(9):2461-2469.
15 Yeh C H,Sturgis L,Haidacher J et al.Requirement for p38 and p44/p42 mitogen-activated protein kinases in RAGE-mediated nuclear factor-kappaB transcriptional activation and cytokine secretion[J].Diabetes,2001;50(6):1495-1504.
16 Sun C,Liang C,Ren Y et al.Advanced glycation end products depress function of endothelial progenitor cells via p38 and ERK 1/2 mitogen-activated protein kinase pathways[J].Basic Res Cardiol,2009;104(1):42-49.
