奥美拉唑对肾移植术后不同剂型麦考酚酸浓度的影响
2012-07-10陈劲松文吉秋孙启全季曙明程东瑞谢轲楠刘志红
陈劲松 李 雪 文吉秋 孙启全 季曙明 程东瑞 吴 迪 谢轲楠 刘志红
由于器官移植技术、移植免疫基础及各种免疫抑制剂的研究进展,器官移植已成为临床治疗器官功能衰竭的有效治疗手段之一。麦考酚酸(MPA)是一种抗代谢类免疫抑制剂,与环孢素A(CsA)、他克莫司、雷帕霉素等联用有协同作用,可有效防治肾移植术后急性排斥反应[1]。目前在临床常用的麦考酚钠肠溶片(EC-MPS)和吗替麦考酚酯片(MMF)是两种不同剂型,在体内均快速水解为活性产物MPA而产生免疫抑制作用。
消化性溃疡病是器官移植术后常见的并发症,需要抗酸剂如质子泵抑制剂(PPI)进行治疗。研究显示,约80%的移植患者在术后接受PPI治疗[2]。本文将研究奥美拉唑对上述两种剂型的MPA的影响,以便为更加合理应用这类免疫抑制剂提供准确依据。
对象和方法
入选标准2010年7月至2011年7月在南京军区南京总医院首次行尸体肾移植患者16例,随机分为MMF组和EC-MPS组,每组8例,年龄18~60岁,术前群体反应性抗体(PRA)<10%。育龄女性在观察之前的7d内血清妊娠试验阴性。所有患者入组前均交代奥美拉唑治疗的剂量及疗程。
排除标准(1)再次或多次器官移植;(2)多器官联合移植 (如肾脏和胰腺)或曾经接受其他任何器官移植;(3)使用抗淋巴细胞抗体制剂进行诱导治疗;(4)供受者ABO血型不一致;(5)在移植前最后一次测定患者的群体反应性抗体>10%;(6)已知患者对EC-MPS或MMF或制剂中的其他成分(例如乳糖)过敏;(7)有明显血小板减少(<7.5×109/L),和(或)中性粒细胞绝对数<1.5×109/L,和(或)白细胞减少(<2.5×109/L)和(或)血红蛋白<60 g/L;(8)入组前4周内接受过其他试验药物;(9)过去5年内患者有恶性肿瘤病史,但已切除的皮肤鳞状细胞癌和基底细胞癌除外;(10)患有重要临床意义的感染需要继续治疗者;(11)严重腹泻、活动性消化性溃疡或糖尿病控制不良者;(12)人类免疫缺陷病毒(HIV)阳性或HBsAg 阳性;(13)有药物和(或)酒精滥用证据者。
免疫抑制方案入组患者在肾移植术后分别采用新山地明+激素+ EC-MPS或新山地明+激素+MMF三联免疫抑制方案。具体用药方案如下:
EC-MPS:术前给予口服720 mg,术后立即口服540 mg,1次/12h维持。
MMF:术前给予口服1 000 mg,术后立即口服750 mg,1次/12h维持。
EC-MPS的分子量是319.32,MMF的分子量是433.48,180 mg EC-MPS中含MPA 0.5637 mmol,250 mg MMF含MPA 0.5767 mmol,因此,720 mg EC-MPS与1 000 mg MMF等效。
新山地明:术后血清肌酐(SCr)<397.8 μmol/L,CsA起始用量3 mg/(kg·d),术后SCr<176.8 μmol/L,CsA剂量加至6 mg/(kg·d),以后根据血药浓度调整CsA剂量:1月内C0控制在150~200 ng/ml。
激素:甲泼尼龙注射液500 mg/d,静脉滴注,手术当天及术后第1、2天共三天,之后应用甲泼尼龙64 mg/d,每天递减8 mg,至16 mg/d维持。
奥美拉唑:20 mg/d,静脉滴注,在每天8:00点口服MMF或EC-MPS前输完,奥美拉唑应用时间为肾移植术后第1~7天,术后第8天停用。
MPA浓度的检测内容及方法(1)在静脉注射奥美拉唑前及注射后0.5h、1h、1.5h、2h、3h、4h、6h、8h及12h,共10个时间点抽取患者外周静脉血2 ml,含有15%的乙二胺四乙酸(EDTA)抗凝剂的采血管以检测MPA浓度;(2)MPA血药浓度测定采用高效液相色谱(HPLC)法,计算MPA-AUC。
样品处理:全血样品经2 000 r/min离心10 min,吸取200 μl血浆,加入乙腈500 μl,振荡混匀。4℃离心12 000 r/min,10 min,吸取上清,取上清液进样,用Shimadzu Prominence UFLC高效液相色谱仪行色谱分析。
色谱柱:Shim-pack XR-ODS 75 mm L×3.0 mm I.D.2.2 μm;流动相:40 mmol/L四丁基溴化铵-乙腈 (70∶30);柱温:45℃;流速:1.2 ml/min;检测波长:304 nm;进样量:10 μl。
观察指标(1)观察两组患者分别在肾移植术后3d、7d及10d MPA血药浓度-时间曲线下面积(MPA-AUC0-12h),并进行组间及组内比较。(2) 观察两组患者分别在肾移植术后3d、7d及10d的峰值浓度及达峰时间,并进行组间及组内比较。(3)观察并比较上述时间点两组患者血红蛋白(Hb)、SCr、谷丙转氨酶(ALT)、血清白蛋白(Alb)及血CsA浓度的变化。
统计学分析两组间各指标比较均采用Friedman检验,本组内两两比较采用方差分析(ANOVA)(Student-Newman-Keuls及LSD)进行检验,以P<0.05为差异有统计学意义。采用WinNonlin 5.2程序,按非房室模型进行药代动力学参数的计算。
结 果
肾移植术前基线情况两组患者术前检查体质量指数(BMI)、SCr、Hb、ALT、Alb均无统计学差别(表1)。
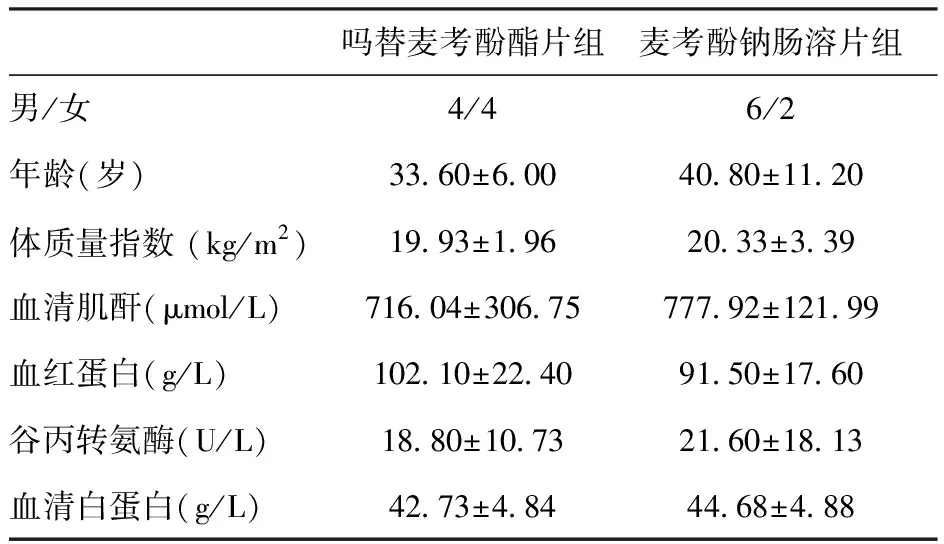
表1 两组患者肾移植术前一般情况及实验室检查结果
肾移植术后情况术后第2周两组Hb均较第1周明显升高(P<0.05),SCr明显下降(P<0.05)。术后第1周和第2周时两组Alb水平、CsA浓度和ALT均无统计学差异,SCr在术后2周两组间有统计学差异(表2)。
*:与本组第1周相比,P<0.05
MMF组达峰时间、峰值、MPA-AUC变化情况MMF组在肾移植术后第3、7、10天达峰时间分别为(1.50±0.71)h、(2.50±1.04)h、(1.25 ±0.60)h(P<0.05),其中第7天较第3天达峰时间延后,第10天较第7天达峰时间提前。
MMF组在肾移植术后第3、7及10天峰值浓度分别为(7.69±2.25)μg/ml、(8.95±5.60)μg/ml及(9.87±3.82)μg/ml(P>0.05),但第10天与第3天和第7天相比P>0.05。
MMF组在肾移植术后第3、7及10天MPA-AUC0-12h分别为(38.98±14.63)mg·h/L、(34.59±12.04)mg·h/L及(32.47±10.81)mg·h/L(P>0.05)。
EC-MPS组达峰时间、峰值、MPA-AUC变化情况 EC-MPS组在肾移植术后第3、7及10天达峰时间分别为(2.50±0.53)h、(2.56±0.62)h及(2.63±0.74)h(P>0.05)。
EC-MPS组在肾移植术后第3、7及10天峰值浓度分别为(11.56±9.59)μg/ml、(12.64±8.49)μg/ml及(10.11±9.19)μg/ml(P>0.05)。
EC-MPS组在肾移植术后第3、7及10天MPA-AUC0-12h分别为(22.76±15.52)mg·h/L、(25.31±10.37)mg·h/L及(16.68±14.77)mg·h/L(P>0.05)。
两组MPA-AUC0-12h比较如图1A所示,EC-MPS组患者的MPA-AUC0-12h在肾移植术后第3、7及10天均低于MMF组,两组间第3、7及10天比较P值分别为0.065、0.382及0.05。
两组达峰时间及峰值浓度比较如图1B所示,MMF组与EC-MPS组达峰时间比较:第3、7及10天P值分别0.01、0.721及0.002。两组间峰值浓度在术后第3、7及10天间比较P值分别为 0.878、0.328及0.505,无明显差别(图1C)。

图1 A:MMF和EC-MPS的MPA-AUC0-12h值;B:MMF和EC-MPS的达峰时间;C:MMF和EC-MPS的峰值浓度
讨 论
MPA是高效、选择性的次黄嘌呤单核苷酸脱氢酶抑制剂,可抑制鸟嘌呤核苷酸的经典合成途径,从而抑制淋巴细胞增生。99.99%的MPA分布在血浆中。MPA和麦考酚酸葡萄糖醛酸苷(MPAG) 均与蛋白高度结合,结合率分别为97.98%和82%。游离的MPA浓度可能随着蛋白结合位点的降低(尿毒症、肝功能衰竭、Alb减少)而增加。MPA的半衰期为11.7h,清除率为8.6 L/h;MPA主要经葡萄糖醛酰基转移酶代谢为无生物学活性的MPAG。在稳定期肾移植患者中,MPA多以MPAG 的形式通过尿清除(>60%),少量以MPA的形式在尿中出现(3%);另外,MPAG 部分分泌在胆汁中并可以通过肠道菌群分解,分解后的MPA可被再次吸收,在EC-MPS/MMF给药约6~8h后,可测出MPA浓度的第二个峰[3-5]。
研究显示MMF水解成MPA与吗乙酯的过程高度依赖胃内的酸性环境,在使用PPI 2h内,胃酸分泌被抑制94%,而 EC-MPS在小肠内分解,由于在肠道碱性环境下释放吸收,药物暴露不受PPI的影响[6],Rupprecht等[7]证实由于PPI与MMF联合用药后,可以导致MMF的暴露量不足而增加急性排斥反应的发生率,而PPI与EC-MPS联合作用后对EC-MPS的暴露量无影响。
本研究结果显示,由于奥美拉唑的影响,MMF 组的达峰时间在肾移植术后第7天与第3天相比逐渐延长,在停止使用PPI后,达峰时间缩短,并较第3天水平更短,与第7天相比统计学差别明显,而EC-MPS组在3个时间点无明显变化,不受PPI的影响。同时,由于吸收部分的不同,MMF组患者术后第3天和第10天的达峰时间与EC-MPS组相比也明显提前(P<0.05)。
在对两组患者的MPA-AUC0-12h和峰值浓度的研究结果中显示:MMF组在停止使用PPI前后,MPA-AUC0-12h并未增加,峰值浓度有增加的趋势,但无统计学差别,这与文献报道有所差别,出现该结果的原因我们认为与MPA的药代动力学特征具有高度变异的个体内和个体间差异有关,已经证实包括人种、性别、体重、肝药酶遗传多态性等多种因素都对MPA的药代动力学产生影响[8-12],除此以外,还与本研究所选择的入组患者均为肾移植术后早期的患者有关,因为这些患者的肾功能在肾移植术后都存在逐渐恢复的过程,其中该组有两例患者在术后第10天肾功能仍未恢复正常,使得该组患者的平均SCr在术后第14天时明显高于EC-MPS组,而如表1和表2所示,患者的Alb和Hb水平在肾移植术后也有轻度下降,再加上肾移植术后使用免疫抑制剂特别是CsA后其浓度逐渐上升,这些因素可能对MMF组患者的MPA-AUC0-12h以及峰值浓度产生影响,据一项MPA群体药物代谢学的Meta分析研究结果表明,患者本身的Alb和Hb浓度、肝肾功能损害情况等因素都对MPA的浓度产生影响,同时,CsA可通过多向性抗药蛋白2干扰MPA的肝肠循环途径,从而减少MPA-AUC0-12h[13],这些都是导致MMF组患者在停止使用PPI后MPA-AUC0-12h和峰值浓度并未上升的原因;而在EC-MPS组患者的研究观察中无论是MPA-AUC0-12h还是峰值浓度在停止使用PPI前后也均无统计学差别。
值得注意的是,本研究中EC-MPS组患者的MPA-AUC0-12h值和峰值浓度在同一时间的个体差异更大,而MMF组患者之间MPA-AUC0-12h的差别相对较小,亦较稳定,同时,我们也观察到在应用等摩尔剂量的情况下,EC-MPS组的MPA-AUC0-12h值在本研究观察的3个时间点均较MMF组低,尤其是在术后第3、10天差别明显,这种情况的产生可能与EC-MPS的吸收部分主要在肠道,吸收面积大、影响因素较多等因素有关,同时肾移植术后早期患者处于低蛋白血症、贫血及高CsA浓度状态对肠道吸收影响更大,因此,应该早期监测MPA治疗浓度,并及时调整药物剂量,避免因MMF浓度不足而增加急性排斥反应的发生率。
小结:本研究显示,奥美拉唑能明显延长MMF组MPA的达峰时间,可能降低其峰值浓度,但它对EC-MPS的药代动力学无影响,因此,在肾移植术后应用MMF作为免疫抑制剂的患者术后应早期的检测MPA的浓度,及时调整MMF的剂量。本研究受样本数量较少、观察时间较短等因素的限制,势必也会对研究结果的准确性产生一定的影响,因此,还需大样本的研究对上述问题进一步证实。
1 Jones EL,Epinette WW,Hackney VC,et al.Treatment of psoriasis with oral mycophenolic acid.J Invest Dermatol,1975,65(6):537-542.
2 Herrero JI,Benlloch S,Bernardos A,et al.Gastrointestinal complications in liver transplant recipients:MITOS study.Transplant Proc,2007,39(7):2311-2313.
3 Facundo C,Diaz JM,Guirado L,et al.Results of a triple induction regime with tacrolimus,mycophenolate mofetil,and prednisone in renal transplantation.Transplant Proc,2002,34(1):98.
4 Grinyó JM,Cruzado JM.Mycophenolate mofetil and sirolimus combination in renal transplantation.Am J Transplant,2006,6(9):1991-1999.
5 Offermann G.Five-year results of renal transplantation on immunosuppressive triple therapy with mycophenolate mofetil.Clin Transplant,2003,17(1):43-46.
6 Miura M,Satoh S,Inoue K,et al.Influence of lansoprazole and rabeprazole on mycophenolic acid pharmacokinetics one year after renal transplantation.Ther Drug Monit,2008,30(1):46-51.
7 Rupprecht K,Schmidt C,Raspé A,et al.Bioavailability of mycophenolate mofetil and enteric-coated mycophenolate sodium is differentially affected by pantoprazole in healthy volunteers.J Clin Pharmacol,2009,49(10):1196-1201.
8 Staatz CE,Tett SE.Clinical pharmacokinetics and pharmacodynamics of mycophenolate in solid organ transplant recipients.Clin Pharmacokinet,2007,46(1):13-58.
9 Shaw LM,Korecka M,Venkataramanan R,et al.Mycophenolic acid pharmacodynamics and pharmacokinetics provide a basis for rational monitoring strategies.Am J Transplant,2003,3(5):534-542.
10 Miura M,Kagaya H,Satoh S,et al.Influence of drug transporters and UGT polymorphisms on pharmacokinetics of phenolic glucuronide metabolite of mycophenolic acid in Japanese renal transplant recipients.Ther Drug Monit,2008,30(5):559-564.
11 Kuypers DR,Naesens M,Vermeire S,et al.T The impact of uridine diphosphate-glucuronosyltransferase 1A9 (UGT1A9) gene promoter region single-nucleotide polymorphisms T-275A and C-2152T on early mycophenolic acid dose-interval exposure in de novo renal allograft recipients.Clin Pharmacol Ther,2005,78(4):351-361.
12 van Hest RM,Mathot RA,Pescovitz MD,et al.Explaining variability in mycophenolic acid exposure to optimize mycophenolate mofetil dosing:a population pharmacokinetic meta-analysis of mycophenolic acid in renal transplant recipients.J Am Soc Nephrol,2006,17(3):871-880.
13 Hesselink DA,van Hest RM,Mathot RA,et al.Cyclosporine interacts with mycophenolic acid by inhibiting the multidrug resistance-associated protein 2.Am J Transplant,2005,5(5):987-994.
