Smad锚着蛋白在高糖诱导人肾小管上皮细胞细胞外基质沉积中的作用
2012-07-10凌光辉唐文彬彭佑铭段绍斌刘映红刘伏友
凌光辉 唐文彬 孙 林 彭佑铭 段绍斌 刘 虹 李 瑛 刘映红 刘伏友
糖尿病肾病(diabetic nephropathy,DN)是终末期肾病(end stage renal disease,ESRD)最常见的原因之一。肾小管间质纤维化(tubulointerstitial fibrosis,TIF)是DN发展到ESRD的最主要病理改变,而细胞外基质(extracellular matrix,ECM)沉积是肾间质纤维化的主要组织学改变。高糖导致肾小管上皮细胞ECM沉积增加,转化生长因子β1(transforming growth factor,TGF-β1)在这一过程中起关键作用[1]。TGF-β1/Smads信号通路是经典的TGF-β1细胞内传导途径,受多个因素调控。Smad锚着蛋白(Smad anchor for receptor activation,SARA)是TGF-β1/Smad信号通路的衔接蛋白。SARA可呈递Smad2和Smad3至活化的TGF-βⅠ型受体(TβⅠR),促进其磷酸化,介导TGF-β1信号由其受体活化到核转位的过程。已有研究提示SARA可能参与调节上皮细胞转分化及纤维化,但具体机制不详[2]。本研究旨在探讨SARA在高葡萄糖诱导的HK-2细胞ECM沉积中的作用及机制。
材料与方法
材料与试剂DMEM培养基(美国Gibco公司),胰酶(美国Sigma公司),胎牛血清(中国杭州四季青公司),D-葡萄糖(美国Sigma公司),D-甘露醇(美国Sigma公司),小鼠抗人Ⅰ型胶原(CollagenⅠ,ColⅠ)单克隆抗体(英国Abcam公司),兔抗人纤维连接蛋白(FN)多克隆抗体(美国Sigma公司),山羊抗人SARA多克隆抗体(美国Santa Cruz公司),兔抗人SARA多克隆抗体(美国Santa Cruz公司),兔抗人TGF-β1多克隆抗体(美国Cell signaling公司),小鼠抗人Smad2单克隆抗体(美国Santa Cruz公司),兔抗人Smad3抗体(美国Cell signaling公司),兔抗人p-Smad2多克隆抗体(美国milipore公司),兔抗人p-Smad3多克隆抗体(美国R&D公司),小鼠抗人β肌动蛋白(β-actin)单克隆抗体(美国Santa Cruz公司),辣根过氧化物酶标记抗小鼠二抗、抗兔二抗、抗山羊二抗(中国中杉金桥公司),Trizol(美国Invitrogen公司)、组织细胞蛋白裂解液RIPA(北京鼎国生物公司),逆转录试剂盒(RevertAidTM First Strand cDNA Synthesis Kit)(立陶宛Fermentas公司),PCR引物(由上海生物工程公司合成),SYBR Green ER qPCR SuperMix(美国Invitrogen公司),ECL显影剂,PVDF膜(美国Millipore公司)。脂质体2000(美国Invitrogen公司),Opti-MEMⅠ培养基(美国Gibco公司),质粒小提试剂盒(天根生化科技有限公司),高纯度质粒大提试剂盒(天根生化科技有限公司),质粒pCMV5B-FLAG-SARA和pCMV5B-FLAG-SARA dSBD(美国Addgene)。
细胞培养与干预正常人近端肾小管上皮细胞(HK-2细胞)(购自ATCC)使用DMEM+10%FBS培养基,37℃、5%CO2条件下生长。细胞长至80%以上融合时进行消化,调节细胞浓度至1×106/ml接种到六孔培养板。待细胞长至70%~80%融合时进行实验。D-葡萄糖刺激时间的选择:根据文献报道[3],并结合本研究预实验结果,采用30 mmol/L D-葡萄糖作为干预条件。D-葡萄糖刺激0h,24h,48h及72h提取总蛋白和RNA。
质粒转染具体操作参考脂质体2 000说明书进行。质粒转染细胞分组如下:(1)未转染HK-2+5.5 mmol/L葡萄糖(正常对照组,LG);(2)未转染HK-2+30 mmol/L D-葡萄糖(高糖组,HG);(3)转染质粒pCMV5B-FLAG-SARA的HK-2+30 mmol/L D-葡萄糖[高糖组+SARA(WT)组];(4)转染质粒pCMV5B-FLAG-SARA dSBD(敲除SBD结构域)的HK-2+30mmol/L D-葡萄糖[高糖+SARA(dSBD)组]。质粒转染48h后再加高糖(30 mmol/L D-葡萄糖)刺激,高糖刺激48h后提取总蛋白及RNA。
细胞免疫荧光将细胞直接培养于24孔板盖玻片上,同步12h后,进行分组诱导;将孔板中盖玻片上的细胞用PBS快速清洗2次;4%多聚甲醛室温固定15~20 min;PBS清洗3次;0.1%PBST室温孵育3~5 min;PBS清洗3次;加入稀释的一抗后置于37℃恒温摇床上孵育1h(孔间加水保湿);PBS清洗3次;滴加稀释的FITC标记相应二抗,37℃孵育1h;PBS清洗3次;滴加稀释的DAPI;封片剂封片,荧光显微镜下观察并且拍照;阴性对照用PBS代替一抗以排除非特异性的二抗结合。
Western Blot 将HK-2细胞加入100 μl预冷的组织细胞裂解液(使用前加入1∶100的PMSF)冰上裂解30 min。裂解液4℃、12 000 r/min离心10 min,上清移入另一1.5 ml EP管中,用BCA蛋白检测试剂盒测定蛋白浓度。取变性的蛋白20 μg/孔,用相应浓度的SDS-PAGE胶进行电泳。恒压下将蛋白转至PVDF膜,3%牛血清白蛋白封闭2h,分别加入稀释的一抗,37℃孵育2h或4℃过夜。PBST洗膜3次,加入对应的HRP标记IgG,孵育1h。PBST洗膜3次后显影,将PVDF膜固定在Kodak暗箱,Kodak IS4000凝胶成像分析系统曝光扫描并且分析结果,以所测得的各条带的吸光度与内参照β-actin吸光度的比值代表定量值。
实时定量PCR(Real-time PCR) 按Trizol试剂说明书提取不同组HK-2细胞总RNA。按标准步骤进行逆转录,所得cDNA进行Real-time PCR实验。PCR反应总体系25 μl,包括双蒸水9.5 μl,cDNA 2 μl,SYBR green 染料12.5 μl,上下游引物各0.5 μl。引物见表1,引物均由上海生物工程公司合成。反应条件:95℃预变性3 min,随后40循环,包括95℃变性15s,60℃退火并延伸40s。每个基因设3复孔,实验重复3次。采用双ΔCt法计算目的基因表达量,每个样品目的基因表达量除以β-actin表达量即为样品基因相对含量。

表1 各基因引物序列

结 果
高糖诱导HK-2细胞ECM分泌增加Western Blot结果显示,高糖刺激后,HK-2细胞FN表达呈时间依赖性增加,刺激24h后其表达增加,刺激48h后有显著性差异(P<0.01),72h达到高峰,而ColⅠ也有相同的变化(图1A、B)。Real-time PCR检测也提示高糖诱导HK-2细胞ECM中FN和ColⅠα1 mRNA表达水平增加,48~72h其表达量达到高峰,与0h相比有显著性差异(P<0.01)(图1C)。
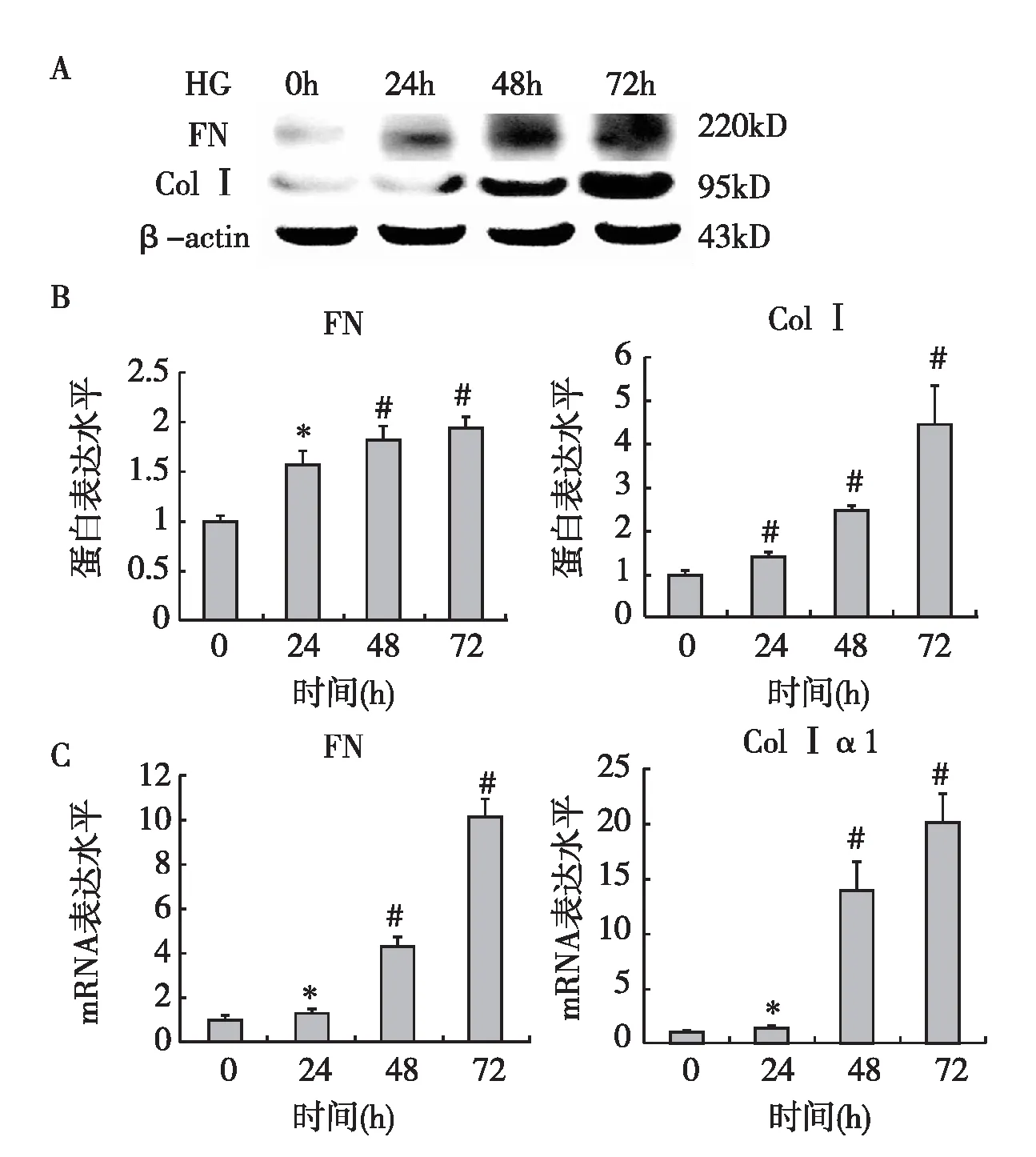
图1 高糖诱导HK-2细胞ECM分泌增加
高糖诱导TGF-β1信号通路活化
高糖诱导TGF-β1表达上调 Western Blot结果显示,高糖刺激后,HK-2细胞TGF-β1表达呈时间依赖性增加,48h有显著性差异(P<0.01),72h时达到高峰(图2A、B)。Real-time PCR结果也提示高糖诱导HK-2细胞TGF-β1mRNA表达上调,呈时间依赖性(图2C)。
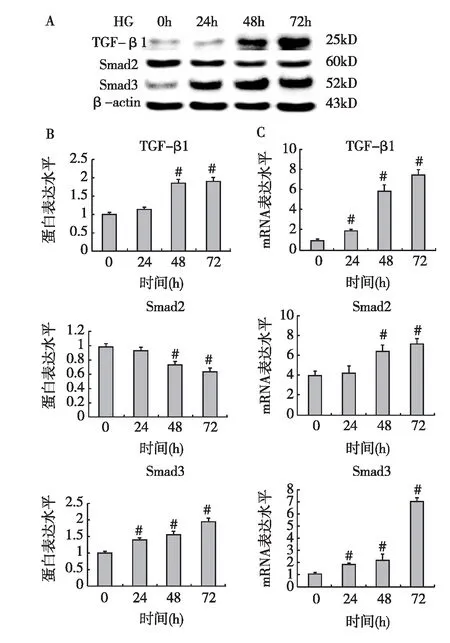
图2 高糖对HK-2细胞TGF-β1、Smad2及Smad3表达水平的影响
高糖诱导Smad2和Smad3表达水平变化 进而检测高糖刺激后Smad2和Smad3的表达变化发现,高糖可诱导HK-2细胞Smad3蛋白表达呈时间依赖性增加,刺激48h后有显著性差异(P<0.01)(图2A、B),Real-time PCR结果亦证实高糖诱导HK-2细胞Smad3 mRNA表达上调(图2C)。而高糖刺激后,HK-2细胞Smad2 mRNA表达升高,与低糖组相比,高糖刺激48h有显著性差异(P<0.01)(图2C),但Smad2蛋白水平呈时间依赖性降低(图2A,B),即Smad2蛋白水平变化与mRNA水平变化不一致。提示高糖诱导HK-2细胞ECM沉积过程中,Smad2和Smad3可能发挥了不同的作用。
高糖诱导HK-2细胞Smad2和Smad3磷酸化Western Blot结果提示,高糖刺激30min后,p-Smad2表达明显增高(P<0.05),持续至60 min,90 min起即下降。高糖刺激30 min起,p-Smad3的表达水平明显增高(P<0.05)并持续至120 min。可见高糖诱导HK-2细胞ECM沉积过程中,TGF-β1信号通路发生活化,且以Smad3的活化为主(图3)。
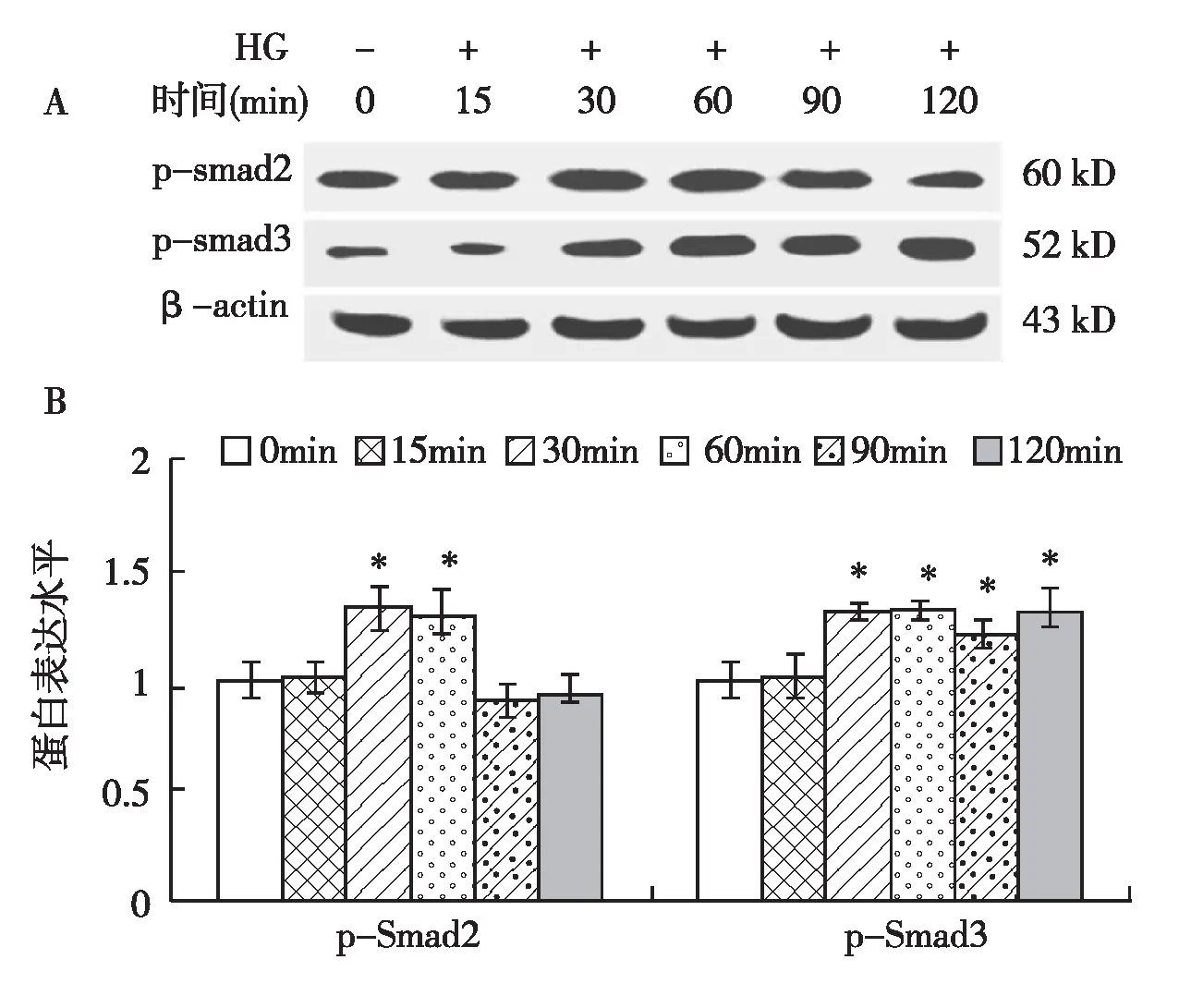
图3 高糖刺激HK-2细胞Smad2和Smad3不同程度的磷酸化
高糖诱导HK-2细胞SARA表达下降细胞免疫荧光结果显示:低糖组HK-2细胞胞质内有均匀、颗粒状的SARA表达,高糖刺激48h后,SARA表达明显下降(图4A)。Western Blot结果显示,高糖刺激后,HK-2细胞SARA表达下调,24h即有显著性差异(P<0.01),48~72h进一步下降(图4B、C)。Real-time PCR检测结果也提示SARA的mRNA表达水平呈时间依赖性下调,24~48h有显著性差异(图4D)。

图4 高糖诱导HK-2细胞SARA表达下降
质粒转染效果鉴定质粒转染48h后提取细胞总蛋白,Western Blot检测SARA的表达。结果显示,SARA(WT)和SARA(dSBD)质粒的HK-2细胞SARA表达较未转染组明显增高(P<0.05),而转染空质粒对SARA的表达无影响(图5)。
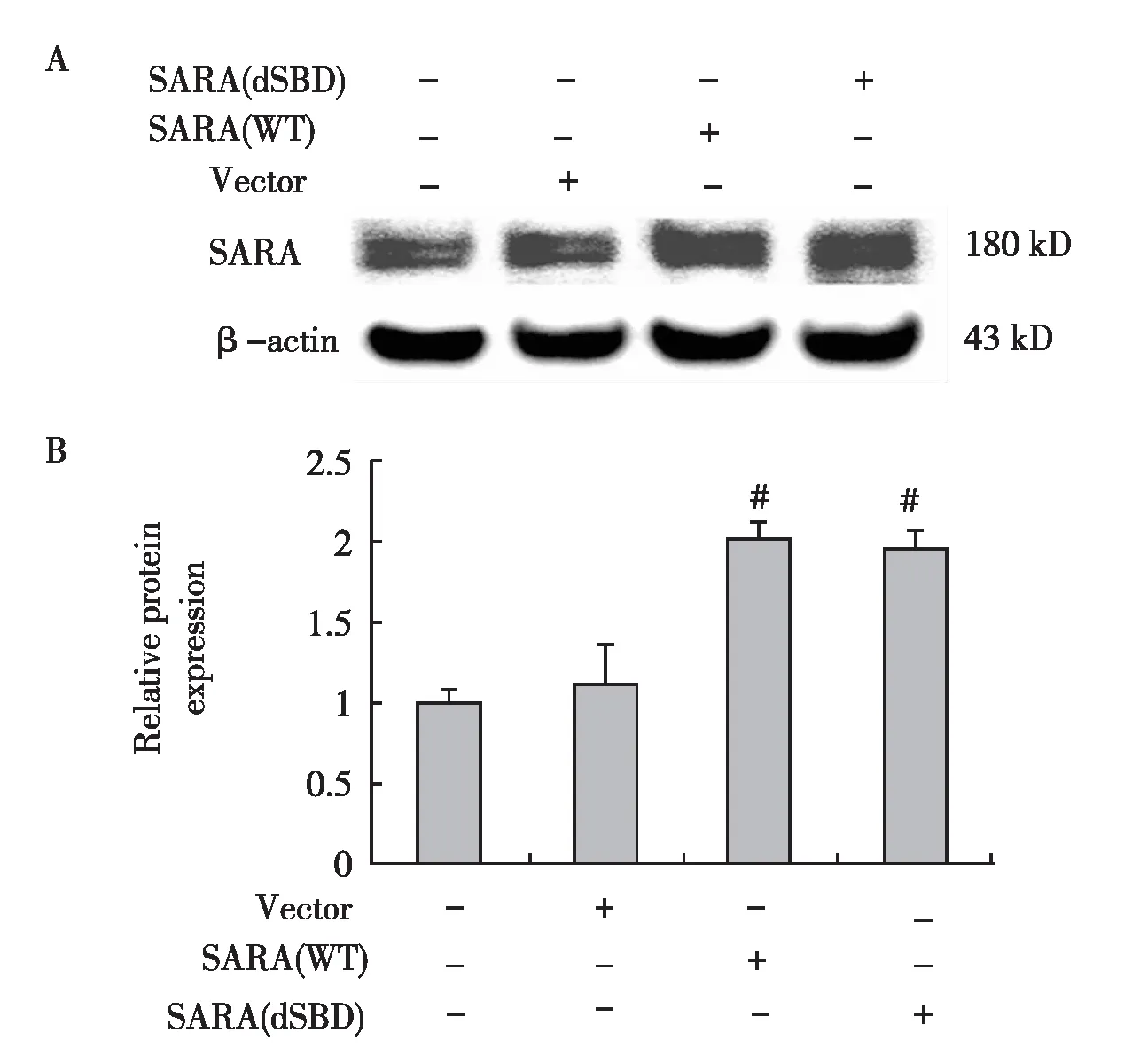
图5 HK-2细胞质粒转染效果鉴定
过表达SARA抑制高糖诱导的HK-2细胞ECM沉积转染质粒SARA(WT)或SARA(dSBD)48h后,再予高糖刺激48h,提取总蛋白及RNA,检测FN、ColⅠ的蛋白及mRNA的表达水平变化。Western Blot结果显示,高糖组FN和ColⅠ蛋白表达水平较低糖组明显上调(P<0.01);高糖+SARA(WT)组FN和ColⅠ蛋白表达较高糖组有明显下调(P<0.05);而高糖+SARA(dSBD)组FN和ColⅠ蛋白表达水平较高糖组无明显变化(P>0.05)(图6A,B)。Real-time PCR结果也提示与高糖组比较,高糖+SARA(WT)组FN和ColⅠα1 mRNA表达水平有所下降(P<0.05),而高糖+SARA(dSBD)组FN和ColⅠα1 mRNA表达水平无明显变化(图6C)。以上结果提示过表达SARA可抑制HK-2细胞ECM沉积,这一效应依赖于SARA的SBD结构域。

讨 论
ECM沉积是DN肾脏纤维化的特征性改变之一。在高糖环境中,尤其是细胞内的高糖可促进肾小球系膜细胞、足细胞、近端肾小管上皮细胞等肥大,并使肾脏多种ECM成分如Ⅰ、Ⅲ、Ⅳ、Ⅵ型胶原、FN及蛋白多糖合成增加。另一方面,高糖可导致ECM降解失常[4]。本研究检测了FN和ColⅠ的蛋白和mRNA表达变化,结果提示高糖可诱导HK-2细胞ECM成分FN和ColⅠ呈时间依赖性增加,mRNA表达变化尤为明显。
TGF-β1是DN发病过程中的核心因子,其他因子可通过调节TGF-β1的生成来影响DN进展[5,6]。糖尿病时TGF-β1及其受体mRNA表达上调[7,8],TGF-β1的受体主要表达在肾小管上皮细胞,成为体内这种促纤维化因子的主要靶细胞。本研究也发现高糖刺激24h,HK-2细胞TGF-β1的mRNA表达明显增高,48~72h后蛋白表达达稳定高值,这与高糖诱导的HK-2细胞ECM沉积相一致,提示TGF-β1在这一过程中发挥了重要的作用。
Smad2、Smad3虽同属R-Smads,是主要的TGF-β1细胞内传导途径,但两者在不同的疾病状态、不同的细胞系表现出不同的变化,发挥不同的功能,Smad3可能是关键的致纤维化因子,而Smad2在转分化及纤维化中的作用一直存在争议[9]。Ju等[10]特异性敲除肝脏细胞的Smad2、Smad3或将两者同时敲除,再构建肝脏纤维化模型发现,敲除Smad2的小鼠表现出更为明显的肝脏纤维化,体外实验也表明敲除Smad2后,肝细胞在TGF-β1的刺激下发生明显的转分化,而敲除Smad3后,可明显抑制TGF-β1诱导的肝细胞的转分化[10]。在本研究中,高糖可诱导HK-2细胞Smad2蛋白表达下调,而Smad3蛋白和mRNA水平上调。提示Smad3可能作为主要的促进因子参与了高糖诱导的HK-2细胞ECM沉积,而Smad2的下降打破了两者的平衡,促进了HK-2细胞ECM沉积的进展。更有意思的是,我们发现高糖刺激后Smad2的mRNA表达水平上调,而其蛋白水平下降,提示存在转录后调控机制调控了Smad2的蛋白表达。目前研究认为泛素蛋白酶体通路成员Smurf2可与Smad2结合,使其发生泛素化降解[2]。我们推测其他转录后调控机制如某些microRNA分子也可能参与调节Smad2,具体机制有待进一步研究阐明。
SARA是TGF-β1信号通路中重要的衔接蛋白,近年来在TGF-β1/Smad通路中的调控作用逐渐被重视。已有研究提示SARA可能与EMT及纤维化相关。Tao等[11]研究发现,肝纤维化时SARA的表达水平与TGF-β1及α平滑肌肌动蛋白呈负相关,即肝脏纤维化时SARA表达水平会下降。在体外肝脏星形细胞转分化的过程中,SARA主要表达于静止的肝脏星形细胞,而非活化的肝脏星形细胞[12]。近期有研究者发现,SARA可维持上皮细胞的形态,表达降低后可引起上皮细胞转分化[2]。本研究中,我们用细胞免疫荧光检测了SARA在HK-2细胞中的表达,发现高糖可明显抑制SARA的表达。Western Blot和Real-time PCR进一步证实其表达水平呈时间依赖性降低,与高糖诱导HK-2细胞ECM分泌呈负相关。结果提示SARA可能作为一种保护因子参与调控高糖诱导的HK-2细胞ECM沉积过程。过表达SARA可抑制高糖诱导的HK-2细胞ECM分泌,而转染SARA(dSBD)无此效应。结果提示SARA的SBD结构域在其调节高糖诱导的HK-2细胞ECM分泌的过程中起关键作用。
SARA在细胞内可直接与Smad2相结合,调节Smad2的细胞内定位,使其被活化的TGF-β1受体激活,介导TGF-β1信号通路的转导[13]。SBD结构域是介导SARA与Smad2/3直接结合的关键结构域。本研究发现高糖刺激后SARA表达下降,提示SARA与Smad2的蛋白表达变化相一致,而与Smad3的表达变化相反。最新的研究表明SARA的下调可促进了Smad2与Smurf2的结合,从而导致Smad2的泛素化降解增加[2],因此我们认为上调SARA可能减少了Smad2的泛素化降解,而使其蛋白表达水平升高,从而维持Smad2和Smad3表达水平的相对平衡,进而抑制了HK-2细胞ECM的分泌。敲除SBD结构域后,SARA不能与Smad2结合,因此对高糖介导的HK-2细胞ECM分泌无影响。
小结:我们认为在高糖诱导的HK-2细胞ECM沉积过程中,SARA的表达下调,可能通过降低Smad2的蛋白表达,从而促进TGF-β1信号通路的活化,导致HK-2细胞ECM沉积增加。过表达SARA可能上调Smad2的蛋白表达,从而抑制TGF-β1信号通路传导,抑制HK-2细胞ECM分泌。SARA通过其SBD结构域与Smad2结合,发挥以上的调节作用。目前并不清楚高糖通过何种机制介导SARA的表达下调,可能SARA的启动子序列中存在高糖及高糖相关的细胞因子的调控位点,也可能存在转录后水平的调控,具体机制有待进一步探索。
1 Lan HY.TGF-β/smad signaling in diabetic nephropathy.Clin Exp Pharmacol Physiol,2011.
2 Runyan CE,Hayashida T,Hubchak S,et al.Role of sara (SMAD anchor for receptor activation) in maintenance of epithelial cell phenotype.J Biol Chem,2009,284(37):25181-25189.
3 Holian J,Qi W,Kelly DJ,et al.Role of kruppel-like factor 6 in transforming growth factor-beta1-induced epithelial-mesenchymal transition of proximal tubule cells.Am J Physiol Renal Physiol,2008,295(5):F1388-1396.
4 Song Y,Li C,Cai L.Fluvastatin prevents nephropathy likely through suppression of connective tissue growth factor-mediated extracellular matrix accumulation.Exp Mol Pathol,2004,76(1):66-75.
5 Pantsulaia T.Role of TGF-beta in pathogenesis of diabetic nephropathy.Georgian Med News,2006,(131)13-18.
6 Hoffman BB,Sharma K,Ziyadeh FN.Potential role of TGF-beta in diabetic nephropathy.Miner Electrolyte Metab,1998,24(2-3):190-196.
7 Shankland SJ,Scholey JW,Ly H,et al.Expression of transforming growth factor-beta 1 during diabetic renal hypertrophy.Kidney Int,1994,46(2):430-442.
8 Riser BL,Ladson-Wofford S,Sharba A,et al.TGF-beta receptor expression and binding in rat mesangial cells:Modulation by glucose and cyclic mechanical strain.Kidney Int,1999,56(2):428-439.
9 Wang W,Koka V,Lan HY.Transforming growth factor-beta and smad signalling in kidney diseases.Nephrology (Carlton),2005,10(1):48-56.
10 Ju W,Ogawa A,Heyer J,et al.Deletion of smad2 in mouse liver reveals novel functions in hepatocyte growth and differentiation.Mol Cell Biol,2006,26(2):654-667.
11 Tao YY,Cui HY,Liu CH.[Dynamic characteristics of SARA during liver fibrogenesis in rats].Zhonghua Gan Zang Bing Za Zhi,2006,14(12):909-913.
12 Liu C,Gaca MD,Swenson ES,et al.Smads 2 and 3 are differentially activated by transforming growth factor-beta (TGF-beta) in quiescent and activated hepatic stellate cells.Constitutive nuclear localization of smads in activated cells is TGF-beta-independent.J Biol Chem,2003,278(13):11721-11728.
13 Tsukazaki T,Chiang TA,Davison AF,et al.SARA,a FYVE domain protein that recruits smad2 to the TGFbeta receptor.Cell,1998,95(6):779-791.
