高截留量透析治疗多发性骨髓瘤:个案报道
2012-07-10龚德华季大玺张凯悦黄湘华黄高渊刘志红
龚德华 季大玺 张凯悦 黄湘华 黄高渊 徐 斌 刘志红
管型肾病是多发性骨髓瘤(MM)导致肾功能损害的一个主要原因。而肾功能损害,特别是长期需要依赖透析的患者较非透析患者预后差[1-2]。因此寻找能改善患者肾功能、促使患者摆脱透析的有效方法,对改善患者预后有重要意义[2]。目前认为,管型肾病的致病机制在于:血清中过高的游离轻链(FLC)经肾小球滤过后超过肾小管重吸收能力,小管液中大量FLC蛋白与肾小管上皮分泌的Tamm-Horsfall糖蛋白形成管型并堵塞肾小管,从而造成肾功能损害。理论上讲,采用血液净化方法从循环中清除FLC将可能减轻肾损害及促进肾功能恢复。由于轻链κ、λ单体分子量为22.5 kDa,且后者常以二聚体形式存在,其分子量远超过一般普通透析器/滤器的有效清除溶质分子量(<20 kDa),因此常规血液透析(HD)/血液滤过(HF)无法清除。血浆置换虽可清除FLC,但其交换容量有限(1~1.5倍血浆容量),而FLC分布容积较大,其清除亦无法达到有效降低血清FLC水平的目的[3-5]。近年来国际新推出的一种方法,即采用高截留量透析器/滤器(分子截留量45 kDa)行延长透析(HCO-HD),可有效清除血清FLC,结合有效化疗,可显著降低患者血清FLC水平,可能促进患者肾功能恢复[6-8]。本单位采用HCO-HD治疗1例MM导致管型肾病的患者,有效清除了FLC,但患者透析后体温升高伴高内毒素血症,现报告如下。
对象和方法
病例资料患者女性,52岁,因“恶心、呕吐2月,发现血清肌酐(SCr)升高1月”于2011年12月收住南京军区南京总医院肾脏病研究所。患者血压正常,尿量2 000~4 000 ml/d,入院检查结果示:血红蛋白100 g/L,血小板计数142×109/L,白蛋白39.6 g/L,球蛋白21.1 g/L,尿素氮15.8 mmol/L,SCr 527.1 μmol/L,血清FLC κ 10.21 mg/L、λ 6 862 mg/L,尿FLC κ 8.21 mg/L、λ 2 612 mg/L,B超示双肾大小正常。入院后经骨髓穿刺诊断为MM,结合临床诊断为管型肾病。患者在明确诊断后即予沙度利胺联合VAD (长春新城+表阿霉素+地塞米松)方案化疗。在开始化疗第4天接受HCO-HD治疗。
HCO-HD方案患者采用右侧颈内静脉留置双腔导管作血管通路,采用Fresenius 4008s ARrT plus机器(Fresenius Medical Care AG.& Co.Germany)、HCO2100透析器(Theralite,2.1m2,cutoff 45 kDa,Gambro Dialysatoren,Hachungen,Germany)行HD治疗,8 h/次,2次/周,共6次。透析超滤量设定为500~800 ml/次,治疗中补充人体白蛋白液20 g/次。体外循环采用低分子肝素抗凝,首量4 000U,维持量200 U/h,保证活化凝血时间延长至200s,透析结束时透析器凝血中度以下。血流量200 ml/min,透析液流量在前4次设定为500 ml/min,后两次设定为200 ml/min。透析液钾浓度根据患者血钾水平调整,设定3~3.5 mmol/L。患者前3次透析采用普通透析液(美国AAMI内毒素<2 EU/ml,细菌<200 CFU/ml,中国标准YY05722 内毒素<1 EU/ml,细菌<100 CFU/ml),因透析后体温升高,于第4次始改为超纯净透析液(美国ANS/AMMI标准 内毒素<0.03 EU/ml,细菌<0.1 CFU/ml)。超纯透析液制备方法:双级反渗水供给,透析液B浓缩液采用无菌干粉,同时在透析液进入透析器前加用细菌过滤器处理。
标本采集患者在每次治疗前后采血;治疗中第10 min、4h同时留取滤器动脉端、透析液废液端标本;及按透析液流量比例2%匀速收集透析液废液。标本送检血生化,及测定FLC κ、λ水平。在第3及4次透析前、后采血,并于透析中取透析液入口处透析液送检测定内毒素水平。
计算公式
血清清除率(CL,ml/min)=(Ce/Cb)×Qd
下降率(RR,%)=(1-Cpost/Cpre)×100%
清除量(g/次)=Cet×Qd×8×60
尿素清除指数(Kt/V)=-ln(Cpost/Cpre-0.008t)+(4-3.5×Cpost/Cpre)×UF×Wt
其中Ce、Cb分别为透析液废液、滤器前动脉端血液浓度,Qd:透析液流量;Cpre、Cpost分别为单次治疗前后血液浓度;Cet:治疗结束透析液总废液浓度;t:治疗时间,UF:净脱水量,Wt:透析后体重。
结 果
一般情况患者3周内共顺利完成6次治疗HCO-HD,血压、心率平稳。血清FLC λ水平从治疗前4 689 mg/L降至492.7 mg/L,(图1)。患者尿量维持在2 000~4 000 ml/d无明显变化,SCr有下降趋势,波动于323~413 μmol/L,暂时不需依赖维持透析,血常规及血浆蛋白水平亦无明显变化(表1)。
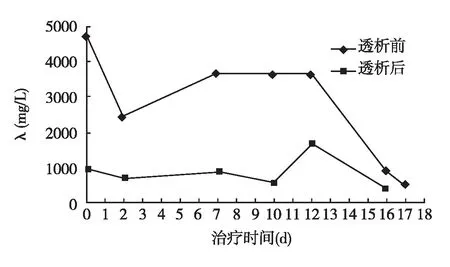
图1 透析前后患者血清λ链的变化
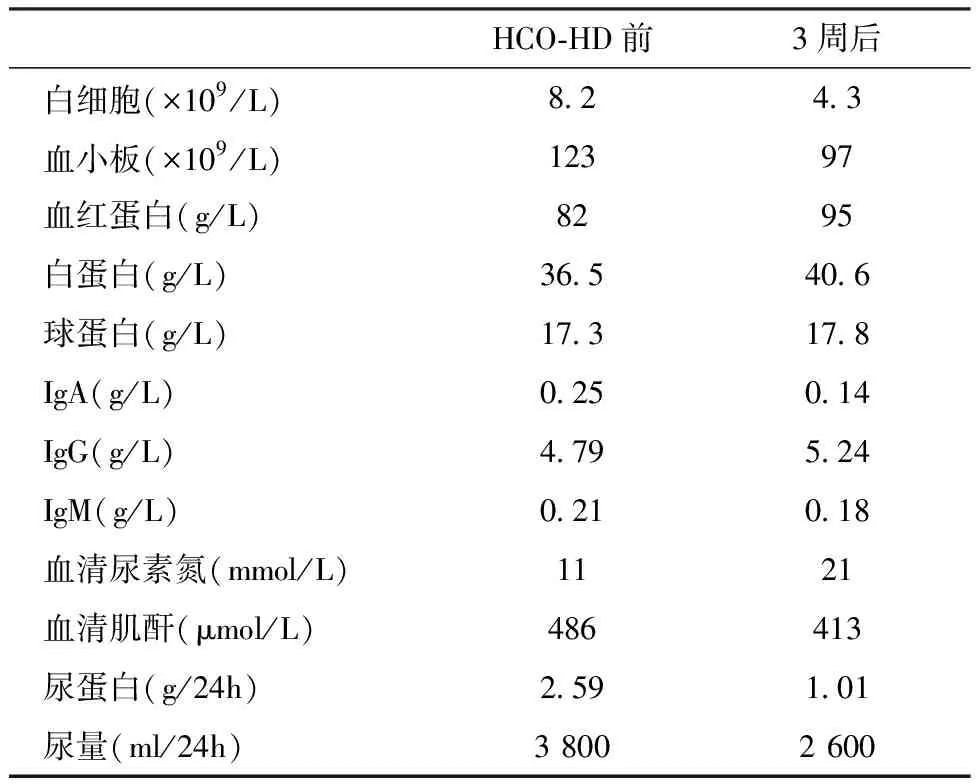
表1 治疗前后患者实验室检查结果
透析对患者体温的影响患者前3次采用普通透析液透析治疗。透析液内毒素水平0.112~0.145 EU/ml,透析后患者出现体温升高,最高达38.5℃,第3次透析检测血液内毒素水平发现,透析前<0.03 EU/ml,透析后0.122 EU/ml。第4次改为超纯透析液透析(透析液内毒素水平0.03 EU/ml),透析后体温升高现象明显缓解,此后血液内毒素水平无升高(表2)。
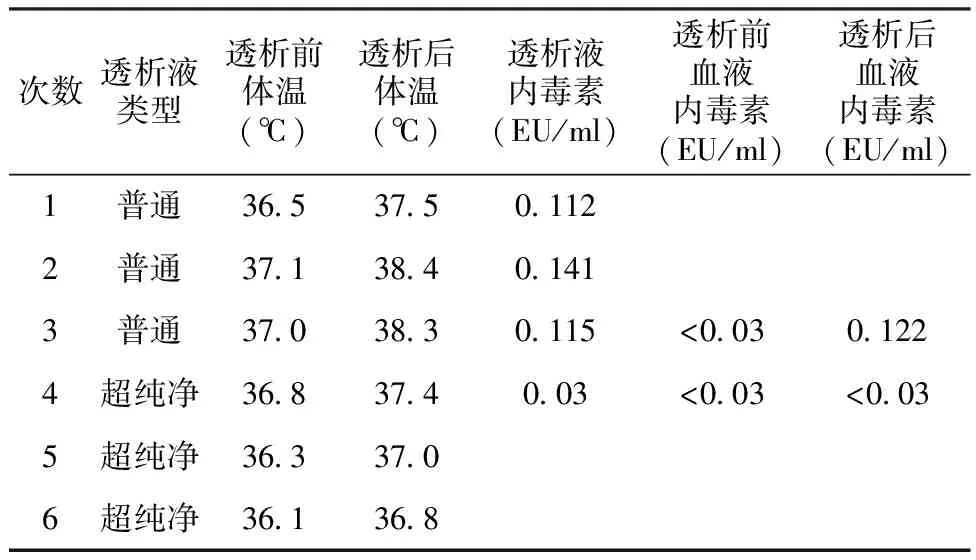
表2 高截留量透析时不同透析液对患者体温及血液内毒素水平的影响
透析液流量对FLC清除的影响由于透析液废液中FLC κ浓度低于检测范围,未计算其清除率。透析液流量500 ml/min时,治疗10 min时FLC λ清除率平均38.4 ml/min,至第4小时降至25.8 ml/min;白蛋白清除率也从治疗10 min时的6.0 ml/min降至1.3 ml/min。透析液流量200 ml/min时FLC λ清除率及白蛋白清除率明显低于透析液流量500 ml/min (图2、3)。
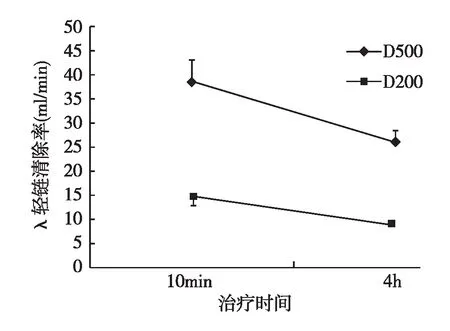
图2 透析液流量对血清λ轻链清除率的影响
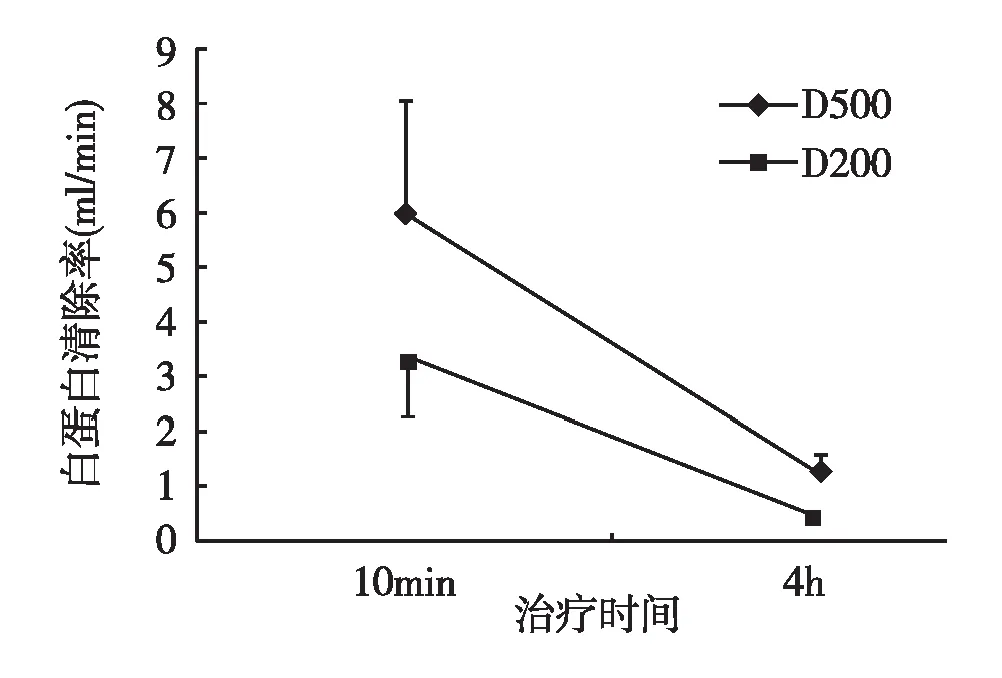
图3 透析液流量对血清白蛋白清除率的影响
透析液流量500 ml/min时,单次治疗清除FLC λ 9.06~18.02g;透析液流量200 ml/min时清除量为1.16g和6.6g。由于单次清除量与治疗前水平密切相关,本文计算了单次清除量/治疗前浓度比值[g/(g·L-1)],结果显示500 ml/min透析液流量时比值为2.46~4.54,而200 ml/min透析液流量时比值为1.58和1.81。透析液流量500 ml/min时白蛋白丢失量为25.7~28.0 g/次,200 ml/min时为12.7 g/次和14.6 g/次(表3)。

表3 单次高截留量透析治疗对轻链及白蛋白的清除量
透析液流量500 ml/min时,单次透析FLC λ下降率为71.0%~85.2%;透析液流量为200 ml/min时,FLC λ下降率为47.2%~53.8%。由于流量500 ml/min时白蛋白丢失量>25g,而每次补充量为20g,因此透析后血清白蛋白出现下降;而流量200 ml/min时白蛋白丢失量<15g,同样补充量透析后血清白蛋白出现上升。由于患者FLC κ水平正常,透析后较低,甚至低于检测范围,有2次透析后κ轻链下降率无法计算(表4)。
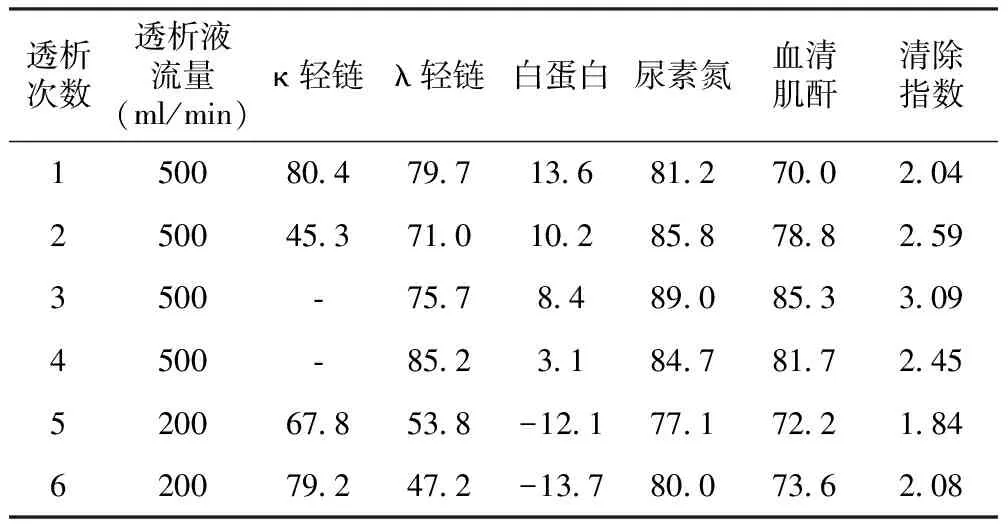
表4 单次高截留量透析治疗血清成分的下降率(%)
讨 论
普通HD由于所采用的透析器膜孔径限制,一般只能清除分子量<20 kDa的溶质,而对于一些分子量相对较大的物质,如肌红蛋白、一些细胞因子(肿瘤坏死因子α)及轻链蛋白则清除效果差。为提高这些物质的清除率,一方面可研制特异性吸附装置,另一方面可通过增大透析器膜孔径来实现。由于这些物质分子量与白蛋白较接近,因此增大膜孔径增加物质清除的同时还需避免过多白蛋白的丢失。近年来满足此要求的透析器已问世并应用于临床,通常称为高截留量或超高通量透析器。高截留量透析器的临床使用包括横纹肌溶解综合征所致的高肌红蛋白血症,炎症反应所致的高细胞因子血症及MM所致高轻链血症[10-16]。
HCO-HD治疗MM高轻链血症所致管型肾病及相关急性肾损伤最早于2007年由Hutchison报道[8]。该作者随后发表了系列文章,研究HCO-HD对轻链清除率的影响因素及轻链清除对临床预后的影响[6,7],并于2008年发起一项多中心的前瞻性随机对照研究,观察HCO-HD对MM所致管型肾病的治疗作用,目前此项研究正在进行中[17]。现有的一些临床病例观察研究初步显示,早期HCO-HD结合化疗如能有效降低患者血清轻链水平,与患者肾功能恢复率及摆脱透析几率相关[13,18,19]。本文报道此例患者经HCO-HD结合化疗,3周内使患者血清FLC λ降低92.8%,肾功能亦有部分恢复。本文观察到λ轻链清除率治疗开始时为38.4 ml/min,4h降至25.8 ml/min,降幅达32.8%。此清除率水平高于Hutchison等[6,7]报道采用一个HCO1100(面积1.1m2)透析时清除率(15.3 ml/min),与串联采用两个HCO1100透析器时清除率相当(35 ml/min)。治疗过程中清除率的下降,包括对白蛋白清除率,也见于其他报道[6,7]。导致这种现象的原因可能与透析中蛋白膜的形成及部分纤维堵塞导致的膜通透性下降及有效面积减少有关。更换透析器可能避免这一问题。但Hutchison等[7]报道了一种奇怪的现象,更换透析器确可增加FLC λ的清除率,但对FLC κ的清除率反而下降。该作者还研究了影响清除率的因素,包括增加透析器面积、增加对流及延长时间。本文通过一个病例的观察,显示透析液流量对清除率影响亦较大,发现透析液流量500 ml/min时的清除率几乎是200 ml/min时的3倍,单次治疗下降率亦高出其近50%。这一点提示我们,在行HCO-HD时是否可进一步提高透析液流量以增加清除率。值得注意的是,随着透析液流量增加,白蛋白丢失亦相应增加,其补充量也应增加,否则会出现血清白蛋白水平的下降。
采用HCO-HD治疗可能会带来一些临床的实际问题,如采用正常透析液流量、延长透析时间会导致小分子毒素降幅过大,有出现失衡综合征的风险。本研究显示,单次治疗尿素下降达81.2%~89.0%,Kt/V值亦>2.0。由于本例患者治疗前尿素水平升高并不严重,因此患者未出现相关并发症。Hutchison等[8]提出了采用类似HD诱导透析的方式,即HCO-HD首次时间从2h开始,逐步延长,以避免失衡综合征的出现。而我们认为采用此种方法成本太大,如患者氮质血症水平高,可先采用HD诱导透析几次使其下降后再开始正常HCO-HD治疗。
HCO-HD另一可能问题是透析液内毒素进入血液的风险。常规透析液并非无菌、无致热源,一般标准要求透析液内毒素<2 EU/ml,透析过程中可能通过反超及反弥散进入血液。普通透析器膜孔径较小可起阻挡作用,同时膜的外层吸附作用亦可阻挡部分内毒素。透析中如超滤率设定较大,形成透析器膜内正压,膜外负压,亦可避免反超滤所致内毒素进入血液的问题[20-24]。即使如此,已有很多研究报道普通透析内毒素进入血液带来的问题[25-30]。而HCO-HD由于所用透析器膜孔径增大,同时治疗时间延长,所需超滤率设定相对较小,大大增加了透析液内毒素进入血液的可能。本研究观察到,透析液内毒素水平在0.1 EU/ml左右时,透析结束患者血液内毒素水平升至0.122 EU/ml,且临床观察到患者体温升高;而换用超纯净透析液后,上述情况消失。在其他作者关于HCO-HD临床应用的研究中尚未关注此类问题。在此,我们建议HCO-HD应采用超纯透析液[31,32]。
综上所述,本文虽是一例MM合并管型肾病采用HCO-HD联合化疗的经验报道,也清晰地证实了HCO-HD清除及降低血清FLC的有效性,并观察到不同透析液流量对其清除效果的影响。更重要的是观察到采用常规透析液所带来患者透析后体温升高及高内毒素血症的问题,并提出HCO-HD应采用超纯透析液的建议。目前HCO-HD临床应用除有待循证医学证据进一步证实外,还有一些技术性问题,如影响清除率因素及如何避免透析失衡综合征的问题,有待进一步研究。
1 Wirk B.Renal failure in multiple myeloma:a medical emergency.Bone Marrow Transplant,2011,46(6):771-783.
2 Katagiri D,Hagiwara S,Minami E,et al.Factors associated with recovery of renal function in patients with multiple myeloma who were treated with hemodialysis.Nephron Clin Pract,2011,117(1):c28-32.
3 Gakhar B,Kobrin S,Berns JS.Extracorporeal treatment of cast nephropathy.Semin Dial,2011,24(1):9-11.
4 Cserti C,Haspel R,Stowell C,et al.Light-chain removal by plasmapheresis in myeloma-associated renal failure.Transfusion,2007,47(3):511-514.
5 Mahmood A,Sodano D,Dash A,et al.Therapeutic plasma exchange performed in tandem with hemodialysis for patients with M-protein disorders.J Clin Apher,2006,21(2):100-104.
6 Hutchison CA,Bradwell AR,Cook M,et al.Treatment of acute renal failure secondary to multiple myeloma with chemotherapy and extended high cut-off hemodialysis.Clin J Am Soc Nephrol,2009,4(4):745-754.
7 Hutchison CA,Harding S,Mead G,et al.Serum free-light chain removal by high cutoff hemodialysis:optimizing removal and supportive care.Artif Organs,2008,32(12):910-917.
8 Hutchison CA,Cockwell P,Reid S,et al.Efficient removal of immunoglobulin free light chains by hemodialysis for multiple myeloma:in vitro and in vivo studies.J Am Soc Nephrol,2007,18(3):886-895.
9 Daugirdas JT.Second generation logarithmic estimates of single-pool variable volume Kt/V:an analysis of error.J Am Soc Nephrol,1993,4(5):1205-1213.
10 Sorrentino SA,Kielstein JT,Lukasz A,et al.High permeability dialysis membrane allows effective removal of myoglobin in acute kidney injury resulting from rhabdomyolysis.Crit Care Med,2011,39(1):184-186.
11 Gondouin B,Hutchison CA.High cut-off dialysis membranes:current uses and future potential.Adv Chronic Kidney Dis,2011,18(3):180-187.
12 Xie HL,Ji DX,Hu WX,et al.Crush syndrome after the Wenchuan earthquake:new experience with regional citrate anticoagulation continuous veno-venous hemofiltration.Int J Artif Organs,2010,33(2):114-122.
13 Kleeberg L,Morgera S,Jakob C,et al.Novel renal replacement strategies for the elimination of serum free light chains in patients with kappa light chain nephropathy.Eur J Med Res,2009,14(2):47-54.
14 Haase M,Bellomo R,Baldwin I,et al.Beta2-microglobulin removal and plasma albumin levels with high cut-off hemodialysis.Int J Artif Organs,2007,30(5):385-392.
15 Haase M,Bellomo R,Baldwin I,et al.Hemodialysis membrane with a high-molecular-weight cutoff and cytokine levels in sepsis complicated by acute renal failure:a phase 1 randomized trial.Am J Kidney Dis,2007,50(2):296-304.
16 Morgera S,Slowinski T,Melzer C,et al.Renal replacement therapy with high-cutoff hemofilters:Impact of convection and diffusion on cytokine clearances and protein status.Am J Kidney Dis,2004,43(3):444-453.
17 Hutchison CA,Cook M,Heyne N,et al.European trial of free light chain removal by extended haemodialysis in cast nephropathy (EuLITE):a randomised control trial.Trials,2008,9:55.
18 Peters NO,Laurain E,Cridlig J,et al.Impact of free light chain hemodialysis in myeloma cast nephropathy:a case-control study.Hemodial Int,2011,15(4):538-545.
19 Heyne N,Denecke B,Guthoff M,et al.Extracorporeal light chain elimination:high cut-off (HCO) hemodialysis parallel to chemotherapy allows for a high proportion of renal recovery in multiple myeloma patients with dialysis-dependent acute kidney injury.Ann Hematol,2012,91(5):729-735.
20 Ward RA.Quality management of dialysis fluid for online convective therapies.Contrib Nephrol,2011,168:78-88.
21 Suzuki H,Honda H,Kato N,et al.Assessment of inflow of endotoxin and its fragments in patients on maintenance hemodialysis.Blood Purif,2011,31(4):268-275.
22 Schiffl H.High-flux dialyzers,backfiltration,and dialysis fluid quality.Semin Dial,2011,24(1):1-4.
23 Kashiwagi T,Sato K,Kawakami S,et al.The performance evaluation of endotoxin retentive filters in haemodialysis.J Nihon Med Sch,2011,78(4):214-223.
24 Isakozawa Y,Takesawa S,David V.Endotoxin and bacterial level of dialysate fluid quality.Contrib Nephrol,2011,173:70-75.
25 Feroze U,Kalantar-Zadeh K,Sterling KA,et al.Examining Associations of Circulating Endotoxin With Nutritional Status,Inflammation,and Mortality in Hemodialysis Patients.J Ren Nutr,2012,22(3):317-326.
26 Tao J,Sun Y,Li X,et al.Conventional versus ultrapure dialysate for lowering serum lipoprotein(a) levels in patients on long-term hemodialysis:a randomized trial.Int J Artif Organs,2010,33(5):290-296.
27 Tomo T,Shinoda T.Standardization of water purification in the central dialysis fluid delivery system:validation and parametric method.Blood Purif,2009,27 (Suppl 1):36-40.
28 Ledebo I.Purification of dialysis fluid:historical background and perspective.Blood Purif,2009,27 (Suppl 1):17-19.
29 Honda H,Suzuki H,Hosaka N,et al.Ultrapure dialysate influences serum myeloperoxidase levels and lipid metabolism.Blood Purif,2009,28(1):29-39.
30 Henrie M,Ford C,Andersen M,et al.In vitro assessment of dialysis membrane as an endotoxin transfer barrier:geometry,morphology,and permeability.Artif Organs,2008,32(9):701-710.
31 Masakane I.Review:Clinical usefulness of ultrapure dialysate—recent evidence and perspectives.Ther Apher Dial,2006,10(4):348-354.
32 Bommer J,Jaber BL.Ultrapure dialysate:facts and myths.Semin Dial,2006,19(2):115-119.
