序贯酶消化法分离培养大鼠髓核细胞*
2012-07-09罗元一殷嫦嫦
罗元一 殷 明 殷嫦嫦
(1南昌大学第二附属医院 江西南昌 330006;2九江学院基础医学院 江西九江 332000)
椎间盘退变是临床上引起腰腿痛的常见原因,至今其发生的具体机制尚不十分清楚[1]。目前研究表明髓核内蛋白多糖含量的减少是椎间盘退变的共同特征,即蛋白多糖合成与分解的平衡失调可能是引起椎间盘退变的关键病理生理改变[2]。髓核细胞 (Nucleus pulposus cells,NPCs)对维持正常椎间盘内环境以及修复退变的椎间盘有非常重要的作用[3]。对髓核细胞结构、功能、代谢以及增值凋亡的研究有利于阐明椎间盘退变的发生、发展的具体机制。本实验采用序贯酶消化法分离培养NPCs,并观察细胞的黏附、增殖及形态改变,旨在建立一种成熟、有效的NPCs体外培养体系,为后续研究椎间盘退变的机制提供细胞模型。
1 材料与方法
1.1 材料
健康的250g左右大小SD大鼠3只,雌雄不限,由南昌大学动物科学部提供。
1.2 主要试剂和仪器设备
DMSO、0.25%胰蛋白酶 (含 EDTA)、MTT粉剂、PBS粉剂,DMEM(含双抗),胎牛血清(Solarbio公司),96孔板 (CORNING公司),倒置相差显微镜及拍照系统 (NIKON公司),37℃恒温培养振荡器 (上海苏坤实业有限公司),酶标仪 (Model680)(BIO-RAD公司),CO2恒温孵育箱 (SIM公司),超净工作台 (苏州净化设备有限公司)。
1.3 方法
1.3.1 NPCs分离培养 将健康的250g左右大小SD大鼠3只采用颈椎脱臼法处死,75%酒精浸泡5~10min,转入超净台内,在无菌条件下取下大鼠胸腰段脊柱,彻底清除脊柱周围肌肉组织,暴露脊柱之间的椎间盘组织,用小尖刀小心划开纤维环,取出白色胶冻样髓核组织,PBS液反复漂洗,洗去污物及血渍,将髓核组织用眼科剪剪成约1mm3的小碎块,移入离心管中,0.25%胰蛋白酶在37℃恒温振荡器中振荡消化30min,1000rpm离心5min,弃消化液,用PBS液漂洗2次,每次1000rpm离心5min,弃离心液,2mg/mLⅡ型胶原酶重悬离心碎块组织后在37℃恒温振荡器中振荡消化2h,每15min摇动1次,1000rpm离心5min,弃消化液,用PBS液漂洗2次,每次1000rpm离心5min,弃离心液,加入含10%FBS的DMEM培养基7mL吹打重悬成细胞悬液,接种于100mL培养瓶中,置于37℃、5%CO2、饱和湿度培养箱中培养,3d后首次半量更换培养基,去除漂浮在培养基中的组织块,以后每3d换液1次,第12d左右传代。
1.3.2 NPCs传代培养及纯化 倒置相差显微镜下观察细胞,当细胞铺满瓶底接近80~90%时进行传代。弃培养基后,用PBS漂洗2遍。0.25%胰酶液1.5mL消化贴壁细胞,镜下见贴壁细胞变圆且有小部分细胞开始脱落时加入同等量含10%FBS的培养液终止消化。5mL移液管反复吹打后,移至无菌离心管中。以1000r/min的转速离心5min,弃上清夜,10%FBS的DMEM培养基6mL重悬细胞,按1:3传代,倒置相差显微镜下观察发现,细胞在换液和传代过程中逐渐纯化。
1.3.3 MTT法绘制P3代NPCs生长曲线 取传代培养的P3代细胞用0.25%胰酶消化,收集液体于离心管中,以1 000r/min的转速离心5min,弃上清液,加入含10%FBS的DMEM培养基5mL重悬成单细胞悬液。细胞计数板上细胞计数,调整细胞浓度约为1×104/mL,用加样器移入96孔培养板中,每孔200μL,置于培养箱中培养。设空白孔对照,每 3d换液次,分别于 24h、4d、7d、10d、13d、16d各取一块96孔培养板每孔加入MTT溶液 (5mg/mL)20μL,再培养4h后,弃孔内上清液,每孔加入 DMSO 150μL,摇匀振荡10min,使结晶物充分溶解,在酶标仪上选择490nm波长检测各孔吸光值,记录结果。以时间(d)为横轴,吸光度 (A)为纵轴绘制细胞生长曲线。[4]
1.3.4 细胞观察 倒置相差显微镜在100倍视野下观察NPCs的贴壁黏附、增殖及形态学变化。
1.3.5 统计学分析 数据由SPSS 18.0软件统计处理,结果以平均值±标准差 (±s)表示。
2 结果
2.1 细胞形态观察结果
原代培养第3d半量换液后见少量贴壁细胞,部分呈多边形,部分呈长梭形,周围散在少量圆形细胞 (图1A),贴壁细胞轮廓清晰,细胞增殖较慢,细胞形态并不完全一致;第6d细胞呈典型的三角形、多角形、多边形 (图1B);第10d细胞呈漩涡状、岛状、集落样生长,细胞存在少量间隙,(图1C);第12d细胞间紧密排列,铺满瓶底达80~90%(图1D)。传第1代细胞在90min后开始贴壁,8h后完成贴壁,与原代细胞相比长梭形细胞数量明显减少,生长较均匀,不规则三角形、多角形、四边形、多边形细胞数量明显增多,经5~6d生长静止期后呈出现呈对数增长趋势,10d左右铺满瓶底达70~80%,12d左后铺满瓶底达80~90%,呈典型的多边形、多角型生长,细胞形态较一致 (图1E)。从传3代以后细胞开始出现衰老、退变迹象,细胞贴壁时间缓慢约3h,细胞增殖速度较慢,铺满瓶底达80~90%约15d左右,细胞间隙增大,细胞质内出现颜色较深的颗粒,细胞碎片增多 (图1F)。
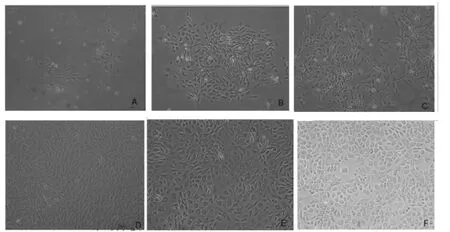
图1 细胞培养形态图片
2.2 P3代细胞生长曲线
NPCs在接种后7d内增殖相对缓慢,第7~13d生长曲线近似成线性曲线,表明这段时间细胞成对数生长,处于对数生长期,第13d后曲线逐渐变得平缓,细胞增殖速率明显减慢,处于平台期。
在酶标仪上选择490nm波长检测各孔吸光值,以时间 (d)为横轴,吸光度 (A)为纵轴绘制P3代细胞生长曲线,见图2。
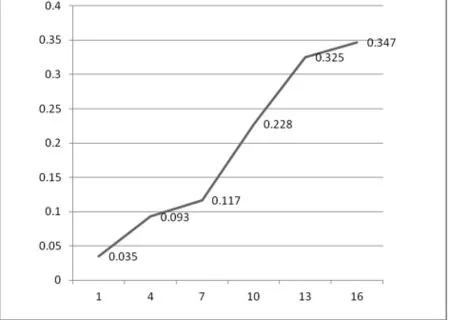
图2 P3代细胞生长曲线图
3 讨论
椎间盘退变引起的一系列脊柱退行性疾病及其继发病变在临床上十分常见,对于有症状的椎间盘退变患者原则上采取“阶梯疗法”,即依次按保守治疗、经皮治疗、髓核摘除、髓核置换、椎间盘置换、脊柱融合术等进行治疗[5]。近年来随着组织工程的发展,使得利用髓核细胞作为种子细胞移植修复退变的椎间盘,甚至扭转椎间盘退变成为可能[6]。已经有临床表明接受自体髓核移植的患者,可以缓解椎间盘退变引起的下腰背疼痛并能缓解椎间盘退变的程度[7,8]。因此,建立分离纯化髓核细胞方法显得尤为重要。
髓核细胞是一种类软骨细胞,至今为止还没有特异性的抗体来鉴定[9],主要依靠观察细胞形态,检测II型胶原以及聚合蛋白[10]。本实验采用体外序贯酶消化法分离培养NPCs,首先使用胰酶消化髓核组织能把髓核组织内成团的细胞初步分散开,为后续使用II型胶原酶消化做好充足的准备,然后采用II型胶原酶消化可消化掉髓核细胞细胞外基质中的II型胶原,而II型胶原是髓核细胞外基质的主要成分[11],从而更好的分离出髓核细胞。采用胰酶消化时,消化的时间不能过长,如时间过长会影响细胞活力,II型胶原酶消化时间可稍长,应使胶原酶与髓核组织充分混匀、接触。原代培养后的细胞经过多次换液、传代后得到形态比较一致的典型的多角形细胞,细胞呈漩涡状、岛状、集落样生长。与文献报道的各种不同方法培养髓核细胞的形态基本一致,可初步判定为NPCs,P3代细胞生长曲线显示细胞已经开始出现衰老、退变,说明体外序贯酶消化法可获得纯度较高的NPCs,能保持细胞活力在P2代以前。采用该法培养髓核细胞能建立一种成熟、有效的NPCs体外培养体系,为后续研究椎间盘退变的机制提供细胞模型,同时也为组织工程应用髓核细胞作为种子细胞修复退变的椎间盘提供了实验室理论及技术保障。
[1]Tow B P,Hsu W K,Wang J C,et al.Disc regeneration:a glimpse of the future[J].Clin Neurosurg,2007,54(2):122.
[2]Liu Y,Kong J,Chen BH,Hu YG.Combined expression of CTGF and tissue inhibitor of metalloprotease-1 promotes synthesis of proteoglycan and collagen typeⅡin rhesus monkey lumbar intervertebral disc cells in vitro [J].Chin Med J(Engl),2010,123(15):2082.
[3]王锋,王运涛,吴小涛.髓核细胞修复椎间盘退行性变的研究进展 [J].中国修复重建外科杂志,2009,23(7):864.
[4]王庆德.体外低氧环境对人骨髓间充质干细胞成骨诱导分化影响的初步研究 [D].武汉:华中科技大学,2008.27.
[5] Dang L,Liu Z.A review of current treatment for lumbar disc herniation in children and adolescents[J].Eur Spine J,2010,19(2):205.
[6]Sakai D.Future perspectives of cell-based therapy for intervertebral disc disease[J].Eur Spine J,2008,17(4):452.
[7] Meisel HJ,Ganey T,Hutton WC,et al.Clinical experience in cell-based therapeutics:interven-tion and outcome[J].Eur Spine J,2006,15(3):S397.
[8] Meisel HJ,Siodla V,Ganey T,et al.Clinical experience in cell-based therapeutics:disc chondrocyte transplantation -A treatment for degenerated or damaged intervertebral disc[J].Biomol Eng,2007,24(1):5.
[9]Alini M,Eisenstein SM,Ito K,et al.Are animal models useful for studying human disc disorders/degeneration?[J].Eur Spine J,2008,17(1):2.
[10]赵献峰,刘浩,丰干均,等.脊索细胞促进髓核软骨样细胞增殖及表型维持 [J].中国修复重建外科杂志,2008,22(8):939.
[11] Miyamoto T,Muneta T,Tabuchi T,et al.Intradiscal transplantation of synovial mesenchymal stem cells prevents intervertebral disc degeneration throug suppression of matrix metalloproteinase-related genes in nucleus pulposus cells in rabbits[J].Arthritis Res Ther,2010,12(6):R206.
