冰冻红细胞的制备及临床输注效果分析
2012-07-09付竹筠
付竹筠
(九江市中心血站 江西九江 332000)
在世界各地不同人群中,Rh(D)阳性的比例有很大不同,北欧85%为D阳性,西非95%为D阳性。在我国的某些地方,几乎所有的人都是D阳性,我国汉族的Rh(D)阴性仅占0.4%左右。为保证Rh(D)阴性血液的供应,尤其是突发事件或急诊患者的用血,我站开展Rh(D)阴性稀有血型冰冻红细胞制备新技术,并广泛应用于临床。该技术是将甘油化冰冻红细胞技术应用于Rh(D)阴性血液的保存,在临床无需求情况下,将筛检出的Rh(D)阴性血液制备成冰冻红细胞,一方面避免了Rh(D)阴性血液资源的浪费,另一方面又能满足Rh(D)阴性血型的临床用血。笔者对102单位冰冻红细胞的制备方法和临床输注效果进行分析,报告如下。
1 材料与方法
1.1 血液来源
制备前的血液均为采自我市Rh(D)阴性血型的无偿献血者的合格血液,在采血后第6d将储存在4℃冰箱的Rh(D)阴性血液制备成冰冻红细胞。
1.2 仪器设备与材料
红细胞甘油冰冻保护剂 (复方甘油溶液)、冰冻保存的转移袋 (三珠袋)、9%氯化钠注射液均由北京博德桑特输采血器材科技开发中心提供;羟乙基淀粉40氯化钠注射液由四川科伦药业股份有限公司提供;0.9%氯化钠注射液由江西科伦药业有限公司提供;索福Rc-12Bp大容量冷冻离心机,-86℃日本三洋冰箱。
1.3 冰冻红细胞的制备方法
1.3.1 红细胞甘油化 取拟冰冻保存的全血或悬浮红细胞2 500r/min离心12min后,去除全部上清液,采用无菌接合技术将红细胞转移至三珠袋中 (每个三珠袋转入1单位红细胞),再采用无菌接合技术用输血器连接复方甘油溶液袋和已转移入红细胞的三珠袋,在无菌条件下,缓慢滴加复方甘油溶液160mL至已转移入红细胞的三珠袋内,边加边摇动三珠袋,让甘油与红细胞充分混匀,约在20min内加完,热合三珠袋的导管后在室温中静置平衡30min,再以2 500r/min离心9min去除上层甘油溶液,置-86℃冰箱中速冰保存。
1.3.2 冰冻红细胞的解冻 从-86℃冰箱中取出冰冻红细胞,经检查外观无破损后,立即放入冰冻血浆解冻箱的37℃水浴中,用手轻轻摇动血袋使其快速融化,冰冻红细胞完全解冻后立即取出,用洁净的干毛巾包绕并轻轻挤压已解冻的冰冻红细胞袋,一方面是擦干血袋外表面的水,另一方面是检查血袋有无渗漏。
1.3.3 洗涤除去甘油 用输血器连接已解冻的冰冻红细胞袋和9%氯化钠注射液袋,缓慢加入9%氯化钠注射液80mL至冰冻红细胞中,边加边摇动三珠袋,使其充分混匀,加完后静置平衡5min,再加入羟乙基淀粉40氯化钠注射液100 mL,边加边摇动三珠袋,使其充分混匀,静置平衡5min后再加入羟乙基淀粉40氯化钠注射液100 mL,加完后热合三珠袋的导管,2 500r/min离心12min去除上清液。再加入0.9%氯化钠注射液 (每次加入400 mL)洗涤2~3次,直至上清液无明显溶血为止。最后加入0.9%氯化钠注射液至三珠袋中使终产品容量为200mL±10%,留取至少20cm长分段热合并注满终产品的血辫供临床做主侧交叉配血[1]。
1.4 统计学处理
采用t检验,p<0.05认为差别具有统计学意义。
2 结果
2.1 质量检测
对102单位解冻洗涤后的冰冻红细胞按照我国卫生部规定的检测方法进行检测,其红细胞回收率、残余白细胞、残余血小板、甘油含量、游离血红蛋白含量、体外溶血试验、无菌试验均达到我国的质量标准[2],具体结果见表1。
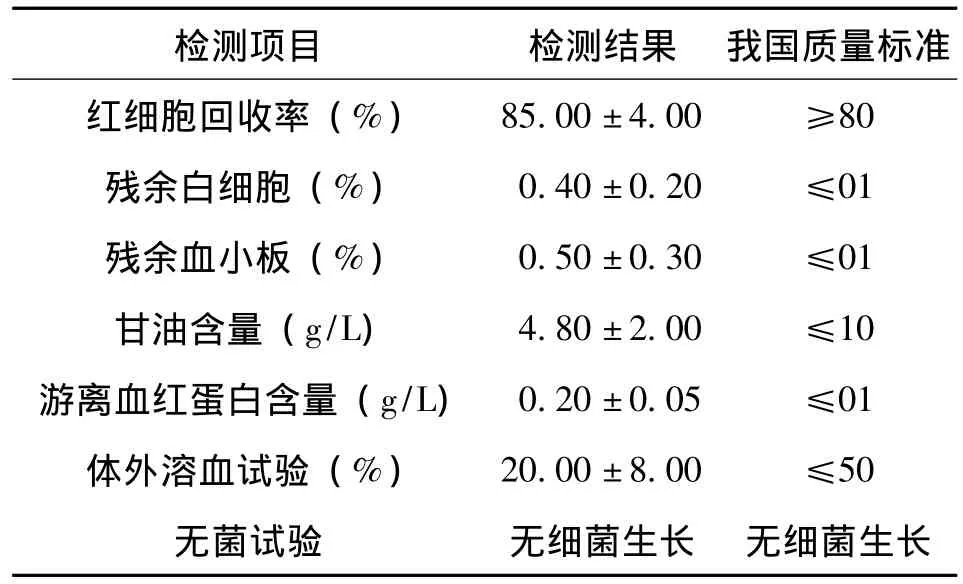
表1 102单位解冻洗涤后的冰冻红细胞的质量检测结果
2.2 冰冻红细胞临床输注效果观察
102单位冰冻红细胞分别由37例急诊输血、择期手术、纠正贫血的患者输注1~8单位不等,其中15例急诊输血患者输注2~8单位冰冻红细胞,输注前平均Hb为64.11 g/L,Hct为20.3%,输注后平均Hb为76.22 g/L,Hct为25.27%;12例择期手术患者输注2~4单位冰冻红细胞,输注前平均Hb为70.86 g/L,Hct为25.66%,输注后平均Hb为77.52 g/L,Hct为28.36%;10例纠正贫血患者输注1~4单位冰冻红细胞,输注前平均Hb为60.54 g/L,Hct为28.52%,输注后平均Hb为70.15 g/L,Hct为30.15%。37例输注冰冻红细胞的患者中,有2例择期手术患者存在Hb及Hct下降的表现,其余患者输注冰冻红细胞后Hb及Hct都有明显升高。输注过程未出现输血相关副作用,具体结果见表2。
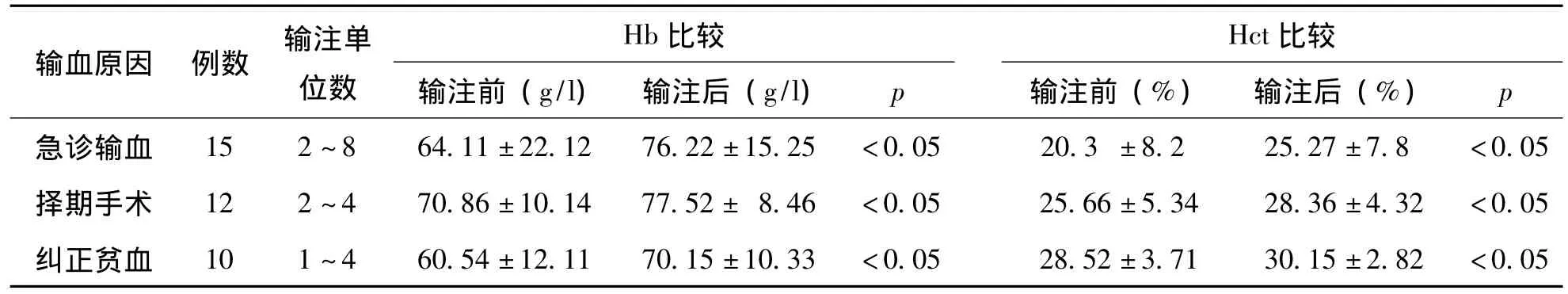
表2 冰冻红细胞输注效果观察
3 讨论
目前,我国血站将甘油保存红细胞技术用于Rh(D)阴性等稀有血型血液的长期保存。冰冻红细胞在-80℃低温下可以保存10年,因为-80℃低温保存阻断了红细胞的生物代谢过程。冰冻红细胞解冻时采用渗透压梯度递减法洗涤后,红细胞又可以恢复正常的生理机能。人体输入去甘油解冻红细胞后,血液中残存少量的甘油和游离血红蛋白可以被体内的血液稀释并通过肾脏逐渐排出体外[3]。通过对37例输注冰冻红细胞的患者的临床输注效果观察,发现多数患者取得了Hb和Hct明显升高的治疗效果;少数手术患者输注后出现Hb及Hct下降的表现,可能与手术过程中出现的大出血等有关,这说明输注冰冻红细胞是有效的。同时还发现临床输注冰冻红细胞后,无1例出现输血相关副作用,这说明输注冰冻红细胞是较为安全的。冰冻红细胞由于多次洗涤时血浆、白细胞、血小板、抗凝剂、细胞外钾、游离血红蛋白等物质几乎全部被洗去,所以输注时病人输血不良反应大大减少[4]。综上所述,冰冻红细胞在临床应用是安全有效的,在一定程度上解决了Rh(D)阴性患者的用血需求,值得推广应用。但是冰冻红细胞在临床输注前需要解冻洗涤,从解冻、冼涤至成品,约需3h,虽然也有1-1.5h的文献报道[4],但是时间短易致洗涤不彻底,使残留的甘油和游离血红蛋白量偏高,而解冻后成品红细胞内残留甘油量过高容易引起溶血[5]。如果患者一次性输注的数量较多,洗涤时间长,不利于大出血病人的急救,因此需要找到一种解冻后无需洗涤可直接输注的红细胞冰冻保护剂是红细胞保存的研究发展方向,希望在不久的将来通过血站工作者的不懈努力能够实现。
[1]徐国泰,吕秋霜,王春荣,等.羟乙基淀粉溶液洗涤方法—快速洗涤红细胞 [J].中国输血杂志,1988,1⑷:191.
[2]中华人民共和国卫生部.中国输血技术操作规程 [M].天津:科学技术出版社,1998.109.
[3]李国良,彭继红,肖莉,等.冰冻红细胞临床疗效的观察 [J].江西医药,2009,44(8):417.
[4]浑守永,游敏,高新谱,等.Rho(D)阴性冷冻红细胞的临床应用研究 [J].临床输血与检验,2002,4(1):29.
[5]朱发明,严力行.酶法检测解冻红细胞残留甘油含量 [J].输血与检验,2002,4(2):25.
