自制BMPs活性蛋白的异位诱导成骨实验研究*
2012-07-09车向新李卫东
车向新 曹 俊 李卫东
(1九江学院基础医学院;2江西省系统生物医学重点实验室 江西九江 332000)
骨形态发生蛋白 (bone morphogenetic proteins,BMPs)是一组具有类似结构的高度保守的功能蛋白,为多功能生长因子,能够在体内诱导骨和腱样组织形成。BMPs在肢体生长、软骨内骨化、骨折早期及肌腱修复时表达,对骨骼的发育和再生修复以及肌腱的再生修复起重要作用[1,2]。本研究利用新鲜小牛骨干制备活性骨形态发生蛋白,并检测其在小鼠肌袋内的异位成骨作用及生物相容性,为后续人工骨材料的制备及利用奠定基础。
1 材料和方法[3]
1.1 主要材料
活性蛋白制备 (本实验在江西省系统生物医学重点实验室完成)。按Urist法[4]用新鲜小牛骨干制备骨基质明胶 (bonematrixgelatin,BMG),再通过萃取、层析、分离纯化,制备活性骨形态发生 蛋 白 (bovine bone morphogenetic proteins,bBMPs),冷冻干燥,冻干品分装,环氧乙脘熏蒸消毒,置4℃冰箱冷藏备用。
1.2 实验动物
封闭群昆明小鼠 (华中科技大学同济医学院实验动物中心提供),雄性,4周龄,40只。
1.3 手术方法
取小鼠俯卧位固定,右侧后肢内侧脱毛,碘酒、酒精消毒,在右后肢内侧做切口,经皮肤、皮下,分开肌肉,将bBMPs材料放人肌袋内;在左后肢内侧做同样的切口,分开肌肉缝合皮肤。放回笼内饲养。手术后按第2、3、4、8周时间每次处死10只动物,先后分别行X线摄片、取材,将材料连同周围肌肉一同取出,10%福尔马林固定,行HE染色。
1.4 观察内容
1.4.1 大体观察 术后观察小鼠饮食,活动和切口反应情况,取材后注意有无炎性反应,材料有无排出,有无化脓以及成骨情况。
1.4.2 X线检测 分 2、4、6、8周钼靶 20KV 0.4S植入侧与非植入侧同片对照。
1.4.3 组织形态学观察 标本经10%福尔马林固定后脱钙、石蜡包埋、切片,然后分别用HE法染色,光镜下观察成骨情况。
2 结果[3]
2.1 大体所见
所有动物在术后均末见伤口破溃、红肿等不良反应,饮食和活动均正常,取材后见BMP侧2周标本表面由灰白色、较硬韧的组织覆盖。对侧周围组织界限较清楚。
2.2 X线所见
X线片4周植入部位已有斑点状钙化区形成见图1。图1中,a见材料植入区呈云雾状密度增高影,b见植入区有小条状密度增高,c、d见小块状密度增高。
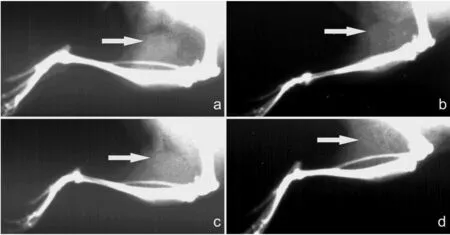
图1 4周植入部位已有斑点状钙化区形成X线片
2.3 组织形态学观察
组织形态学观察结果见图2。

图2 组织形态学观察结果
图2a显示2周有大量细胞集聚 (×10);图2b显示3周有较多的骨细胞,有骨基质生成 (×40);图2c显示4周有明显骨样组织形成 (×10);图2d显示8周有明显完整的骨组织形成(×10)。
3 讨论
BMPs是转化生长因子β(TGFβ)超家族成员,其诱导成骨作用已为骨修复研究领域所公认[5]。BMPs的主要生物学作用是诱导末分化的间充质细胞向软骨和骨的方向分化[6]。Urist认为BMPs诱导所在组织及周边间充质细胞聚集,改变了宿主床的炎性细胞反应和其它的局部条件,有利于间充质细胞向软骨和骨细胞的方向发展[7]。BMPs通过与受体结合,可激活胞内Smads信号,调控成骨相关基因的表达[8]。
迄今已发现约20多种BMPs成员,其中BMP-2、BMP-4、BMP-6、BMP-7和BMP-9有明显的成骨诱导作用。Kang等[9]用重组腺病毒表达14种BMP,结果发现当BMP转导成骨前体细胞或重组腺病毒注射入无胸腺小鼠的四头肌内时,BMP-6和BMP-9能有效地诱导骨形成,推断BMP-6和BMP-9可能是更为有效的成骨因子。对比14种BMP基因诱导干细胞成骨分化作用的强弱,结果发现BMP-9的诱导成骨分化作用最强,BMP-2、BMP-7次之。
目前,对BMP诱导成骨作用中到底哪种成员起主要作用或次要作用很难确定。按系统思维理论分析,BMPs的各个成员是“协同作战”的,BMPs因子群中的任何单一成员的诱导活性,不太可能强于整体的诱导活性。已有研究证实,一些BMPs成员在诱导成骨方面显示正协同效应,例如BMP5联合BMP10或BMP12时可明显增强成骨细胞标志基因ALP的表达[10]。与单一BMP组成的同源二聚体相比较,不同类型BMP单体连在一起构建异源二聚体BMPs,显示与BMP受体有更高的亲和力,且成骨诱导能力增强[11]。基于上述观点,笔者采用从新鲜小牛骨干提取纯化的牛骨形态发生蛋白 (bBMPs)作为人工骨材料的诱导核心,bBMPs包含不同类型BMP,检测其是否具有诱导成骨活性将是关键。
诱导成骨作用应通过非骨环境的成骨作用证实,这可将骨传导引起的成骨作用排除在外,因此,本研究采用小鼠肌袋的异位诱导成骨这一经典动物模型来评价其骨诱导能力。结果显示,bBMPs植入后4周有明显骨样组织形成,8周有完整的骨组织形成,说明bBMPs具有较强异位诱导成骨能力。
bBMPs是一类种属非特异性的18KD的蛋白质,理论上bBMPs不引起免疫排斥反应,同时这组蛋白具有高效的诱导成骨活性。在小鼠肌袋诱导成骨的研究中发现bBMPs植人肌袋内24、48、72h在植人材料周围均没见切口红肿、破溃等不良反应,显示其具有良好的生物相容性。
[1] Nakase,T and H Yoshikawa.Fracture repair and bone morphogenetic protein(BMP)[J].Clin Calcium,2006,16(5):755.
[2] Fazzalari N L.Bone fracture and bone fracture repair [J].Osteoporos Int,2011,22(6):2003.
[3]车向新.诱导型人工骨材料修复兔颅骨缺损的实验研究[D].南昌:南昌大学,2008.11.
[4] Urist M R,Nilsson O,Rasmussen J,et al.Bone regeneration under the influence of a bone morphogenetic protein(BMP)beta tricalcium phosphate(TCP)composite in skull trephine defects in dogs[J].Clin Orthop Relat Res,1987(214):295.
[5] Yamaguchi A.Application of BMP to bone repair[J].Clin Calcium,2007,17(2):263.
[6]Lavery K,S Hawley.New insights into BMP -7 mediated osteoblastic differentiation of primary human mesenchymal stem cells [J].Bone,2009,45(1):27.
[7] Urist M R.Bone:formation by autoinduction[J].Science,1965,150(3698):893.
[8] Lissenberg-Thunnissen SN,de Gorter DJ,Sier CF,et al.Use and efficacy of bone morphogenetic proteins in fracture healing [J].Int Orthop,2011,35(9):1271.
[9]Kang Q,Sun MH,Cheng H,et al.Characterization of the distinct orthotopic bone-formingactivity of 14 BMPs using recombinant adenovirus-mediated gene delivery [J].Gene Ther,2004,11(17):1312.
[10]Luu H H,Song W X,Luo X,et al.Distinct roles of bone morphogenetic proteins in osteogenic differentiation of mesenchymal stem cells [J].J Orthop Res,2007,25(5):665.
[11] Guo J,Wu G.The signaling and functions of heterodimeric bone morphogenetic proteins[J].Cytokine Growth Factor Rev.2012,3(1-2):61.
