解毒灌肠液干预肝硬化家兔内毒素血症的实验研究*
2012-07-09马羽萍张殿增张新昀黄小正郭雅玲
马羽萍 张殿增 张新昀 刘 莉 赵 玲 彭 杰 黄小正 郭雅玲
陕西省传染病院(西安710061)
肠源性内毒素血症,在临床疾病的发生发展过程中起着非常重要的作用[1]。肠源性内毒素血症可引起肝脏持续性损害,是加速和促使肝硬化形成的原因之一,也是促使肝硬化并发症形成的重要原因,严重影响肝硬化患者的生存及预后[2]。肝硬化患者肠源性内毒素血症的发生率较高。前期我们通过运用复方中药解毒灌肠液治疗重型肝炎和肝硬化患者合并内毒素血症的临床研究,发现该方药能改善临床症状,降低内毒素,改善肝功能,减少并发症[3]。本研究通过家兔肝硬化模型动物造模,观察复方中药解毒灌肠液对其血液内毒素水平、肝组织炎性细胞因子、病理切片变化及肝肾功能的影响,探讨该方药对内毒素血症动物的保护作用。
1 实验材料
1.1 解毒灌肠液 大黄1500g,金银花、蒲公英、丹参、赤芍、白头翁各1000g,枳实、厚朴各500g。制成浓缩煎液(比重为1.04—1.05),高压灭菌,分装(200mL/瓶)。本制剂所用药材的生药鉴定均按照中国药典2000版一部有关的各项规定进行。
1.2 试剂 内毒素脂多糖(LPS),Sigma Chemical Co.产品(批号L2880。抗兔内毒素(批号:2011111033)和抗兔TNF-α(批号:20111109046)Elisa试剂盒均购自天津索罗门生物科技有限公司。头孢克肟片为江苏正大清江制药有限公司生产,乳果糖为安维世制药(北京)有限公司生产。四氯化碳为广东光华化学厂有限公司产品(批号:20091015),用时以高压消毒过的色拉油配制成50%的溶液。生化检测在西安交通大学第一附属医院临床检验中心进行。
1.3 动物 SPF级健康雄性家兔,6月龄,体重1.9±0.5kg,由西安交通大学医学院实验动物中心提供,在层叠式自动冲水不锈钢笼内饲养,供自来水和兔标准颗粒饲料,自由摄食饮水。
2 方法 取SPF级健康雄性家兔42只,适应性喂养1周后,耳中动脉采血后,所有动物以0.1mL/㎏剂量用一次性注射器腹腔注射四氯化碳。每3d1次,连续90d。肝硬化造模结束后,将存活的40只动物随机分为四组:3个对照组,即生理盐水、乳果糖、头孢克肟灌肠组;1个实验组,即解毒灌肠液灌肠组。于注射四氯化碳结束前两周分别用生理盐水、乳果糖、头孢克肟和解毒灌肠液进行保留灌肠,容积为10mL/只,每日1次;灌肠结束12h后,用内毒素LPS灌胃(40μg/kg)1次,持续2周。末次LPS灌胃2h后,心脏采血,测定肝肾功能相关的生化指标、血液学指标、血液内毒素水平和TNF-α水平。然后脱臼处死动物,摘取心、肝、脾、肾和大脑称湿重,计算脏体比。摘取大肠,称湿重后在105℃烤箱内烘干,称干重,计算其干湿比。最后将心、肝、脾、肾和大肠标本用10%甲醛固定,常规切片,进行病理学检查。
3 结果
3.1 解毒灌肠液对肝纤维化模型家兔肝肾功能的影响于造模前和内毒素灌胃后分别于耳中动脉和心脏采血,用全自动生化检测仪检测动物的血液生化学指标,结果如表1示。
表1 解毒灌肠液对肝纤维化模型家兔肝肾功能的影响(±s)
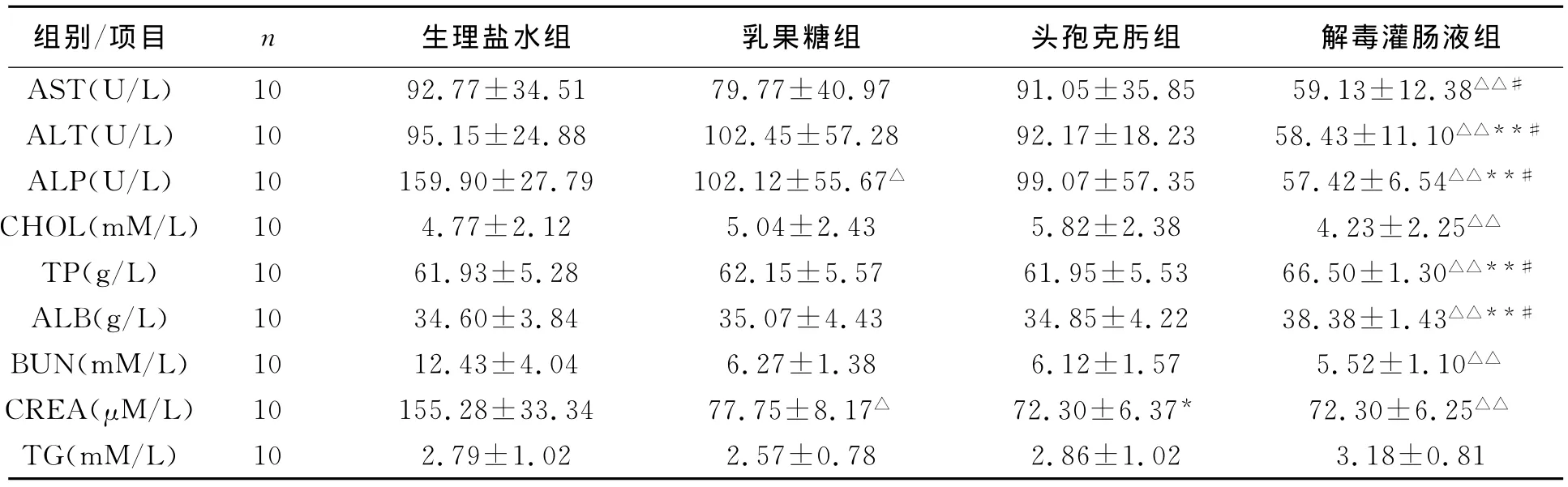
表1 解毒灌肠液对肝纤维化模型家兔肝肾功能的影响(±s)
与生理盐水组比较,△P<0.05,*P<0.05,△△P<0.05;与乳果糖组比较,**P<0.05;与头孢克肟组比较,#P<0.05。
生理盐水组 乳果糖组 头孢克肟组 解毒灌肠液组AST(U/L) 10 92.77±34.51 79.77±40.97 91.05±35.85 59.13±12.38△△#组别/项目 n 10 2.79±1.02 2.57±0.78 2.86±1.02 3.18±0.81 ALT(U/L) 10 95.15±24.88 102.45±57.28 92.17±18.23 58.43±11.10△△**#ALP(U/L) 10 159.90±27.79 102.12±55.67△ 99.07±57.35 57.42±6.54△△**#CHOL(mM/L) 10 4.77±2.12 5.04±2.43 5.82±2.38 4.23±2.25△△TP(g/L) 10 61.93±5.28 62.15±5.57 61.95±5.53 66.50±1.30△△**#ALB(g/L) 10 34.60±3.84 35.07±4.43 34.85±4.22 38.38±1.43△△**#BUN(mM/L) 10 12.43±4.04 6.27±1.38 6.12±1.57 5.52±1.10△△CREA(μM/L) 10 155.28±33.34 77.75±8.17△ 72.30±6.37* 72.30±6.25△△TG(mM/L)
表1中的结果表明,与生理盐水组比较,乳果糖组中肝、肾功能多指标明显改善,解毒灌肠液组中肝、肾功能指标普遍较对照组明显改善。
表2 解毒灌肠液对肝纤维化模型家兔血液学的影响±s)

表2 解毒灌肠液对肝纤维化模型家兔血液学的影响±s)
与生理盐水组比较,各组血常规指标无明显差异,P>0.05;与头孢克肟组比较,#P<0.05。
生理盐水组 乳果糖组 头孢克肟组 解毒灌肠液组RBC(1012/L)10 5.28±1.17 5.08±0.78 6.05±1.00 4.91±0.73组别/项目 n#HGB(g/L) 10 117.83±16.68 119.33±16.52 130.0±12.20 114.00±13.97#WBC(109/L)10 3.92±2.60 3.10±2.51 3.44±2.50 2.86±2.50 LYMP(%) 10 69.33±17.12 71.13±16.20 79.22±4.70 70.68±18.26 NEUT(%) 10 26.48±17.41 26.22±16.31 17.62±4.94 26.67±17.27
表2中的结果显示,各组的血液学指标较模型对照组没有明显差别,说明给药后模型动物的血液学指标没有明显的改变。
表3 解毒灌肠液对肝纤维化模型家兔血清TNF-α和ET水平的影响±s)

表3 解毒灌肠液对肝纤维化模型家兔血清TNF-α和ET水平的影响±s)
与生理盐水组比较,△P<0.05,*P<0.05,△△P<0.05;解毒灌肠液组与乳果糖组及头孢克肟组比较,**P<0.05,#P<0.05。
生理盐水组 乳果糖组 头孢克肟组 解毒灌肠液组TNF-α(ng) 10 424.27±87.25 313.26±65.64△ 315.68±45.73* 220.87±103.61**△△#组别/项目 n ET(pg/mL) 10 165.87±42.36 85.72±42.46△ 137.32±40.77 65.50±28.82△△#
表3显示,与生理盐水组比较,各组动物血清TNF-α、ET水平明显降低;与乳果糖组及头孢克肟组比较,解毒灌肠液组动物血清TNF-α、ET水平降低更为明显(P<0.05)。
表4 解毒灌肠液对肝纤维化模型家兔脏体比的影响±s)
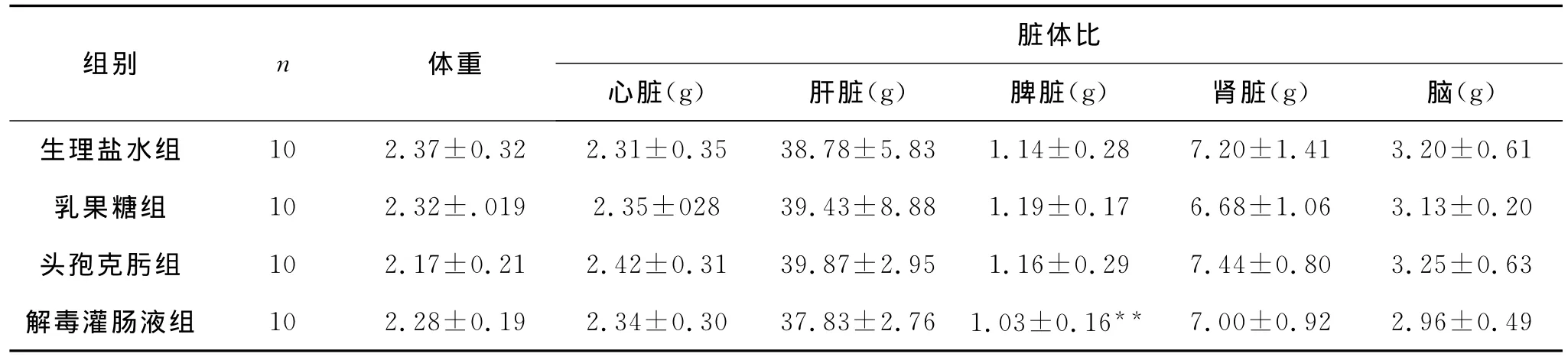
表4 解毒灌肠液对肝纤维化模型家兔脏体比的影响±s)
与生理盐水组比较,各组动物脏体平均重量无明显差异,P>0.05;与乳果糖组比较,**P<0.05。
组别 n 体重脏体比心脏(g) 肝脏(g) 脾脏(g) 肾脏(g) 脑(g)7.20±1.41 3.20±0.61乳果糖组 10 2.32±.019 2.35±028 39.43±8.88 1.19±0.17 6.68±1.06 3.13±0.20头孢克肟组 10 2.17±0.21 2.42±0.31 39.87±2.95 1.16±0.29 7.44±0.80 3.25±0.63解毒灌肠液组 10 2.28±0.19 2.34±0.30 37.83±2.76 1.03±0.16**生理盐水组 10 2.37±0.32 2.31±0.35 38.78±5.83 1.14±0.28 7.00±0.92 2.96±0.49
表4中的结果显示,与生理盐水组比较,各组动物脏体平均重量没有明显的差别(P>0.05)。说明造模与给药对动物的脏体平均重量没有明显的影响。
表5 解毒灌肠液对肝纤维化模型家兔大肠干湿比的影响(±s)

表5 解毒灌肠液对肝纤维化模型家兔大肠干湿比的影响(±s)
与生理盐水组比较,△P<0.05,*P<0.05,△△P<0.05;解毒灌肠液组与乳果糖组比较,**P<0.05,与头孢克肟组比较,#P<0.05。
10 2.37±0.32 62.58±6.66 7.05±0.52 0.11±0.02乳果糖组 10 2.32±.019 45.70±3.03△ 6.47±80.38 0.14±0.02△头孢克肟组 10 2.17±0.21 44.95±3.80* 6.22±0.49* 0.13±0.01解毒灌肠液组 10 2.28±0.19 38.07±4.02△△**# 6.46±0.41 0.17±0.01△△**#干湿比生理盐水组组别 动物数(n) 体重(kg) 湿重(g) 干重(g)
表5中的结果显示,与生理盐水组比较,乳果糖组、头孢克肟组及解毒灌肠液组动物大肠的干湿比值明显增加(P<0.05);与乳果糖组、头孢克肟组比较,解毒灌肠液组动物大肠的干湿比值增加更为明显。说明解毒灌肠液对肝纤维化动物大肠具有更强的保护作用。
3.2 病理检查
3.2.1 肝脏病理检查 于LPS灌肠后2h,脱臼处死动物,剪取肝脏样品,10%甲醛固定,石蜡包埋,常规切片,在显微镜下观察肝脏的病理变化,结果如图1所示。

图1 解毒灌肠液对肝纤维化模型家兔肝脏病理学的影响 结果显示,模型对照组动物的肝细胞明显水肿,肝窦明显扩张。窦内枯否细胞明显浊胀、变形、数量增多,汇管肿胀、变形,数量增多较明显,可见明显地条索状纤维化增生,井可见中性粒细胞浸润。乳果糖组、头孢克肟组见有相同改变,但程度较轻,少量中性粒细胞浸润。解毒灌肠液组仅见肝细胞明显水肿,纤维化增生较少,中性粒细胞浸润明显少于模型对照组和其他给药组。HE染色,×400。
3.2.2 大肠病理检查 于LPS灌肠后2h,脱臼处死动物,剪取大肠样品,10%甲醛固定,石蜡包埋,常规切片,在显微镜下观家兔大肠的病理变化,结果如图2所示。
讨 论 肠源性内毒素是肝功能衰竭发生、发展的主要原因。肠道堪称是内毒素的最大储库。活动性肝病时常伴有门脉高压性肠病,其主要表现为血管扩张、扭曲、形成交通支、通透性增加(门脉高压性肠血管病),粘膜充血、水肿、糜烂、出血。加之部分病人伴随的自身免疫性肠病和感染性肠病,这些均可增加肠粘膜通透性,有助于内毒素的吸收,增加内毒素的摄取,

图2 解毒灌肠液对肝纤维化模型家兔大肠病理学的影响结果显示,模型对照组动物的大肠粘膜的炎症反应明显,血管充血扩张,粘膜水肿,中性粒细胞浸润。乳果糖组和头孢克肟组亦有明显炎症反应。解毒灌肠组动物的大肠粘膜的炎症反应明显减轻,血管扩张和水肿都不明显。
从而致使肝硬化患者血清中的ET水平明显增加,肝脏和结肠、直肠出现明显的炎症反应,大肠湿重增加[4]。内毒素血症综合征、肝性脑病,及出血等[5]。常是肝衰竭继发多脏器衰竭的始动因素。因此肿瘤坏死因子被视为内毒素所知肝脏病理生理过程的关键性促炎物质[6]。内毒素血症,从肠道给药,通过肠道粘膜吸收,使药物直达病所[7],减少肠源性内毒素产生和吸收,降低血浆内毒素水平,下调或抑制损伤性细胞因子的分泌,改善肝内微循环,减轻内毒素对肝细胞线粒体的损伤,恢复正常的肝脏能量代谢,是肝衰竭临床治疗的一条新的思路。
目前在临床上常采用多种方法以降低血液内毒素,如内毒素吸附剂乳果糖和抗菌素[9]等,还用一些中药进行灌肠。乳果糖可以①酸化肠腔,减少胺类吸收;②调节肠道菌群,抑制肠道嗜碱性有害细菌生成;③渗透性腹泻作用,减少ET滞留在肠腔,促进肠蠕动,减少内毒素库;④灭活内毒素;⑤阻止活化单核巨噬细胞释放细胞因子,减轻免疫反应。这些作用可能是它减轻肝硬化内毒素血症模型动物肝脏损坏的原因,但它对肠粘膜没有保护作用,对已经吸收的内毒素没有清除作用。头孢克肟则是通过杀灭肠道和吸收入血的活菌降低血液内毒素水平,对已经形成的LPS没有作用。所以,它们对血液ET水平和TNF-α有一定的影响。
本研究结果显示,造模形成的肝硬化内毒素血症模型,生理盐水组比对照组动物的肝肾功出现明显的异常,血脂代谢失调,血清TNF-α、ET水平明显提高,大肠的干湿比明显减少,肝脏和大肠出现明显的炎症病理学改变。经药物干预,乳果糖组和头孢克肟组动物的这些改变有些减轻,但不是很明显。解毒灌肠液组对动物肝纤维化模型家兔肝肾功能及血清TNF-α、ET水平的影响明显(P<0.05),大肠的干湿比、肝脏和大肠炎症病理学改变与其他给药组比较明显。
解毒灌肠液由清热解毒、通里攻下、活血化瘀的中草药组成,对肝硬化内毒素血症的家兔有显著的保护作用,其途径可能通过保护肠道屏障作用,改善微循环,减少肠道内毒素的吸收,降低机体的内毒素水平,从而减少炎性因子的产生,阻断内毒素血症的生物学效应。是治疗肝硬化有效的辅助方法之一。
[1]房 杰,孙兰菊,陈明慧.解生地对大鼠肠管炎内毒血症防治作用的实验研究[J].陕西医学杂志,2011,40(10):1455.
[2]R uan P,G ong ZJ,Zhang Q R.C hanges of p lasm a D(-)-lacate,d iam ine ox idase and endotox in in p at ien ts w ith liver cir2rhosis[J].H epatob il Pan creat D is Int,2004,3(4):456-462.
[3]马羽萍,彭 杰,赵 玲,等.中西医结合治疗重症型肝炎、肝炎肝硬变合并内毒素血症40例[J].陕西中医,2002,23(7):579.
[4]黄自平.肠源性内毒素血症在肝硬化失代偿中的作用及其处理[J].胃肠病学和肝病学,1997,6(1):9-24.
[5]张顺财.内毒素基础与临床[M].北京:科学出版社2003:272.
[6]于中麟,钱林学.乳果糖在肝病治疗中的应用[J].中华内科杂志,1996,35:65.
[7]毛 毛,大黄解毒灌肠治疗慢性乙型病毒性肝炎肠性内毒素血症45例[J].陕西中医,2010,31(5):516.
