彩色多普勒超声参数建立卵巢肿瘤良恶性质诊断模型
2012-06-09赵香菊王亮卿户亚光滑秀云
赵香菊 王亮卿 时 燕 张 磊 户亚光 滑秀云
河南长垣县人民医院超声科 长垣 453400
卵巢肿瘤是妇科常见的生殖器疾病,彩色多普勒超声技术作为一种无创伤、简便易行的影像检查,是肿瘤性质术前鉴别诊断的重要依据[1-2]。本文采用前瞻性研究方法,将预示肿瘤性质的超声影像和血流频谱信息进行主成分Logistic回归分析,建立肿瘤性质预报概率模型,构筑接受者工作特征曲线(receiver operating characteristic,ROC),评价临床超声(clinicalul trasound diagnosis,CUD)预测肿瘤良恶性质的能力,旨在为术前卵巢肿瘤性质的鉴别诊断、治疗方案的确立和预后评估等提供重要参考。
1 对象和方法
1.1 对象 选择2009-04—2011-04我院诊治的卵巢肿瘤患者132例,共136个肿瘤。年龄21~79(46.28±10.39)岁;组织活检或术后病理组织学诊断为恶性肿瘤75个,良性肿瘤61个。排除卵巢巧克力囊肿、卵巢滤泡囊肿、黄素囊肿、黄体囊肿、卵泡血肿、黄体血肿、多囊卵巢等非赘生性肿块患者。
1.2 仪器与方法 采用美国Philips公司生产HD-11XE型彩色多普勒超声诊断仪,由2名超声专业医师操作,存疑问题商讨解决。膀胱适度充盈,取仰卧位,经阴道和(或)经腹部扫查,腹部探头频率2~5 MHz,经阴道探头频率4~8 MHz,腹壁滤波100 Hz,多普勒重复频率(PRF)700 Hz。二维超声多切面扫查肿块的位形态是否规则、大小、包膜厚度、边界清晰度、包膜、物理性质(囊性、混合性或实性)、腹水等。在清晰显示肿块二维声像图的基础上,启动多普勒程序以获得肿瘤内血流信号,肿块内部及周边血管多点取样,测量的血流动力学指标包括:收缩期峰值流速(VPS)、舒张末期流速(VED)、平均流速(Vm)、搏动指数(PI)、阻力指数(RI);其中PI=(收缩期峰值血流速度-舒张末期流速)/平均血流速度,RI=(收缩期峰值血流速度-舒张末期流速度)/收缩期血流速度,连续测量肿瘤内部血流3个周期的RI,取均值。血流信号分为4个级别[3]:肿瘤内部及周边未见血流信号为0级;肿瘤周边可见点、线样血流,肿瘤内部未见血流信号为Ⅰ级;肿瘤内部可见散在的点样、线样血流,走行规则为Ⅱ级;肿瘤内部血管呈树枝样、网状,血管走行迂曲、杂乱为Ⅲ级。
1.3 统计学处理 计数资料的组间比较采用卡方检验,多普勒频谱参数的组间比较采用非参数Mann-Whitney检验,将单因素分析有统计意义的变量行主成分Logistic回归,建立诊断模型,ROC曲线作为评价模型的预测能力,统计软件为SPSS 16.0。
2 结果
2.1 卵巢良、恶性肿瘤的声像参数比较 恶性肿瘤的形态不规则、体积≥300 cm3、包膜不明显、边界不清、回声不均、物理性质为实性的构成比高于良性肿瘤,P<0.05或0.01,见表1。
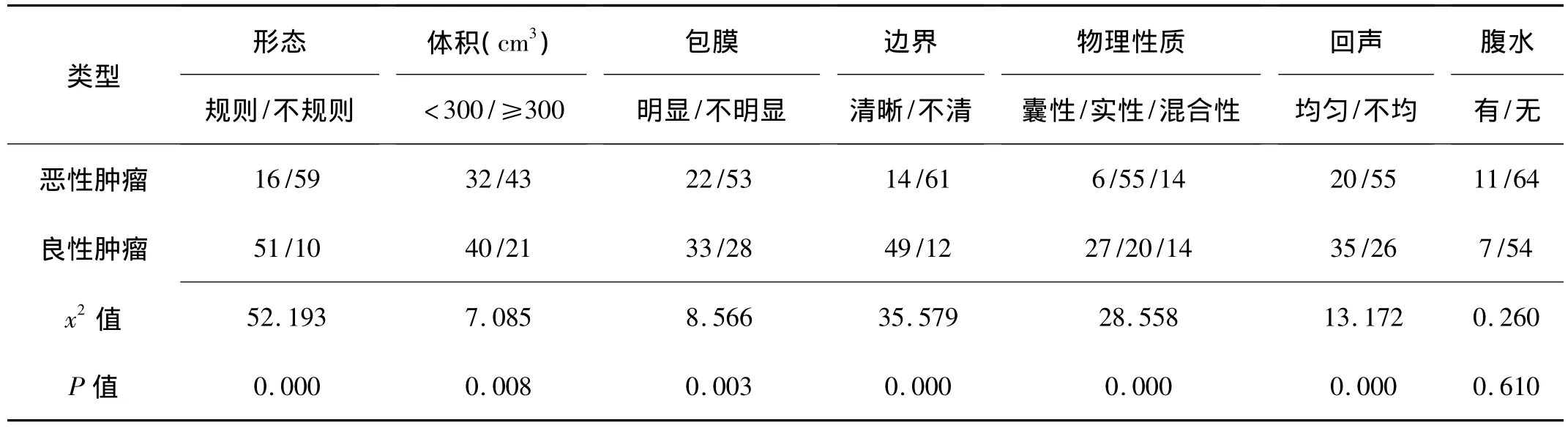
表1 卵巢良性(61个)与恶性(75个)肿瘤的声像参数构成 (例)
2.2 卵巢良、恶性肿瘤的血流频谱参数比较 恶性肿瘤血流信号0级、Ⅰ级、Ⅱ级、Ⅲ级分别为8例、14例、20例、33例,良性肿瘤分别是28 例、20 例、10 例、3 例,z=-6.239,P=0.000。恶性肿瘤的VED和Vm大于良性肿瘤,而RI和PI小于良性肿瘤。见表2。
表2 卵巢良、恶性肿瘤的血流频谱参数比较 ()
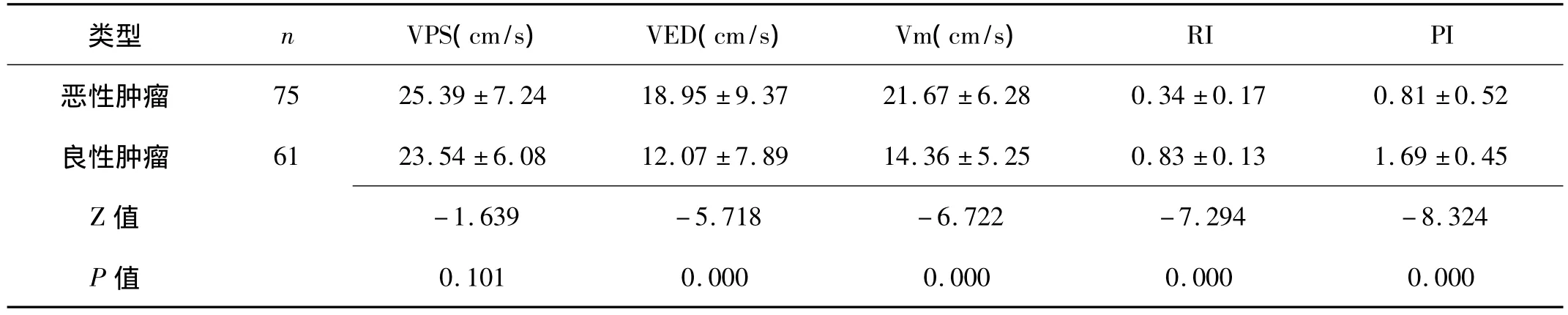
表2 卵巢良、恶性肿瘤的血流频谱参数比较 ()
类型 n VPS(cm/s) VED(cm/s) Vm(cm/s)RI PI恶性肿瘤 75 25.39 ±7.24 18.95 ±9.37 21.67 ±6.28 0.34 ±0.17 0.81 ±0.52良性肿瘤 61 23.54 ±6.08 12.07 ±7.89 14.36 ±5.25 0.83 ±0.13 1.69 ±0.45 Z值 -1.639 -5.718 -6.722 -7.294 -8.324 P值0.101 0.000 0.000 0.000 0.000
2.3 原始数据非条件Logistic回归 将单因素分析中P<0.05的变量量化赋值:形态“规则”=0,“不规则”=1;体积“<300 cm3”=0,“≥300 cm3”=1、包膜“明显”=0,“不明显”=1;边界“清晰”=0,“不清”=1;回声“均匀”=0,“不均”=1;物理性质“囊性”=0,“混合性”=1,“实性”=2,VED、Vm、RI和 PI为实际值;血流信号“0级”=0,“Ⅰ级”=1,“Ⅱ级”=2,“Ⅲ级”=3;应变量:良性肿瘤=0,恶性=1。逐步向前选择法[Forward Stepwise(Conditional)]回归,在单因素分析中11个有统计学意义变量第一步PI入选模型,P=0.000,而第二步仅PI和Vm入选,且P值接近1,OR值和标准误差大,表1。这与实际情况不符,难以解释。故怀疑自变量间存在多重共线性问题。
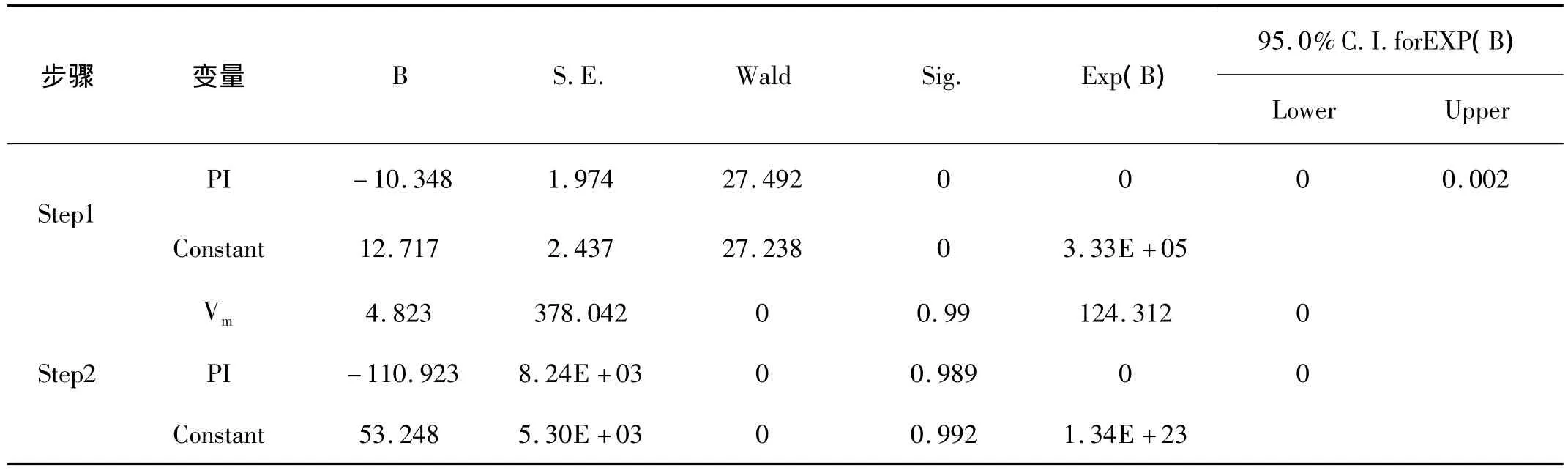
表3 136个卵巢肿块良恶性质的非条件Logistic回归结果
2.4 共线性诊断 利用多元线性回归模块中的诊断工具进行 多重共线性判断,参照文献[3]标准,维度10、11、12特征根接近0,而条件指数分别是 14.069、17.135、20.916 >10,其中肿瘤形态和搏动指数的方差膨胀因子(VIP)为3.313和2.888(表4)。因此,认为数据间存在多重共线性。解决此类问题宜采用主成分Logistic回归。
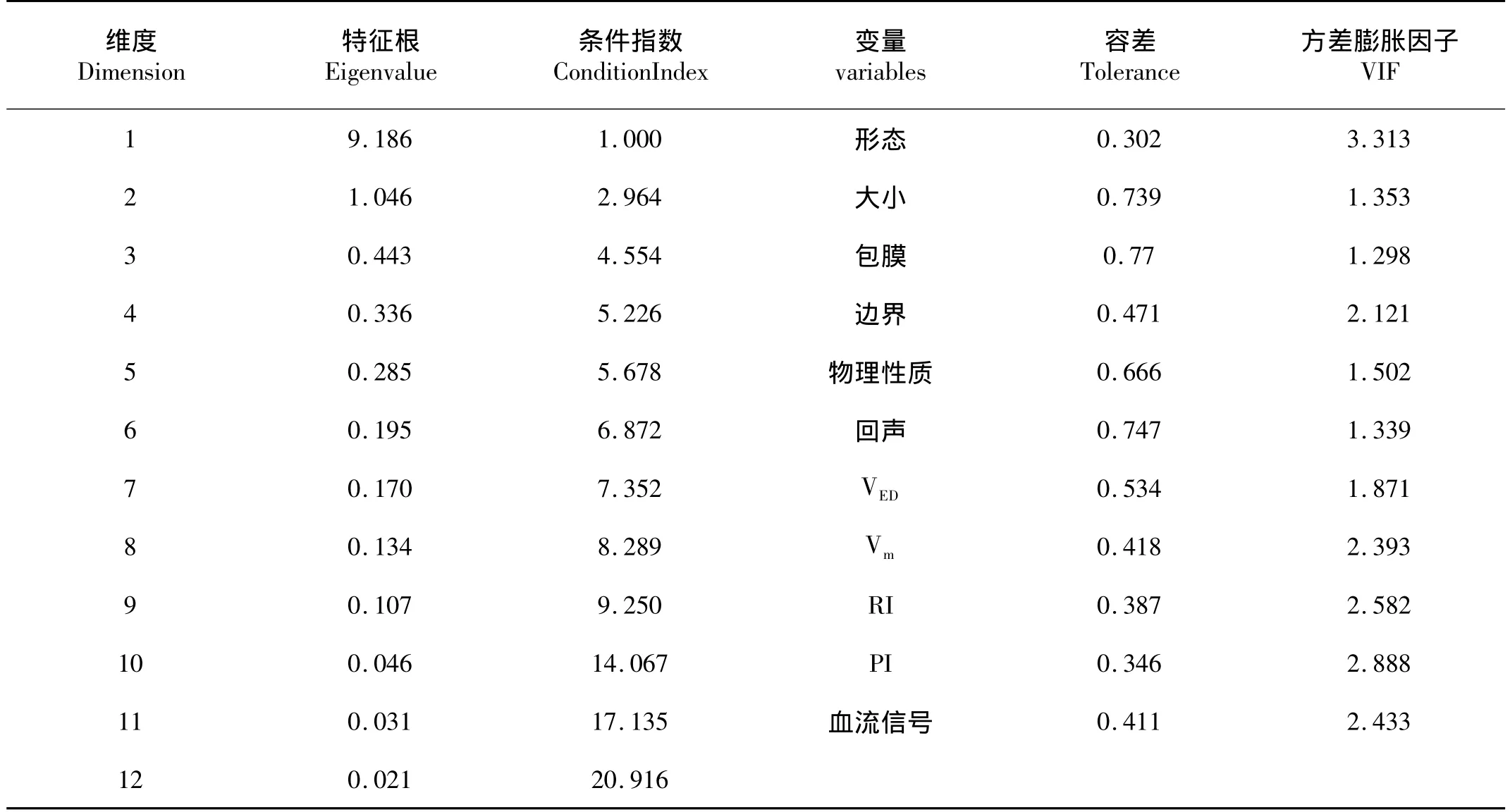
表4 共线性诊断结果
2.5 主成分Logistic回归 (1)主成分分析保留前7个主成分,因其涵盖了所有自变量90%的信息(表5)。根据主成分得分系数(表6)建立主成分函数,计算每个样本的主成分值。用7个主成分作为自变量,强行进入法析出回归模型,然后将数据还原。建立卵巢恶性肿瘤诊断模型Logit(P)=2.824形态+0.495体积 +0.638包膜 +3.256边界 +1.895回声 +1.235物理性质+0.235VED+0.231Vm-3.090PI-2.964RI+1.965 血流信号。见表7。
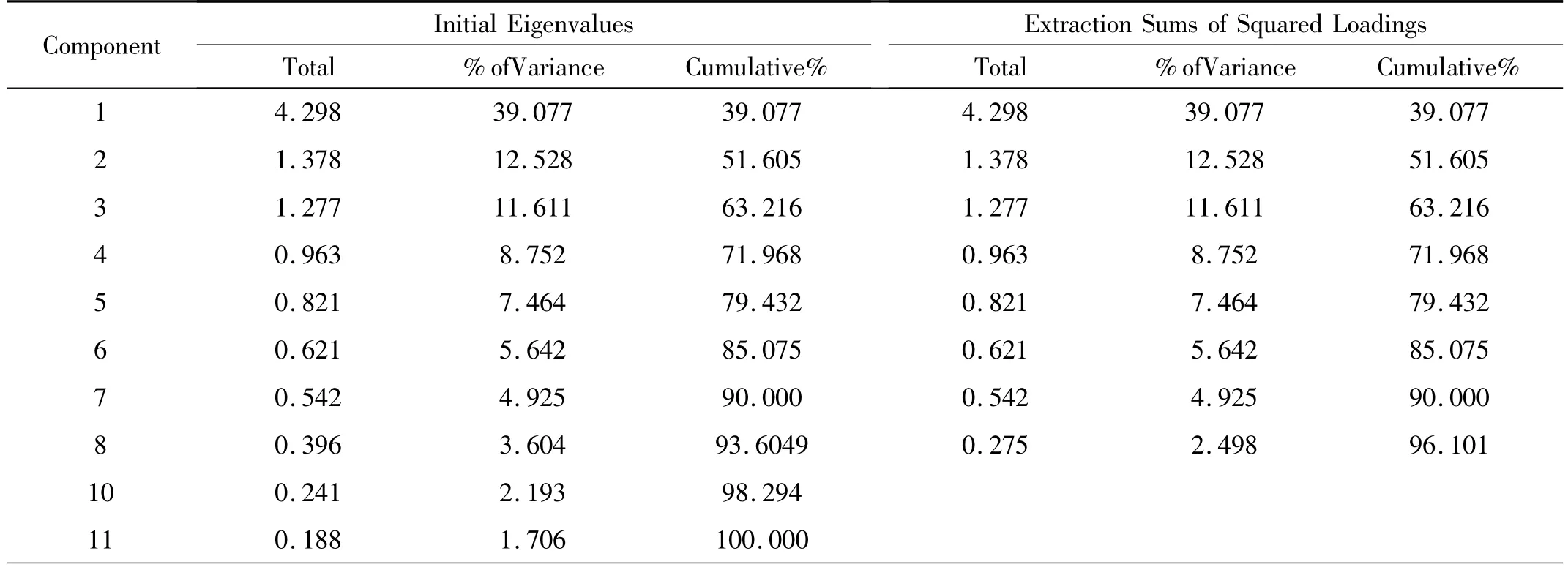
表5 各主成分的特征值及贡献
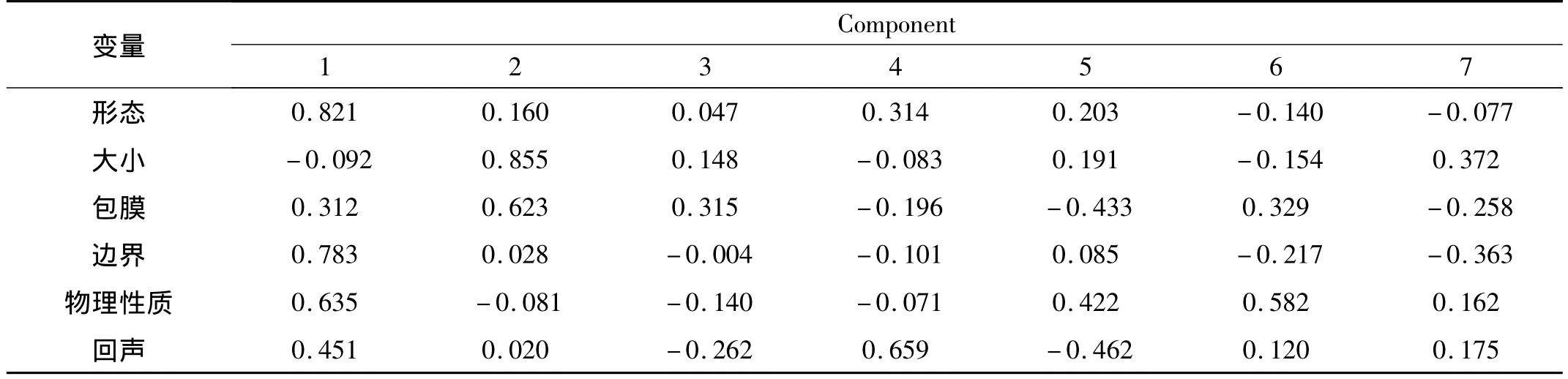
表6 前7个主成分因子载荷矩阵
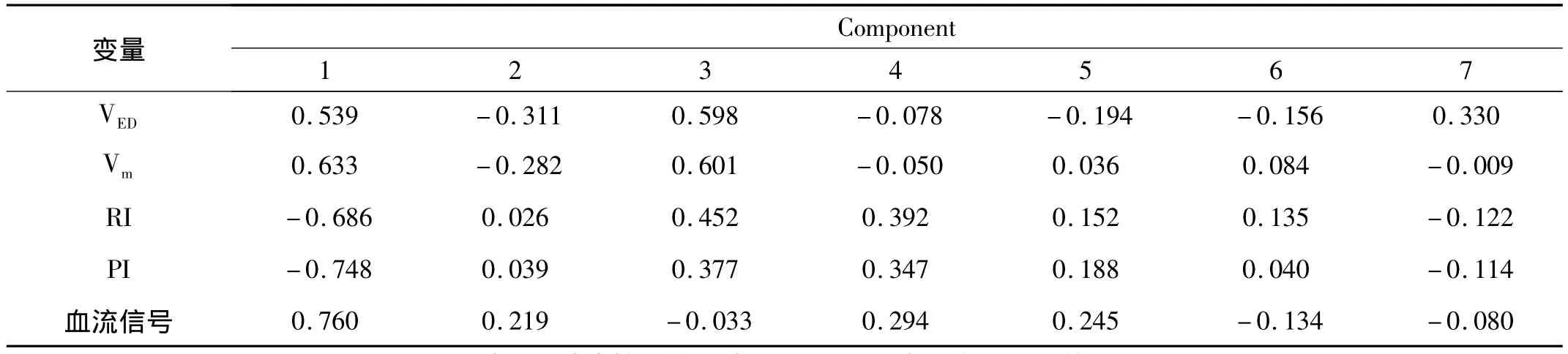
变量Component 1 2 3 4 5 6 7 VED 0.539 -0.311 0.598 -0.078 -0.194 -0.156 0.330 Vm 0.633 -0.282 0.601 -0.050 0.036 0.084 -0.009 RI -0.686 0.026 0.452 0.392 0.152 0.135 -0.122 PI -0.748 0.039 0.377 0.347 0.188 0.040 -0.114血流信号0.760 0.219 -0.033 0.294 0.245 -0.134 -0.080

表7 肿瘤性质的主成分Logistic回归系数及OR值
2.6 模型的诊断性能评价 根据Logistic回归模型,回代每个样本,ROC 曲线下面积(AUC)为 0.935(95%CI:0.894-0.976),Std.Error=0.021,大于任何单一指标的 AUC,P=0.000,在Youden指数最大(0.759)点切割,模型判断恶性肿瘤的敏感性(Sensitivity)90.7%,特异性(Specificity)85.2%,一致率 88.24%。McNemarTest,P=0.804。见表 8,图 1。
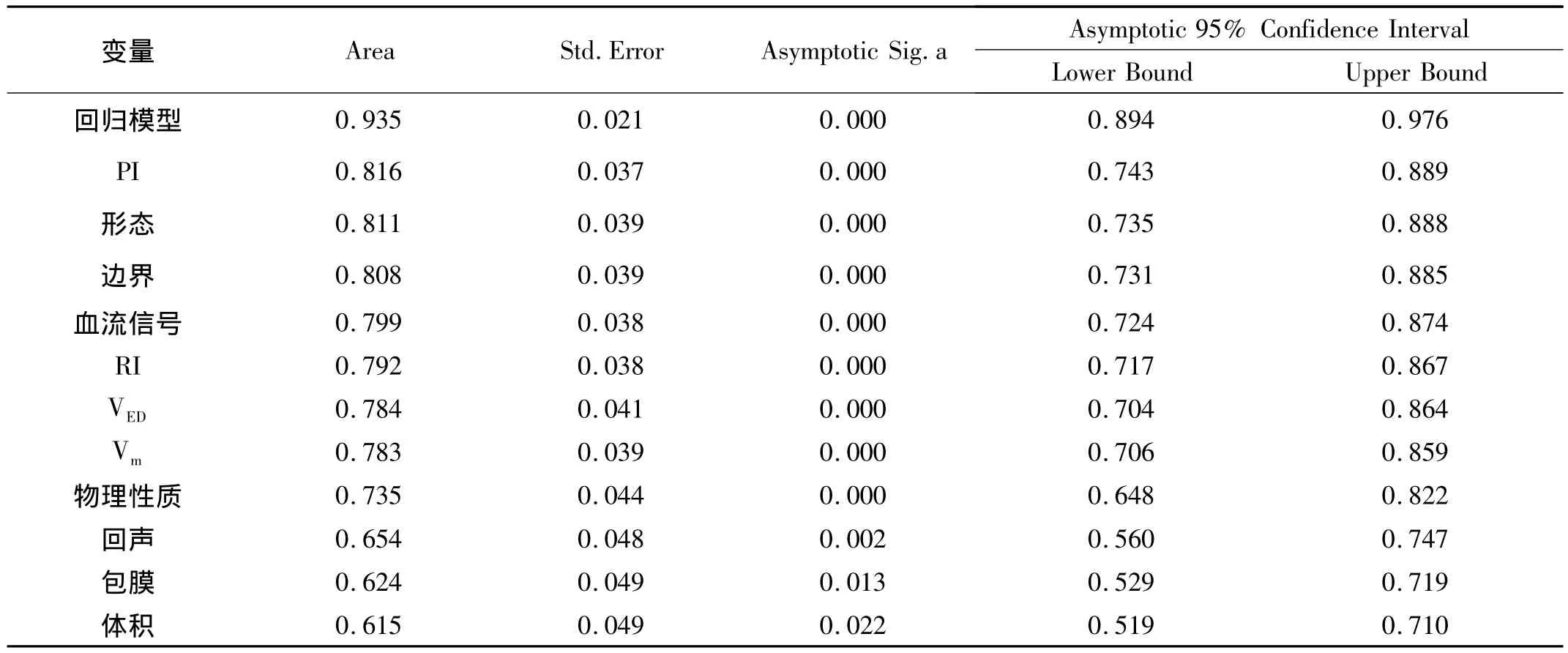
表8 主成分回归模型及其单一指标诊断卵巢恶性肿瘤的ROC曲线面积
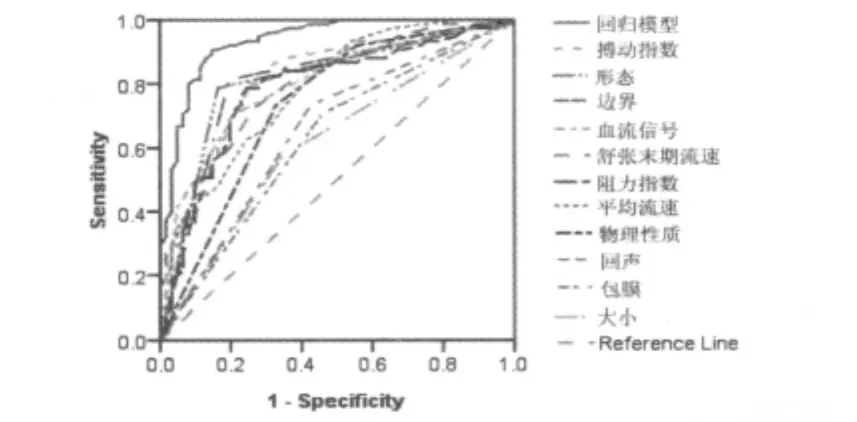
图1 卵巢肿瘤良恶性质的ROC曲线分析
3 讨论
有关彩色多普勒超声检查对卵巢肿瘤良、恶性鉴别诊断的报道很多,但多为回顾性单因素分析,缺乏多因素参与下的综合定量评定,有的仅仅是凭经验鉴别诊断,虽然有一定的敏感性和特异性,但仍存在较大程度的误诊或漏诊。因此,本研究采用前瞻性研究,通过主成分Logistic回归建立预报概率模型,主成分Logistic回归是通过主成分变换,将高度相关的变量信息综合成相关性较低的主成分,可以有效的减弱自变量间的共线性的影响,又可以减少重要信息的丢失。克服了逐步Logistic回归掩盖某些有实际意义变量的不足[4]。
相关文献显示:单纯超声检查能够精确地评估卵巢肿瘤的性质的敏感度为62% ~100%,特异度为73% ~95%[5]。单独采用血流参数诊断卵巢恶性肿瘤的敏感性80.8%,特异性86.9%[6]。TsiliAC等[7-8]研究指出:运用多变量综合比单用超声形态学或者单纯多普勒有更好的预测卵巢性质的效果。本文单因素分析显示:良性恶性肿瘤在形态、体积、包膜、边界、回声、物理性质、血流信号、VED、Vm、RI和PI方面存在统计学差异。应用主成分Logistic拟合数据,建立Logistic回归模型,其判断卵巢肿瘤为恶性的ROC曲线AUC=0.935,大于任何单一指标的AUC;模型的敏感性90.7%,特异性85.2%,一致率88.24%,与病理结果比较无统计学差异。说明单独超声或单独血流频谱对良、恶性肿瘤进行鉴别诊断有一定的局限性,综合多指标对其性质的判断更有价值。但也应认识到:多指标综合鉴别卵巢的良恶性质亦非尽善尽美,当恶性病灶内部出现坏死液化或良性病灶出现机化、钙化及血管异常增生时,也会导致误判[9]。
本资料 OR形态=16.844,OR体积=1.641,OR包膜=1.893,OR边界=25.945,OR回声=6.653,OR物理性质=3.439,ORVED=1.265 ORVm=1.260,ORPI=0.046,ORRI=0.052,OR血流信号=7.135,提示肿瘤形态不规则、体积≥300 cm3,包膜不明显、边界不清晰、回声不均、物理性质表现为实性、VED、Vm值高、PI、RI值低者恶性程度高。有关肿瘤形态和边界对肿瘤性质的鉴别诊断已基本达成共识,本文也得到了同样的结果。初银珠等[10]对95例卵巢肿瘤的彩色多普勒超声血流形态学和血流动力学检查显示:RI在良恶性卵巢肿瘤之间是最有意义的指标,当RI界值定为0.51时,其鉴别良恶性卵巢肿瘤的敏感性和特异性分别为98.0%,96.2%;谢梦等[11]研究显示:卵巢肿瘤内部血流 RI<0.4 的肿瘤为恶性的可能性要大于RI≥0.4者;王黎明等[12]对180例附件肿块影像学多元logistic回归认为:平均血流速度是判断肿瘤恶性程度的独立因素,流速每增加1 cm/s,其卵巢肿瘤恶性可能性将增加1.119倍(P=0.000)。不同肿瘤的血管组成和血供有其自身的特点,良性肿瘤血管形成较慢,恶性肿瘤由于其高代谢和肿瘤组织的快速生长,血管形成较多,其新生血管管壁薄,仅覆盖一层内皮细胞,缺乏完整的平滑肌细胞和弹力纤维[13]。在肿瘤血管分级的研究方面,顾蔚蓉等[14]对卵巢肿瘤患者注射Levovist多普勒信号增强剂后,显示卵巢良性肿瘤血管多位于肿瘤周围,光滑,直或轻度扭曲,见稀疏分支,血管间无分流;而恶性肿瘤在造影后其血管数目较良性肿瘤明显增多,肿瘤周围血管呈树枝状、蟹足状伸入瘤内,走行不规则,扭曲度明显增加,肿瘤内部血管呈繁星点状、团簇状。Angeid-Backman等[15]探查到良性肿瘤中98%的血流信号位于肿瘤周边,即使肿瘤内探到血流信号,也以静脉血流为主,而恶性肿瘤多在肿瘤中央区探及丰富的动脉血流信号,良性肿瘤血管排列较规则,恶性肿瘤血管排列杂乱。这些特点解释了卵巢恶性肿瘤组织内部的血流为低阻抗、高速度型的频谱特征[16]。
综上,卵巢良、恶肿瘤在形态则、体积,包膜、边界、回声、物理性质、VED、Vm、PI、RI有显著差异。单一指标不可能涵盖肿瘤良、恶性质的所有特征,多指标综合分析才有助于肿瘤良、恶性质的鉴别。当然,彩色多普勒超声检查只是卵巢肿瘤术前的辅助诊断,并非是诊断肿瘤性质的金标准。因此,临床除以上指标作为卵巢肿瘤性质的鉴别诊断外,还应考虑患者的年龄、遗传因素、血清CA125水平和妇科表现综合分析,提高卵巢恶性肿瘤早期综合诊断的水平。
[1]Joshi M,Ganesan K,Munshi HN,et al.Ultrasound of adnexal masses[J].Semin Ultrasound CT MR,2008,29(2):72-97.
[2]Timmerman D,Verrelst H,Collins WP et al.Distinguishing the benign and malignant adnexal mass:an external validation of prognostic models[J].Gynecol Oncol,2001,80(2):162-167.
[3]丁元林,孔丹莉,毛宗福.多重线性回归分析中的常用共线性诊断方法[J].数理医药学杂志,2004,17(4):299-300.
[4]苏齐鉴,臧宁,肖信,等.主成分Logistic回归模型在消除数据多重共线性中的应用[J].中国卫生统计,2009,26(2):206-208.
[5]于兴江,王沂峰,江森,等.RMI1和RMI2在卵巢肿瘤定性诊断中价值的比较[J].中国现代医学杂志,2001,11(6):55-56,58.
[6]齐铮琴,赵玉珍,杨漪,等.经阴道彩色多普勒超声诊断卵巢良恶性肿瘤的价值[J].中国医学影像学杂志,2007,15(3):173-175.
[7]Tsili AC,Tsampoulas C,Charisiadi A et al.Adnexal masses:accuracy of detection and differentiation with multidetector computed tomography[J].Gynecol Oncol,2008,110(1):22-31.
[8]Smoleń A,Czekierdowski A,Danio J et al.Sonoangiography and logistic regression analysis in the preoperative differentiation of ovarian tumors[J].Ginekol Pol,2002,73(11):1 053-1 060.
[9]刘淑霞,陈荣川,刘艳丽,等.卵巢肿瘤良恶性的彩色多普勒超声预测模型[J].中国医学影像技术,2009,25(7):1 325-1 326.
[10]初银珠,张艳华,郑秀兰,等.彩色多普勒超声对卵巢肿瘤的诊断价值[J].中华超声影像学杂志,2004,13(7):536-538.
[11]谢梦,张旭垠,周毓青,等.卵巢肿瘤内部血流阻力指数与Ki67及Snail表达的关系[J].中国实用妇科与产科杂志,2008,24(4):692-792.
[12]王黎明,付庆诏,冯天瑾,等.人工神经网络在超声诊断附件包块良恶性中的应用[J].中华超声影像学杂志,2004,13(8):597-600.
[13]Emoto M,Iwasaki H,Mimura K,et al.Differences in the angiogenesis of benign and malignant ovarian tumors,demonstrated by analyses of color Doppler ultrasound.immunohistochemistry,and microvessel density[J].Cancer,1997,80(5):899-907.
[14]顾蔚蓉,丰有吉,张珏华.Levovist在超声鉴别诊断卵巢良恶性肿瘤中的应用研究[J].中华超声影像学杂志,2003,12(9):534-537.
[15]Angeid-Backman E,Coleman BG,Arger PH,et al.Comparison of resistive index versus pulsatility index in assessing the benign etiology of adnexal masses[J].Clin Imaging,1998,22(4):284-291.
[16]Hall GH,Turnbull LW,Bedford K,et al.Neuropilin-1 and VEGF correlate with somatostatin expression and microvessel density in ovarian tumours[J].Int J Oncol,2005,27(5):1 283-1 288.
