神经活性甾体与精神分裂症
2012-06-02江沛刘艺平李焕德蔡骅琳张利明
江沛 刘艺平 李焕德蔡骅琳 张利明
传统观念认为甾体激素在体内通常与细胞内受体结合来诱导或者抑制基因的表达,在调节机体电解质的平衡、生殖基础、免疫功能等方面起着必不可少的作用[1]。随着近年来在中枢神经系统中一系列甾体激素作用位点的发现,越来越多的研究表明这些甾体激素不仅能调节基因的表达,还能对很多神经递质受体有快速的调节作用,进而影响相应递质的合成与释放。其长期作用则能对抗氧化应激、促进神经元发育成熟、调节情绪及记忆,与中枢神经系统的发育成熟有密切的关系。神经活性甾体便是指这些能够对神经系统起到调节作用 的 甾 体 激 素[2], 主 要 包 括 : 雌 激 素 (estrogen)、 睾 酮 (testos⁃terone)、脱氢表雄酮(dehydroepiandrosterone, DHEA)、孕烯醇酮(pregnenolone)等。本文也就近年来部分神经活性甾体与精神分裂症的相关研究进行综述。
1 合成与代谢
在人体内神经活性甾体主要由外周内分泌腺(性腺、肾上腺)和神经系统一同合成,其合成的第一步都是由胆固醇转运进入线粒体,经细胞色素P450酶代谢,侧链裂解后生成孕烯醇酮(pregnenolone);最后由孕烯醇酮分别经3β⁃羟类固醇脱氢酶(3β⁃hydroxysteroid dehydrogenase,3β⁃HSD)、5α⁃还原酶(5α⁃reduc⁃tase)、17β⁃羟类固醇脱氢酶 (173β⁃hydroxysteroid dehydrogenase,17β⁃HSD)及芳构化酶(aromatase)等一系列酶促反应进一步代谢生成(如图1)。这些酶类在中枢神经系统中均有表达,从而保证了这些甾体对中枢神经系统快速高效的局部调控作用[3]。
2 雌激素
2.1 流行病学研究 早在上世纪开始许多精神学家便已经认识到雌激素与精神分裂症之间可能存在某种联系。描述性精神病学创始人之一克雷佩林第一次对精神分裂症妇女体内低的雌激素水平进行了报道,并根据月经周期创立了单独的诊断体系。流行病学调查发现女性精神分裂症发病的第一个高峰一般为20~29岁,而男性较为集中在15~24岁。女性在45~54岁即更年期前后通常伴随着发病的第二个高峰,且男性患精神分裂症的可能是女性的1.4倍[4]。这些数据均表明雌激素对精神分裂症的发生有一定防治作用。
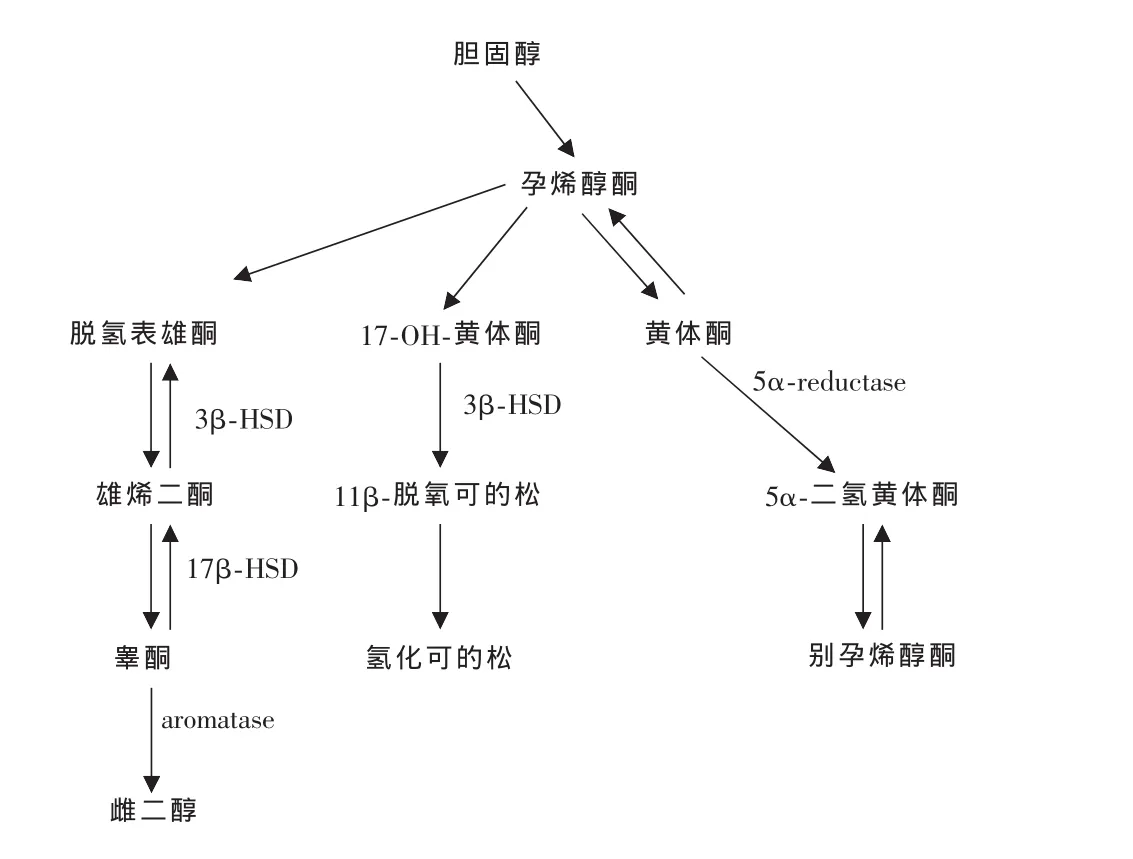
图1 部分神经活性甾体的体内合成过程
2.2 临床观察与辅助治疗 女性首发精神分裂症患者体内雌激素及促性腺激素往往处于较低水平,有研究表明与正常组相比患者体内雌二醇水平有明显的降低,且体内雌二醇水平与患者认知功能显著相关[5]。女性在正常生理周期中往往伴随着雌激素水平大幅度的波动,Bergemann等[6]则对有正常月经周期的女性患者分别在卵泡期、排卵期、黄体期时体内雌激素水平阳性与阴性症状量表 (positive and negative syndrome scale, PANSS)、简明精神病量表(brief psychiatric rating scale,BPRS)评分之间的相关性进行研究,数据显示患者的PANSS评分与雌激素水平高度相关,在排卵期高雌激素水平时患者表现出明显症状的改善。而将雌激素用于精神分裂症的辅助治疗后发现,与单独服用抗精神病药物相比雌激素辅助治疗能够更为明显地改善临床症状,并通过进一步实验表明这种雌激素的辅助作用有一定的剂量依赖性[7]。同时单单服用雌激素也能对精神分裂症状有所改善,说明雌激素不仅能加强抗精神分裂药物的治疗作用,其本身对精神分裂症就有一定的疗效[8]。与此同时临床数据表明,选择性雌激素受体调节剂(selective estrogen receptor modulator, SERM)雷洛昔芬对精神分裂症也有一定防治作用[9]。
2.3 机制研究 现在普遍认为精神分裂症是一种患者在胎儿或幼儿时期由基因及环境因素所引起的神经发育异常(neurodevelopmental disorder)而导致的疾病。与早期感染、应激、营养不良等因素一样,性激素也能够对神经系统的发育成熟产生深远的影响[10]。基础研究表明雌激素能够较好起到改善脑血流量、增加糖利用、促进神经元发育及髓鞘化过程、增加突触密度与可塑性、对抗氧化应激和抑制细胞凋亡等作用,而雌激素的长期作用可能对神经发育及大脑的形态学产生影响。精神分裂症病人较低的雌激素水平则可能是致病因素之一,而不简单只是由于长期服用抗精神病药引起高催乳素水平进而导致的药物不良反应[11]。
精神分裂症病人由于缺乏中枢信息的加工保护一般会出现前脉冲抑制(prepulse inhibition,PPI)降低的现象,而长期给予卵巢切除(ovariectomized,OVX)大鼠雌激素能够阻断甚至逆转由 N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)受体阻断剂MK-801及多巴胺受体激动剂阿扑吗啡等精神分裂症模型药物所介导的PPI的降低[12]。雌激素及雌激素受体激动剂能显著提高OVX大鼠前额叶皮质及海马部位单胺类神经递质水平,这也可能与其能改善患者认知水平有关[13]。同时雌激素能够显著上调伏隔核DA转运体,抑制DA2受体表达,这也可能是雌激素对精神分裂症的潜在治疗机制之一[14]。
3 睾酮
对于睾酮与精神分裂症之间的关系研究较少,其在精神分裂症中是起到预防及治疗作用还是风险因素之一也仍存在较大的争议。很多研究者认为男性发病年龄较小与体内的睾酮水平升高有关,动物实验也表明睾酮能够增强5-HT1a介导的对雄性大鼠PPI的破坏,但在雌性大鼠中却没有得到相同的结果[12]。然而临床观察发现,在首发男性患者体内雌激素与雄激素都有一定的降低。最近Van等[15]对有精神分裂症前驱症状的男性唾液中睾酮含量进行分析也取得了相同的结果,同雌激素一样,睾酮水平的降低可能也与精神分裂症的发生有关。但到目前为止仅有一项实验对睾酮辅助精神分裂症的治疗进行了临床评价,研究发现睾酮能够显著改善患者的阴性症状与认知能力[16],为其进一步辅助抗精神分裂症药物的临床治疗提供了依据。
4 脱氢表雄酮
脱氢表雄酮及其硫酸盐 (dehydroepiandrosterone sulfate,DHEAS)对GABAA受体及NMDA受体都有变构调节作用,DHEA(S)能够快速的促进前额叶皮质谷氨酸(glutamic,Glu)的释放,且这种促进作用可能与DHEA(S)对认知的改善有关。动物实验表明DHEA(S)不仅能促进雄性大鼠脑内Glu的释放,还对过量Glu-NMDA介导的神经毒性产生一定的保护作用[17]。此外 DHEA(S)能够增强海马的胆碱能作用,促进神经元的生长与突触的形成,抑制下丘脑-腺垂体-肾上腺(hypothalamic pituitary adrenal,HPA)轴的活性。而这些都与情绪稳定及精神分裂症的发生发展有关[18]。
临床研究表明在精神分裂症的治疗过程中合用DHEA后随着患者体内DHEA(S)水平的升高阴性症状得到了明显的改善[19]。由于 DHEA(S)是睾酮的前体物质,该研究并对体内睾酮水平进行测定,合用DHEA后并无伴随着睾酮水平的升高,说明DHEA(S)本身就能起到一定的抗精神分裂症的作用。而无论是精神分裂症的阴性及阳性症状,患者都是处于一定的应激状态即HPA轴激素水平的升高,DHEA(S)能够对HPA轴表现出明显的抑制作用。因此一部分学者对DHEA(S)与皮质醇之间的比例与精神分裂症状评分二者的相关性进行了分析,其比值的升高与阴性症状及认知能力的改善之间的关 系 表 现 的 更 为 确 切[20]。
5 孕烯醇酮
5.1 临床研究 孕烯醇酮作为大部分神经活性甾体的前体在精神分裂症的发生发展中所起到的作用也一直受到很多研究者的重视。临床研究表明无论是男性还是女性患者,较正常人相比体内孕烯醇酮水平都有明显的降低,但DHEA与孕烯醇酮的比例有所升高,即孕烯醇酮更多的转化为了DHEA,这可能与精神分裂症病人代偿性的生成了更多的DHEA有关[21]。目前孕烯醇酮对精神分裂症的临床疗效正处于初步探究阶段,Marx等[22]第一次对孕烯醇酮的临床应用进行了报道:研究发现精神分裂症病人对孕烯醇酮耐受情况较好,连续8周每天分两次服用500 mg孕烯醇酮没有出现任何其它不良反应,且随着体内孕烯醇酮的升高患者阴性症状与认知能力得到了显著的改善。后续又对孕烯醇酮的临床疗效进行了长达数年的跟踪,阴性症状量表评分发现服用孕烯醇酮500 mg/d在8周内使阴性症状减轻30%,连续服用两年左右则减轻50%以上[23]。对不同剂量的孕烯醇酮与DHEA的临床疗效对比发现,服用30 mg/d孕烯醇酮能够较好的降低患者的阳性症状评分与锥体外系反应,且效果较400 mg/d DHEA更为明显。而200 mg/d孕烯醇酮相较低剂量而言并不能对精神症状有明显的改善[24]。以上临床试验由于样本量较小且有一定的脱落(3次试验共85例),关于孕烯醇酮对精神分裂症的临床疗效也有待进一步确证。
5.2 机制探讨 除DHEA(S)外,孕烯醇酮的代谢产物:孕烯醇酮硫酸盐(pregnenolone sulfate, PS),别孕烯醇酮(allopregnanolong,AP)也均有很强的神经活性。PS对NMDA受体有变构激活作用从而对精神分裂症病理机制之一“谷氨酸假说”即谷氨酸水平底下、NMDA受体反应性降低有一定对抗作用。动物研究表明PS能够对抗他卓西平马来酸盐(MK-801)引起的记忆损伤,显著改善大鼠的学习与记忆能力,促进Ach的释放,抑制神经元凋亡。AP作为GABAA受体强的激活剂,其作用强度甚至超过临床使用的很多苯二氮卓类与苯巴比妥类镇静催眠药物,因此其强的镇静及抗焦虑作用也引起了广泛的重视[25]。
值得注意的是很多研究表明孕烯醇酮在体内能够很快的被代谢为PS与AP,单剂量注射孕烯醇酮后能够很快的提高PS与AP的脑内浓度,因此孕烯醇酮显著的临床作用可能与其下游的代谢产物有关。此外动物实验表明奥氮平与氯氮平能够显著升高脑内孕烯醇酮与AP水平,而利培酮、氟哌啶醇、齐拉西酮等抗精神病药物却对二者不产生明显的作用,这可能是奥氮平和氯氮平其特殊的抗焦虑、抗抑郁作用的原因之一[26]。
6 展望
精神分裂症的神经发育假说认为:精神分裂症的产生可能是由基因决定的易感体质和出生前后干扰中枢神经系统正常发育的环境因素之间交互作用的结果,这些因素进而导致了大脑结构与神经递质系统的异常。越来越多的实验表明甾体激素在神经系统的发育成熟中起着至关重要的作用,于是Brown等[27]提出精神分裂症的内分泌失调(endocrine disrup-tion)假说,实验发现如双酚A等长期暴露能够严重干扰体内甾体激素水平的物质都可以造成认知能力下降与自闭等精神症状。随着研究的深入,包括维生素D在内的很多其它的甾体都被归入神经活性甾体范围,这些甾体在精神分裂症及其它神经精神疾病中的作用也越来越受到重视,“内分泌基础”的失衡作为精神分裂症发生发展的重要因素之一也为该疾病的进一步研究寻找到了新的突破。
[1]Panzica GC, Balthazart J, Frye CA, et al. Milestones on steroids and the nervous system years of basic and:10 Translational Research[J].J Neuroendocrinol, 2012,24(1):1-15.
[2]Melcangi RC, Panzica G,Garcia LM.Neuroactive steroids: focus on human brain[J].Neuroscience, 2011,191(15):1-5.
[3]Schule C, Eser.D, Baghai TC, et al.Neuroactive steroids in affective disorders: target for novel antidepressant or anxiolytic drugs[J].Neuroscience, 2011,191(15):55-77.
[4]Markham JA.Sex steroids and schizophrenia [J].Rev Endocr Metab Disord, 2012,13:187-207.
[5]陈静,邹涛,朱祥路.女性首发精神分裂症患者的性腺激素水平与认知功能的关系研究[J].中国神经精神疾病杂志,2008,34(12):737-739.
[6]Bergemann N, Parzer P, Runnebaum B, et al.Estrogen, menstrual cycle phases, and psychopathology in women suffering from schizophrenia[J].Psychol Med, 2007,37(10):1427-1436.
[7]Kulkarni J.Oestrogen: a new treatment approach for schizophrenia[J].Med J Aust, 2009,190(16):37-38.
[8]Tunde AM,Singh AK,Marsden K.Improved functioning in a women with schizophrenia on exclusive therapy with oestrogen pills[J].Australas Psychiatry, 2008,10(4):403-404.
[9]Kulkarni J, Gurvich C, Lee SJ, et al.Piloting the effective therapeutic dose of adjunctive selective estrogen receptor modulator treatment in postmenopausal women with schizophrenia[J].Psychoneuroendocrinology, 2010,35(8):1142-1147.
[10]朱芙蓉,郑英君,赵靖平.精神分裂症的环境因素致病假说[J].国际精神病学杂志, 2011,38(3):146-150.
[11]Wieck A.Oestradiol and psychosis: clinical findings and biological mechanisms[J].Curr Top Behav Neurosci, 2011,8(17):173-187.
[12]Gogos A, Kwek P, Buuse M.The role of estrogen and testosterone in female rats in behavioral models of relevance to schizophrenia[J].Psychopharmacology.2011; DOI: 10.1007/s00213-011-2389-y.
[13]Chavez C, Hollaus M, Scarr E, et al.The effect of estrogen on dopamine and serotonin receptor and transporter levels in the brain: An autoradiography study[J].Brain Research, 2010,1321(19):51-59.
[14]Huber TJ, Tettenborn C, Leifke E, et al.Sex hormones in psychotic men[J].Psychoneuroendocrinology, 2005,30(1):111-114.
[15]Van RS, Aleman A, de Sonneville L, et al.Neuroendocrine markers of high risk for psychosis: Salivary testosterone in adolescent boys with prodromal symptoms[J].Psychol Med.2011,41(9):499-508.
[16]Ko YH,Lew YM,Jung SW,et al.Short-term testosterone augmentation in male schizophrenics: a randomized, double-blind,placebo-controlled trial[J].J Clin Psychopharmacol, 2008,28(4):375-383.
[17]Lhullier FL, Nicolaidis R, Riera NG, et al.Dehydroepiandrosterone increases synaptosomal glutamate release and improves the performance in inhibitory avoidance task. Pharmacol [J].Biochem Behav, 2004,77(3):601-606.
[18]Maninger N, Wolkowitz OM, Reus VI, et al.Neurobiological and neuropsychiatric effects of dehydroepiandrosterone (DHEA)and DHEA sulfate (DHEAS)[J].Front Neuroendocrinol, 2009,30(1):65-91.
[19]Strous RD.Dehydroepiandrosterone(DHEA) augmentation in the management of schizophrenia symptomatology [J]. Essent Psychopharmacol, 2005,6(3):141-147.
[20]Ritsner M, Gibel A, Maayan R, et al.State and trait related predictors of serum cortisol to DHEA (S) molar ratios and hormone concentrations in schizophrenia patients[J].Eur Neuropsychopharmacol, 2007,17(4):257-264.
[21]Ritsner M, Gibel A, Ram E, et al. Alterations in DHEA metabolism in schizophrenia: two-month case-control study[J].Eur Neuropsychopharmacol, 2006,16(2):137-146.
[22]Marx CE, Keefe RS, Buchanan RW, et al.Proof-of-concept trial with the neurosteroid pregnenolone targeting cognitive and negative symptoms in schizophrenia[J].Neuropsychopharmacology,2009,34(8):1885-1903.
[23]Savitz AJ.Multi-year continuation study of pregnenolone in patients with schizophrenia[J].Biol Psychiatry, 2010,67(9):225.
[24]Ritsner MS, Gibel A, Shleifer T, et al.Pregnenolone and dehydroepiandrosterone as an adjunctive treatment in schizophrenia and schizoaffective disorder: an 8-week, double-blind, randomized, controlled, 2-center, parallel-group trial[J].J Clin Psychiatry, 2010,71(10):1351-1362.
[25]Marx CE, Bradford DW, Hamer RF, et al.Pregnenolone as a novel therapeutic candidate in schizophrenia:emerging preclinical and clinical evidence[J].Neuroscience, 2011,191(15):78-90.
[26]Marx CE, Shampine LJ, Duncan GE, et al.Clozapine markedly elevates pregnenolone in rat hippocampus, cerebral cortex, and serum: Candidate mechanism for superior efficacy[J].Pharmacol Biochem Behav, 2006,84(4): 598-608.
[27]Brown JS JR.Effects of bisphenol-A and other endocrine disruptors compared with abnormalities of schizophrenia: an endocrine-disruption theory of schizophrenia[J].Schizophr Bull,2009,35(1):256-278.
