弥散张量成像在大鼠脑胶质瘤模型中的应用
2012-04-20伍碧武张义
伍碧武张义
·综述·
弥散张量成像在大鼠脑胶质瘤模型中的应用
伍碧武*张义△
弥散张量成像 大鼠 脑胶质瘤模型
脑胶质瘤是中枢神经系统最常见的一种恶性肿瘤,呈弥漫浸润性生长,与周围组织分界不清,与重要神经纤维束关系紧密。这种生物学特性使术者很难在肉眼或显微镜下真正做到肿瘤全切除,肿瘤留有残余,术后易复发,扩大切除范围则容易损伤正常白质纤维束,造成相应的神经功能障碍。如何明确肿瘤的边界及其与白质纤维束之间的关系,是目前亟待解决的问题[1]。20世纪 90年代中期[2],磁共振弥散张量成像(diffusion tensor imaging,DTI)作为一种新的MRI技术为人所知,它借助水分子弥散的方向信息,可定性定量分析神经纤维细微变化,直观显示脑肿瘤与白质纤维束之间的关系。但DTI显示的病变范围往往超出常规MRI,在患者身上无法实现组织病理学与影响学的点对点分析。因此,在合适的胶质瘤模型上进行DTI研究将有助于解决这一问题。本文就DTI在大鼠脑胶质瘤模型中的应用作一综述。
1 用于DTI研究的大鼠脑胶质瘤模型
19世纪70年代中期,大鼠胶质瘤模型开始应用于影像学技术(MRI、MRS)的评估,并促进了功能影像学的发展。随着DTI的出现,由于其显示的病灶范围广于传统MRI,动物模型在病理学与影像学研究之间起到了很好的桥梁作用。目前应用于DTI研究的大鼠胶质瘤模型主要有四种[3-4]:①9L胶质肉瘤型(9L gliosarcoma),该型是将N-甲基亚硝基脲(N-methylnitrosourea,MNU)根据5 mg/kg的剂量,连续注射至Fisher344大鼠约26周诱发而成,9L细胞呈纺锤状,肿瘤外形同肉瘤,呈非浸润性,边界清楚;②C6胶质瘤型(C6 glioma),该型诱发方式类似于9L型,连续注射MNU至Wistar大鼠约32周诱发而成,C6细胞核呈多形性,肿瘤生长速度较快,呈浸润性生长;③F98胶质瘤型(F98 glioma),由N-乙基N-亚硝基脲(N-ethyl-N-nitrosourea,ENU)以50 mg/kg注射至妊娠的Fischer344大鼠诱发而成,F98细胞呈纺锤形,它是一种未分化的神经胶质瘤,肿瘤生长的生物学行为与人多形性胶质母细胞瘤(GBMs)相似,呈高侵袭性和低免疫原性;④Mayo-22人脑肿瘤异种移植型(Mayo 22 Human Brain Tumor Xenograft),该型由人脑肿瘤异种移植到裸鼠制成[5],肿瘤呈缓慢浸润性生长。
2 DTI主要参数及条件控制
DTI是在弥散加权成像的基础上施加至少6个非共线性方向的扩散敏感梯度而获取的影像[2],其主要参数中以部分各向异性(fractional anisotropy,FA)值的应用最为广泛,它表示水分子各向异性成分占整个弥散张量的比例,其范围为0-1,0代表最大各向同性弥散,1代表最大各向异性弥散。经特定软件后处理生成的方向编码彩色图 (directionally encoded color,DEC图)[6]可以从二维层面显示全脑的纤维走行方向,而在此基础上发展起来的弥散张量纤维束示踪成像 (diffusion tensor tractography,DTT)[7]则能够直观描述主要白质纤维束的空间分布。
获取优质的影像[信噪比(signal to noise ratio,SNR)>20]是DTI研究成功的一个重要条件。然而,与人脑相比,大鼠的脑体积小、白质纤维数量少以及自主运动难控制等[8],均对影像技术提出了较高的要求。首先,用于大鼠DTI研究的扫描仪磁场强度较高,多为4.7-14.1T[9],得到图像分辨率更高,可以发现细微改变。其次,用于人脑DTI扫描的序列往往采用平面回波成像(EPI),这种序列极易受磁场不均匀性(主要源于人/动物磁化率的空间变化)的干扰,并且这种空间扭曲程度与磁场强度相关,场强越大(>4.7T),图像扭曲越严重、分辨率越低,因此,用于大鼠DTI研究多采用单次或多次自旋回波序列。另外,水分子的扩散易受运动与温度等的影响,在对大鼠进行DTI扫描时常采用1%~2%异氟醚麻醉,以尽量控制伪影产生。
3 DTI在大鼠脑胶质瘤模型中的应用
3.1 区分肿瘤与肿瘤周边正常组织由于肿瘤病变组织内轴突丧失了排列的方向和顺序性、瘤细胞微结构破坏及瘤细胞的侵袭作用所导致的神经纤维髓鞘结构丢失,使得FA值降低,因此在理论上来看,DTI可用于评估胶质瘤对脑白质的侵袭程度[10]。Deng等[11]认为胶质瘤瘤周水肿区因含有肿瘤细胞浸润而造成FA值降低,并具有距离上的差异,因此瘤周水肿区的FA值能准确反映胶质瘤瘤周浸润的程度,FA值可做为评价肿瘤浸润的指标,区分脑肿瘤与肿瘤周边正常组织。Zhang等[5]将9L、F98株细胞和取自胶质母细胞瘤患者的人型胶质母细胞瘤细胞(Mayo-22)种植到大鼠尾状核区让其生长,再用4.7T磁共振扫描仪分别行T2WI、DWI及DTI观察颅内长肿瘤大鼠脑组织损伤情况。常规T2WI、DWI可于接种10 d后观察到种植区域肿瘤生长,肿瘤组织呈均匀高信号,而DTI则发现肿瘤病灶中心区FA值降低,周边区FA值升高。另外,在9L和F98肿瘤周边,DTI观察到水分子弥散方向平行于肿瘤表面,两者生长方式相似,而在Mayo-22肿瘤周边,水分子弥散方向垂直于肿瘤表面 (图1)。这一结果与组织病理学表现一致,作者认为DTI能够从细胞水平反应肿瘤微观结构,并能在活体上模拟肿瘤的生长。在此基础上,Kim等[12]利用DTI证实F98型较9L型具有更强的侵袭性。Lope-Piedrafita等[13]用DTI纵向观察大鼠神经胶质瘤模型脑组织变化情况,先将C6细胞种植到大鼠脑内,再进行DTI检查,发现在早期肿瘤周边FA值升高,而到后期相应区域的FA值降低。结合组织病理学,他们推测这是由于早期肿瘤快速生长,并沿着肿瘤表面的法线方向压迫周边组织,使细胞从球形变成扁球形(平行于肿瘤表面),各向异性程度增加,FA值升高;后期随着肿瘤生长,浸润并破坏周围白质,各向异性程度减低,FA值降低。这一发现有利于DTI对肿瘤生长方式的区别。
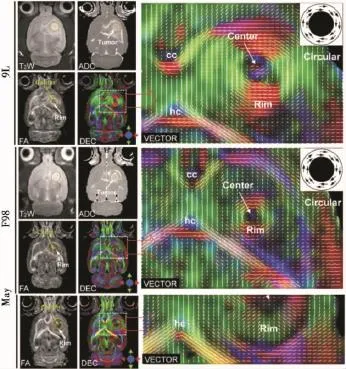
图1 示9L(接种后11 d)、F98(接种后10 d)、Mayo-22(接种后22 d)三种大鼠胶质瘤模型的MRI表现:T2WI、DWI图上肿瘤区呈高信号;FA图上肿瘤区各向异性值不同,中心低,外周高;向量图上,9L和F98肿瘤周边呈环状,Mayo肿瘤周边呈放射状;cc胼胝体,hc海马连合。图摘自Zhang JY,Van Zijl PC,Laterra J,et al.Unique pattens of diffusion directionality in rat brain tumors revealed by high-resolution diffusion tensor MRI[J].Medicine,2008,58(3):454-462.
3.2 显示肿瘤与白质纤维束的关系扩散是胶质瘤的特征之一,代表了瘤细胞的活动能力[14]。由于胶质瘤对有髓神经纤维具有高度的亲和性,故其扩散常沿着白质纤维束进行,呈各向异性扩散[15]。DTI的另一大优势是经软件处理生成的DEC、DTT可用来显示肿瘤和其毗邻的白质纤维束的关系[16],它是目前惟一可以在活体映射白质纤维束走行的无创性的影像学检查方法[17-18]。有学者[19]在临床研究中,依据彩色张量图把因肿瘤改变的脑白质轨迹模式分为4种不同表现:受压移位、中断、破坏、浸润。Kim等[12]分别把9L和F98细胞株种植到Fisher大鼠上,制作出两种不同侵袭特点的胶质瘤模型,然后在DEC图上完整的显示肿瘤与全脑纤维束的关系。利用示踪成像技术 (fiber tracking)在动物模型上重建主要神经纤维束,可以实现连续直观地观察肿瘤生长对主要神经纤维束的影响,并可经活体组织切片进行验证。Asanuma等[20]将C6胶质瘤细胞株种植于右侧大脑皮质,然后分别在1、2、3、4周进行DTI检查,经后处理软件生成DTT,主要重建胼胝体、运动区和扣带回的纤维束。结果显示在肿瘤生长第1周,肿瘤侧各纤维束形态及连续性完整,与对侧相近;第2周时出现轻度移位,连续性完整;3周后则明显的向腹侧或对侧移位,到第4周肿瘤占据整个半球,肿瘤周围纤维束消失,对侧纤维束也出现相应的移位,但连续性仍完整(图2),该结果与病理组织分析保持一致。

图2 示利用DTT动态观察(肿瘤种植后1~4周)肿瘤生长对白质纤维束的影响,棕色代表肿瘤,红色代左右走行的纤维束,绿色代表上下走行的纤维束,蓝色代表前后走行的纤维束,实心小箭头代表肿瘤侧胼胝体向对侧轻度移位,空心箭头代表肿瘤侧胼胝体消失,白色箭头代表对侧胼胝体向对侧(左侧)移位。图摘自Asanuma T,Doblas S,Tesiram YA,et al.Diffusion tensor imaging and fiber tractography of C6 rat glioma[J].J Magn Reson Imaging,2008,28(3):566-573.
3.3 鉴别放射性坏死与肿瘤复发胶质瘤浸润性生长方式决定了其易复发,因此除手术切除肿瘤外,常辅以放化疗。但是放疗过程中可能损伤正常脑组织,导致放射性坏死,两者在常规 MRI上的表现相似,不易鉴别[21]。虽然目前有多种影像学技术,如MRS、动态对比增强MRI等[22]应用于肿瘤复发与放射性坏死的鉴别,但对其可靠性尚无统一认识。研究[23-24]认为,DTI参数中的FA值、表观弥散系数 (apparent diffusion coefficient,ADC)能够反映射线导致的白质损伤。Wang等[25]用40 Gy射线照射Fischer344大鼠诱发放射性坏死模型,并分别与9L、Mayo-22大鼠胶质瘤模型比较,DTI结果显示放射性坏死中心区的ADC值较周边区低,中心区的ADC值和周边区的FA值均较9L和Mayo-22低(图3),组织病理学的表现与FA值、ADC值的改变相吻合。作者认为DTI参数,主要是FA值和ADC值能够有效区分放射性坏死与肿瘤复发,为临床治疗提供方向。
4 不足与展望

图3 示三种模型(放射性坏死、Mayo-22、9L)MRI的不同表现,放射性坏死在ADC图上表现为中心区低信号、周边区高信号,FA图上表现为病灶整体各向异性程度降低;Mayo-22型和9L型表现相似,在ADC图上病灶整体呈高信号,在FA图上表现为中心区各向异性程度降低,周边区各向异性程度升高。图摘自 Wang S,Chen Y,Lal B,et al.Evaluation of radiation necrosis and malignant glioma in rat models using diffusion tensor MR imaging[J].J Neurooncol,2012,107(1):51-60.
首先,DTI作为一种年轻的影像学技术,其自身存在许多不足之处:①FA值易受组织的生化特性(粘滞度、温度)、组织结构(大分子、细胞膜和细胞器等)的影响[26],在胶质瘤的病理生理状态下是否能准确测量还需进一步研究证实;②弥散运动所设计的成像序列对微观的弥散运动很敏感,影响DTI定量分析,尤其是在活体成像中,容易产生伪影,导致DTI所重建的纤维轨迹与真实存在的传导通路存在一定偏差,这些问题在动物模型中同样存在。另外,虽然大鼠胶质瘤模型应用于实验研究已有近50年,但针对DTI研究的模型品种较少,这也在一定程度上限制了这一领域的发展。尽管如此,DTI在小动物模型中的应用仍具有巨大的潜力,它不仅可以完善我们对胶质瘤的认识,而且可以促进DTI技术的进一步发展。
[1] 吴劲松,毛颖.脑胶质瘤手术理念和研究热点[J].中国神经精神疾病杂志,2009,35(6):376-379.
[2]Yang E,Nucifora PG,Melhem ER.Diffusion MR Imaging:Basic Principles[J].Neuroimaging Clin N Am,2011,21(1):1-25.
[3]Barth RF, Kaur B.Rat brain tumor models in experimental neuro-oncology:the C6,9L,T9,RG2,F98,BT4C,RT-2 and CNS-1 gliomas[J].J Neurooncol,2009,94(3):299-312.
[4]Kim S,Pickup S,Poptani H.Diffusion Tensor Imaging in Rat Models of Invasive Brain Tumors[M].//Hayat MA.Methodsof Cancer Diagnosis,Therapy and Prognosis.8th ed.Germany:Springer,2010:131-144.
[5]Zhang J,van Zijl PC,Laterra J,et al.Unique pattens of diffusion directionality in rat brain tumors revealed by high-resolution diffusion tensor MRI[J].Magnetic Resonance in Medicine,2008,58(3):454-462.
[6]Yoshikawa T,Aoki S,Abe O,et al.Diffusion tensor imaging of the brain: effects of distortion correction with correspondence to numbers of encoding directions[J].Radiation Medicine,2008,26 (8):481-487.
[7]Dellani PR, Glaser M, Pr W.White matter fiber tracking computation based on Diffusion Tensor Imaging for clinical application[J].J Digit Imaging,2007,20(1):88-97.
[8] 陈美玲,许秀峰,程宇琪,等.弥散张量成像在神经科学领域的应用[J].国际精神病学杂志,2009,36(3):171-174.
[9]Asanuma T,Doblas S,Tesiram YA,et al.Visualization of the protective ability of a free radical trapping compound against rat C6 and F98 gliomas with diffusion tensor fiber tractography [J].J Magn Reson Imaging,2008,28(3):574-587.
[10]晏怡,唐文渊,邓朝霞,等.弥散张量成像(DTI)对肿瘤脑浸润的量化和应用[J].中国神经精神疾病杂志,2008,34(11):666-670.
[11]Deng Zhaoxia,Yan Yi,Zhong Dong,et al.Quantitative analysis of glioma cell invasion by diffusion tensor imaging[J].J Clin Neurosci,2010,17(12):1530-1536.
[12]Kim S,Pickup S,Hsu O,et al.Diffusion tensor MRI in rat models of invasive and well-demarcated brain tumors[J].NMR Biomed,2008,21(3):208-216.
[13]Lope-Piedrafita S,Garcia-Martin ML,Galons JP,et al.Longitudinal diffusion tensor imaging in a rat brain glioma model[J].NMR Biomed,2008,21(8):799-808.
[14]吴南,冯华.弥漫性脑胶质细胞瘤浸润性生长的机制与治疗[J].中华神经外科疾病研究杂志,2010,9(6):562-563.
[15]Wright AJ,Fellows G,Byrnes TJ,et al.Pattern Recognition of MRSI Data Shows Regions of Glioma Growth That Agree With DTI Markers of Brain Tumor Infiltration[J].Magnetic Resonance in Medicine,2009,62(6):1646-1651.
[16]Goebell E, Fiehler J, Ding XQ, et al.Disarrangement of Fiber Tracts and Decline of Neuronal Density Correlate in Glioma Patients-A Combined Diffusion Tensor Imaging and 1HMR Spectroscopy Study[J].AJNR Am JNeuroradio,2006,27 (7):1426-1431.
[17]Gerstner ER, Batchelor TT.Imaging and response criteria in gliomas[J].Curr Opin Oncol,2010,22(6):598-603.
[18]Ferda J,Kastner J,Mukensnabl P,et al.Diffusion tensor magnetic resonance imaging of glial brain tumors[J].Eur J Radiol,2010,74(3):428-436.
[19]Leclercq D,Delmaire C,de Champfleur NM,et al.Diffusion Tractography:Methods, Validation and Applications in Patients with Neurosurgical Lesions[J].Neuroimaging Clin N Am,2011,22(2):253-268.
[20]Asanuma T,Doblas S,Tesiram Y A,et al.Diffusion tensor imaging and fiber tractography of C6 rat glioma[J].J Magn Reson Imaging,2008,28(3):566-573.
[21]Jain R,Narang J,Sundgren PM,et al.Treatment induced necrosis versus recurrent/progressing brain tumor: going beyond the boundaries of conventional morphologic imaging[J].J Neurooncol,2010,100(1):17-29.
[22]Rogers LR,Gutierrez J,Scarpace L,et al.Morphologic magnetic resonance imaging features of therapy-induced cerebral necrosis[J].J Neurooncol,2011,101(1):25-32.
[23]Wang S,Wu EX,Qiu D,et al.Longitudinal diffusion tensor magnetic resonance imaging study of radiation-induced white matter damage in a rat model[J].Cancer Res,2009,69(3):1190-1198.
[24]Chan KC,Khong PL,Cheung MM,et al.MRI of late microstructuraland metabolic alterationsin radiation-induced brain injuries[J].J Magn Reson Imaging,2009,29(5):1013-1020.
[25]Wang S,Chen Y,Lal B,et al.Evaluation of radiation necrosis and malignant glioma in rat models using diffusion tensor MR imaging[J].J Neurooncol,2012,107(1):51-60.
[26]Jiang S,Liu MX,Han T,et al.Diffusion tensor imaging with multiple diffusion-weighted gradient directions[J].Neural Regeneration Research,2011,6(1):66-71.
R651 (
2012-02-08)
A (责任编辑:甘章平)
10.3969/j.issn.1002-0152.2012.09.015
* 复旦大学附属上海市第五人民医院神经外科(上海 200240)△复旦大学附属华山医院神经外科
