肺癌患者血浆纤维蛋白原、D-二聚体、抗凝血酶Ⅲ水平变化及意义
2012-05-23
(济南军区总医院,济南250031)
恶性肿瘤患者出现的机体高凝状态及纤溶亢进,在肿瘤的发展和转移中起着重要作用[1]。2011年1~12月,我们检测了65例肺癌患者血浆纤维蛋白原(FIB)、D-二聚体及抗凝血酶Ⅲ(AT-Ⅲ)水平变化,并探讨其意义。
1 资料与方法
1.1 临床资料 肺癌患者65例(观察组),男38例、女27例,年龄31~77岁;均经CT、病理等确诊,均未行任何抗肿瘤治疗。TNM分期(UICC,第7版)Ⅰ期5例,Ⅱ期24例,Ⅲ期28例,Ⅳ期8例。选取门诊体检健康者50例作为对照组,两组性别、年龄具有可比性。
1.2 血浆FIB、D-二聚体、AT-Ⅲ检测方法 两组均于清晨抽取空腹静脉血2 mL,加入含0.109 mol/L枸橼酸钠0.2 mL的真空采血管中,3 000 r/min离心10 min,取血浆备用。两组均在采血后2 h内采用STA Compact全自动凝血仪检测血浆中的FIB、D-二聚体、AT-Ⅲ。
1.3 统计学方法 采用SAS9.2统计软件。数据比较用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组血浆FIB、D-二聚体和AT-Ⅲ水平比较见表1。
表1 两组血浆FIB、D-二聚体和AT-Ⅲ水平比较(±s)
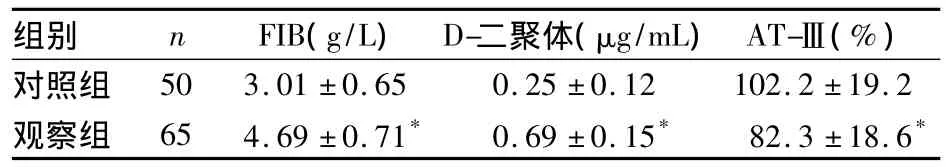
表1 两组血浆FIB、D-二聚体和AT-Ⅲ水平比较(±s)
注:与对照组比较,*P <0.01
组别 n FIB(g/L) D-二聚体(μg/mL)AT-Ⅲ(%)对照组50 3.01 ±0.65 0.25 ±0.12 102.2 ±19.2观察组 65 4.69 ±0.71* 0.69 ±0.15* 82.3 ±18.6*
2.2 血浆FIB、D-二聚体和AT-Ⅲ水平与肺癌临床病理参数的关系 FIB、D-二聚体、AT-Ⅲ水平与肺癌临床分期及淋巴转移有关(P均<0.05)。见表2。
表2 血浆FIB、D-二聚体和AT-Ⅲ水平与肺癌临床病理参数的关系(±s)
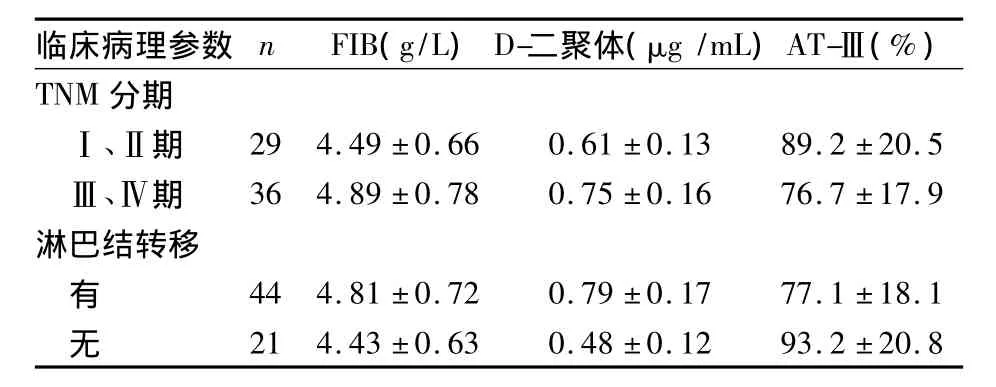
表2 血浆FIB、D-二聚体和AT-Ⅲ水平与肺癌临床病理参数的关系(±s)
临床病理参数 n FIB(g/L)D-二聚体(μg/mL)AT-Ⅲ(%)TNM 分期Ⅰ、Ⅱ期 29 4.49 ±0.66 0.61 ±0.13 89.2 ±20.5Ⅲ、Ⅳ期 36 4.89 ±0.78 0.75 ±0.16 76.7 ±17.9淋巴结转移有44 4.81 ±0.72 0.79 ±0.17 77.1 ±18.1无21 4.43 ±0.63 0.48 ±0.12 93.2 ±20.8
3 讨论
恶性肿瘤有较高的血栓发生率,机体的高凝及纤溶亢进与肿瘤局部浸润和转移有相互促进作用。肿瘤细胞可通过表达凝血蛋白、分泌炎性细胞因子及与正常细胞的直接黏附等多种途径影响凝血系统[2],而恶性肿瘤患者血液高凝状态、血管壁内皮细胞损伤等因素则是引起血栓形成的主要原因。
FIB是肝脏合成和分泌的一种糖蛋白,是血浆中含量最高的凝血因子,其水平变化和凝血功能密切相关,其水平增高说明血液处于高凝状态。而D-二聚体是交联的纤维蛋白在纤溶酶作用下裂解产生的一种终末代谢产物,其水平的增高反映继发性纤溶活性增强和凝血酶的生成增多[3],可作为体内高凝状态和纤溶亢进的特异性分子标志物。本研究结果表明,观察组患者FIB和D-二聚体水平高于健康对照组。其机制可能是肿瘤细胞破坏正常组织,导致产生大量组织因子[4~7],通过外源性途径直接激活凝血途径,导致肿瘤患者的FIB含量增高[8];纤溶系统被激活后,使D-二聚体水平增高。而且本研究结果还发现,血浆FIB、D-二聚体水平与肺癌临床分期及淋巴结转移有关,提示肺癌患者机体的凝血功能和继发性纤溶活性增强利于肿瘤的浸润和转移。其机制可能是因为FIB分解形成纤维蛋白,为肿瘤细胞的生长浸润和转移提供支架,亦可增加血小板及肿瘤细胞间的黏附、结合,从而促进肿瘤细胞的浸润、转移。
AT-Ⅲ是由肝脏、血管内皮细胞分泌的一种由425个氨基酸组成的单链糖蛋白,是依赖肝素的丝氨酸蛋白酶抑制物,是人体内重要的抗凝物质,其中凝血酶的灭活70%~80%由其实现;同时它也可抑制其他活化凝血因子、纤溶酶、胰蛋白酶和激肽释放酶的活性,在体内起着重要的抗凝调节作用[9]。本研究结果显示,观察组AT-Ⅲ活性显著低于健康对照组。其机制可能为肺癌患者凝血、纤溶系统动态平衡破坏后呈现高凝状态,机体为了平衡高凝状态,消耗了大量的AT-Ⅲ。而且其水平随临床分期的进展而降低,说明随着肿瘤的发展患者凝血、纤溶的平衡进一步被破坏;而这种高凝状态又易导致血栓的形成和癌细胞的黏附、浸润和转移。因此,监测FIB、D-二聚体和AT-Ⅲ的水平不仅是预防患者出现血栓等凝血性疾病的有效措施,还可作为肺癌发展的辅助诊断及预后判断的实验室指标。
[1]Mousa SA.Role of currentand emerging antithrombotics in thrombosis and cancer[J].Drugs Today(Barc),2006,42(5):331-350.
[2]Falanga A,Panova-Noeva M,Russo L.Procoagulantmechanisms in tumour cells[J].Best Pract Res Clin Haematol,2009,22(1):49-60.
[3]Schoenleber SJ,Kurtz DM,Talwalkar JA,et al.Prognostic role of vascular endothelial growth factor in hepatocellular carcinoma:systematic review and meta-analysis[J].Br JCancer,2009,100(9):1385-1392.
[4]Kreisl TN,Toothaker T,Karimi S,etal.Ischemic stroke in patients with primary brain tumors[J].Neurology,2008,70(24):2314-2320.
[5]Chorostowska-Wynimko J,Swiercz R,Skrzypczak-Jankun E,et al.Plasminogen activator inhibitor type-1 mutants regulate angiogenesis of human umbilical and lung vascular endothelial cells[J].Oncol Rep,2004,12(6):1155-6112.
[6]Unsal E,Atalay F,Atikcan S,et al.Prognostic significance of hemostatic parameters in patients with lung cancer[J].Respir Med,2004,98(2):93-98.
[7]Weitz IC,Israel VK,Waisman JR,et al.Chemotherapy-induced activation of hemostasis:effect of a low molecular weight heparin(dalteparin sodium)on plasma markers of hemostatic activation[J].Thromb Haemost,2002,88(2):213-220.
[8]CestariDM,Weine DM,Panageas KS,etal.Stroke in patientswith cancer:incidence and etiology[J].Neurology,2004,62(11):2025-2030.
[9]彭黎明,邓承祺.现代血检与止血的实验室检测及其应用[M].北京:人民卫生出版社,2004:25.
