妊娠期高血压疾病患者胎盘组织中ApoE、LPL ser447stop基因多态性检测及意义
2012-05-23
(南昌大学第二附属医院,南昌330006)
妊娠期高血压疾病(HDP)是妊娠期特有的疾病,为孕产妇及围生儿死亡的重要死因[1],其病因及发病机制尚未完全明了。近期研究表明,HDP患者存在一定程度脂质代谢变化,由此推断该病的发生、发展可能与血脂代谢异常有关[2]。载脂蛋白酶E(ApoE)及脂蛋白脂酶(LPL)是脂代谢的关键因子,若干环境因素是影响ApoE及LPL突变致病的重要因素,妇女妊娠则是最常见的环境因素[3]。为探讨ApoE基因及LPL基因第9外显子(ser447stop)多态性是否与 HDP有关,本研究采用HDP患者胎盘组织与正常产妇胎盘组织作为研究对象,通过对组织中 ApoE基因及 LPL基因ser447stop多态性分布情况来探讨其与HDP的关系。
1 资料与方法
1.1 临床资料 随机选取江西省妇幼保健院、南昌大学第一附属医院及赣南医学院附属医院2007年9月~2010年9月汉族妊娠期高血压患者36例作为A组,子痫前期94例作B组。产后追踪12周,均排除原发性高血压、肾病、糖尿病。同期选择正常妊娠妇女130例作为C组。研究对象均签署知情同意书,并经医院道德伦理委员会通过。各组年龄、孕前体质量、身高、孕产次、孕周情况比较,差异无统计学意义(P>0.05)。术中取产妇的胎儿面胎盘组织约5 cm×3 cm×3 cm(避开钙化、坏死及血管区),独立装于样本袋中,保存于-20℃冰箱内。
1.2 方法
1.2.1 DNA的提取与检测 采用经典的酚—氯仿方法提取,经琼脂糖凝胶电泳法检测。
1.2.2 ApoE基因多态性检测 采用等位基因特异性多重聚合酶链反应(multi-ARMS PCR)技术。①目的片段的扩增:引物设计根据Gerard等[4]报道的引物序列。上游引物P1为5'-CGCGGACATGGAGGACGTTT-3',P2 为 5'-CGCGGACATGGAGGACGTTC-3',P3 为 5'-ATGCCGATGACCTGCAGAATT-3',P4 为 5'-ATGCCGATGACCTGCAGAATC-3',以及公共下游引物P5为5'-GTTCAGTGATTGTCGCTGGGCA-3'。按照文献[5]方法,为了监控反应体系的有效性,以低密度脂蛋白受体外显子13为内参照系统,引物序列 P6为 5'-AACAACTGACCCCGCTGGCG-3',P7 为 5'-ATGGCGCTGAGGCCGCGCTC-3'。PCR反应体系:分为 A、B两管。其中A管为50 μM/L 的 P1、P3、P6、P7 各0.4 μL,B 管为 50 μM/L的 P2、P4、P6、P7 各 0.4 μL;两管均加入 50 μM/L的 P5 0.8 μL,dNTP(0.2 mmol/L)0.5 μL,镁离子(1.5 mmol/L)1.5 μL,TaqDNA 聚合酶(2.5 U/μL)1 μL,10×Buffer 2.5 μL,DNA 模板6 μL,加去离子水补足至25μL。扩增条件:95℃预变性5 min,继而94℃变性30 s,58℃退火30 s,72℃复性1 min,共35次循环后72℃延伸7 min,于4℃保存。取扩增产物放入琼脂糖凝胶电泳,置于紫外透射仪下观察确定ApoE基因型。②ApoE基因型判断:ApoE的三种异构体(ApoE2、ApoE3、ApoE4)的氨基酸顺序均已测定,它们的区别在于第112位和第158位上半胱氨酸(Cys)和精氨酸(Arg)的互换(即碱基T与C的互换)。ApoE2/2在这两个位点上均为Cys残基;ApoE3/3在112位点上是Cys残基,在158位点上是Arg残基;ApoE4/4在两个位点上均为Arg残基。由此三种异构体而形成六种基因表型分别是ApoE2/2、ApoE3/3、ApoE4/4、ApoE3/2、ApoE4/3 和ApoE4/2。P1和P2分别检测ApoE 112位的 Cys和Arg,P3和P4分别检测 ApoE 158位的 Cys和 Arg。A管中P1与P5扩增出588 bp片段,P3与P5扩增出451 bp片段。B管中P2与P5扩增出588 bp片段,P4与P5扩增出451 bp片段。
1.2.3 LPL ser447stop基因多态性检测 采用聚合酶链反应—限制性内切酶片段长度多态法(PCRRFLP)。①目的片段的扩增:引物根据引物设计的一般原则设计。上游引物为 5'-TATTCACATCCATTTTCTTC-3',下游引物为 5'-GTCAGCTTTAGCCCAGAATG-3',扩增产物长度为155 bp。扩增体系:10 ×buffer 2.5 μL,MgCl2(25 mM)1.5 μL,dNTP(Mix,10 mM)0.5 μL,hot-tag 酶(2.5 U/μL)1 μL,引物(上下游各 50 μM)2 μL,模板 DNA(10 ng/μL)6 μL,ddH2O 9.5 μL。扩增条件:94 ℃预变性11 min,继而94℃变性45 s,57℃退火45 s,71℃复性1min,共35次循环后72℃延伸10min,于4℃保存。取扩增产物放入琼脂糖凝胶电泳,置于紫外透射仪下观察拍照。②扩增片段的限制性酶切及检测:取PCR扩增产物17μL,加限制性内切酶MnlⅠ0.2μL、buffer G 2μL及 ddH2O 5μL;37℃过夜消化后于琼脂糖凝胶上进行电泳,同时电泳槽孔中加入高脂血症患者的LPL基因突变(ser447stop杂合子)阳性标本为对照,置于紫外透射仪下观察拍照。③酶切产物结果分析:LPL的ser447stop突变是位于第9外显子的1 595核苷酸处C和G转换的结果,这样丝氨酸447密码TCA过早的转化为终止密码子TGA。MnlⅠ内切酶能把有ser447stop突变的PCR扩增产物切开,即把155 bp片段切成117 bp和38 bp。而无突变的PCR扩增产物不能被MnlⅠ内切酶切开,故保持155 bp。按酶切结果将其分为无突变型(CC)、突变杂合子型(CG)及突变纯合子型(GG)。通过将酶切结果与高脂血症患者LPL ser447stop杂合子的阳性标本进行对照来了解其是否存在突变。
1.3 统计学方法 计数资料用频数表示。ApoE等位基因频数计算根据以下公式:ε2=2×E2/2+E2/3+E2/4,ε3=2 × E3/3+E2/3+E3/4,ε4=2 × E4/4+E3/4+E2/4;LPL等位基因频数计算根据以下公式:C=2×CC+CG,G=2×GG+CG;计数资料组间比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 ApoE基因型检测结果 共检测到5种ApoE基因表型,分别是 ApoE2/3、E2/4、E3/3、E3/4 及E4/4(见图 1、2)。A 组 ApoE2/3、E2/4、E3/3、E3/4及E4/4基因表型频率分别为25.00%(9/36)、0、50.00%(18/36)、22.22%(8/36)、0,B 组分别为19.15%(18/94)、0、56.38%(53/94)、24.47%(23/94)、1.06%(1/94),C 组分别为 14.61%(18/130)、3.08%(4/130)、76.92%(100/130)、5.38%(7/130)、0.77%(1/130)。A、B 组E3/3、E3/4 基因表型与C组比较,P均<0.01。A组ApoE等位基因ε2、ε3、ε4 频率分别为 12.50%(9/70)、73.61%(53/70)、11.11%(8/70),B 组分别为 9.57%(18/190)、78.19(%(147/190)、13.30%(25/190),C 组分别为 8.46%(22/260)、86.54%(225/260)、5.00%(13/260)。A、B 组 ApoE 等位基因 ε3、ε4 与C 组比较,P 均 <0.05。
2.2 LPL ser447stop基因型检测结果 所有胎盘组织中发生LPL ser447stop突变的只有3例,其中B组2例,C组1例,均为突变杂合子型(CG)。各组间比较,P均>0.05。详见图3。
3 讨论
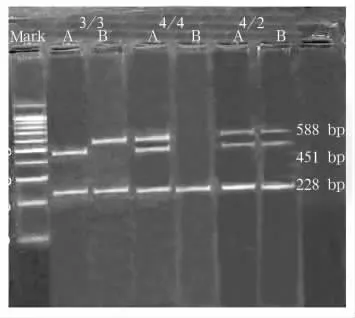
图1 ApoE3/3、E4/4、E4/2 基因型

图2 ApoE3/2、E4/3基因型

图3 LPL第9外显子PCR产物酶切结果
3.1 脂代谢与正常妊娠的关系 妊娠期体内血脂代谢非常活跃,这对胎儿的生长发育是有利的[5]。由于妊娠期血脂与高密度脂蛋白胆固醇(HDL-C)同时升高,HDL有助于乳糜微粒(CM)和极低密度脂蛋白胆固醇(VLDL-C)的合成,阻止自由胆固醇积累在动脉壁,而且机体内皮依赖性血管舒张反应也增强,故妊娠期高脂血症不能引起心血管疾病的发生[6]。
3.2 脂代谢与HDP HDP患者在高脂血症基础上进一步发生改变,TG和游离脂肪酸水平异常升高及耗氧量增加,使脂质过氧化物(LOP)增多并产生自由基损伤血管内皮细胞,使血管壁内皮细胞通透性增加,刺激单核细胞进入血管壁,最后易使LDL-C在血管壁和组织中沉积,形成粥样斑块,使小动脉腔狭小,外周阻力增加,血压升高,导致血管痉挛收缩等一系列病理生理变化。同时,氧化的LDL抑制前列腺素合成酶,使前列环素(PGI2)减少,激活血栓素合成酶,使血栓素A2生成及血小板凝集,加重血压升高、血小板凝集而发生弥散性血管内凝血(DIC)、肾及胎盘血管收缩、脑血管收缩造成子痫等。HDP是多因素共同作用的结果,脂代谢异常可能是其中的一个重要环节[7]。
3.3 ApoE的生物学特性以及其多态性与HDP的关系 ApoE是脂蛋白与受体结合的配体,通过ApoE,胆固醇可在体内重新分布。ApoE的多态性影响血脂的代谢和利用[8]。它有3个主要等位基因(即 ε2、ε3、ε4),编码的 3 种异构体(即 ApoE2、E3、E4),形成6 种表型(即 ApoE2/2、E2/3、E2/4、E3/3、E3/4、E4/4)。3种异构体与脂蛋白受体亲和力不同,ApoE2与受体亲和力低下,而ApoE4却很高;ApoE4表型具有升胆固醇的作用,而ApoE2表型则相反[9]。Belo等[10]发现,ApoE 基因多态现象并不是先兆子痫发病的危险因子,仅与妊娠晚期孕妇脂质水平有关。国外也有文献报道,ApoE等位基因ε2和ε4频率在非洲及欧洲地区先兆子痫患者中过度表达,但同时也有相反的报道[11]。
本研究共检测到 ApoE2/3、E2/4、E3/3、E3/4 和E4/4共5种基因表型。其中ApoE3/4基因表型在A、B组的频率分别是22.22%和24.47%,两组均较C组(5.38%)高(P 均 <0.01)。在 A、B 组中,ε3 等位基因型的频率分别是73.61%和78.19%,两组均较C组(86.54%)低(P 均 <0.05);而 ε4 等位基因型的频率分别是11.11%和13.3%,两组均较C组(5%)高(P均<0.05)。分析原因可能与ApoE的不同异构体与受体的亲和力不同有关。由于亲和力不同而导致ApoE浓度的差异,从而影响脂蛋白与受体的结合,使胆固醇在体内的重新分布异常,减缓了外周组织将LDL-C逆转运到肝脏的能力,使LDL-C在血管壁和组织中沉积,进一步导致妊娠期高血压的发生。通过本研究可推断出ApoE3/4基因表型可能是HDP的危险因素;ε4等位基因可能是HDP的遗传易患因子,而ε3等位基因可能具有保护作用。
3.4 LPL基因的生物学特性及其ser447stop突变与HDP的关系 LPL水解血液中的甘油三酯,生成的甘油和脂肪酸可供组织氧化分解并提供能量。LPL的缺陷或活性降低均可导致血浆TG及VLDL的升高。近年的研究发现,LPL基因突变可能与糖尿病、肥胖、冠心病、高血压、阿尔茨海默病、围产期疾病等相关[12]。LPL的基因多态性对HDP是否有关联也众说纷芸,其中LPL ser447stop基因突变对血压影响的文献较多见。Salah等[13]研究发现,LPL ser447stop基因变异的携带者发展为高血压的风险很高。Chen等[14]对台北地区HDP的患者及其父母的研究发现,LPL ser447stop基因突变可能是一种保护因子。孙瑜等[15]研究LPL的ser447stop变异与HDP的影响发现,其对HDP无影响。
本研究共检测到3例突变,其中B组2例,C组1例,均为杂合子。根据基因多态性的定义,可以认为我们所研究的这一人群可能无LPL ser447stop多态性。故认为LPL ser447stop基因多态性可能与HDP的发生无关。结合国内外文献,分析原因推测可能因为人种差异,因此LPL ser447stop基因多态性对HDP关联的结果,与国外的报道不同。
综上所述,HDP与多重因素有关,而脂代谢异常只是其中一种因素。我们的研究发现,ApoE的不同表型对HDP的发病率不同,而LPL ser447stop基因多态性与HDP可能无关联,但因样本量的局限,仍需进行多角度、多层面的试验方可证实。
[1]乐杰.妇产科学[M].7版.北京:人民卫生出版社,2008:92-98.
[2]郭海香,高眉扬.脂质代谢异常在妊娠高血压疾病的研究进展[J].中国妇幼健康研究,2006,17(3):106-108.
[3]Ray JG,Diamond P,Singh G,etal.Brief overview ofmatemal triglycerides as a risk factor for pre-eclampsia[J].BJOG,2006,113(4):379-386.
[4]Gerard GD,Ann S,Terho L,et al.Rapid identification of Apolipoprotein E genotypes bymultiplex amplification refractorymutation system PCR and capilliary gel electrophoresis[J].Clin Chem,1999,45(2):143-145.
[5]孙瑜,白文佩,周世梅,等.脂代谢异常在妊娠高血压综合征发病中的作用[J].中国围产医学杂志,2001,4(2):70-72.
[6]张春妮,李丽,刘小传,等.正常孕妇血清脂蛋白(a)含量调查及其临床意义[J].临床检验杂志,2004,22(2):133-134.
[7]宿仕萍,乔福元.脂代谢异常在子痫前期、子痫发病中的作用[J].中国实用妇科与产科杂志,2006,22(2):135-136.
[8]田英.研究载脂蛋白E基因多态性与血清高密度脂蛋白subelasses在妊娠高血压疾病中的表达[J].中华医学遗传学杂志,2005,22(1):96-98.
[9]Bednarska-Makaruk M,Rodo M.Polymorphisms of apolipoprotein E and angiotensin-converting enzyme genes and carotid atherosclercsis in heavy drinkers[J].Alcohol Alcohol,2005,40(4):274-282
[10]Belo L,Gaffney D,Rebelo I,et al.Apolipoprotein E and cholesteryl ester transfer proteinpolymorphisms in normal and pre-eclamptic prenancies[J].Eur JObstet Gynecol Reprod Biol,2004,112(1):9-15.
[11]Chikosi AB,Moodley J,Pegoraro RJ,etal.Apolipoprotein E polymorphism in south african zulu woman with preeclampsia[J].Hypertens Pregnancy,2000,19(3):309-314.
[12]穆云翔.脂蛋白脂肪酶基因突变研究进展[J].中华老年心脑血管病杂志,2002,10(4):358-362.
[13]Salah A,Khan M,Esmail N,et al.Genetic polymorphism of S447X lipoprotein lipase(LPL)and the susceptibility to hypertension[J].Crit Care,2009,24(3):4-8.
[14]Chen P,Jou YS,Fann L,et al.Lipoprotein lipase gene is linked and associated with hypertension in Taiwan young-onset hypertension genetic study[J].Biomed Sci,2005,12(4):651-658.
[15]孙瑜,白文佩,周世梅,等.妊高征患者脂蛋白酯酶基因变异(ser447-Thr)的研究[J].中国妇产科临床杂志,2003,4(2):87-89.
