2-芳基苯并噁唑的合成和生物活性
2012-05-08冯志君凌烈锋金雅嫔
冯志君,凌烈锋,金雅嫔
(皖南医学院 1.化学教研室;2.生物化学教研室,安徽 芜湖 241002)
噁唑类化合物以其良好的杀菌及生物活性而广泛应用于医药[1]、农药、生物化学等领域[2-3],是活性天然产物及药物中重要的结构单元之一,因此噁唑及苯并噁唑类化合物的合成及其生物活性的研究是杂环化合物的一个重要研究方向。在已知的苯并噁唑衍生物的合成方法中[4-5],主要都经历了氧化环化以成噁唑环;结合有机高价碘化合物优异的氧化性、温和的反应条件以及环境友好性[6-8],本论文采用了醋酸碘苯(DIB)氧化苯酚亚胺,分子内环化合成了2-芳基苯并噁唑衍生物,通过IR,1H NMR,13C NMR和HRMS(EI)对其结构进行了表征,并对其中部分化合物进行了抑菌活性的测试,以期能发现活性好的化合物和为药物筛选提供先导化合物。合成路线如下(Scheme 1)。
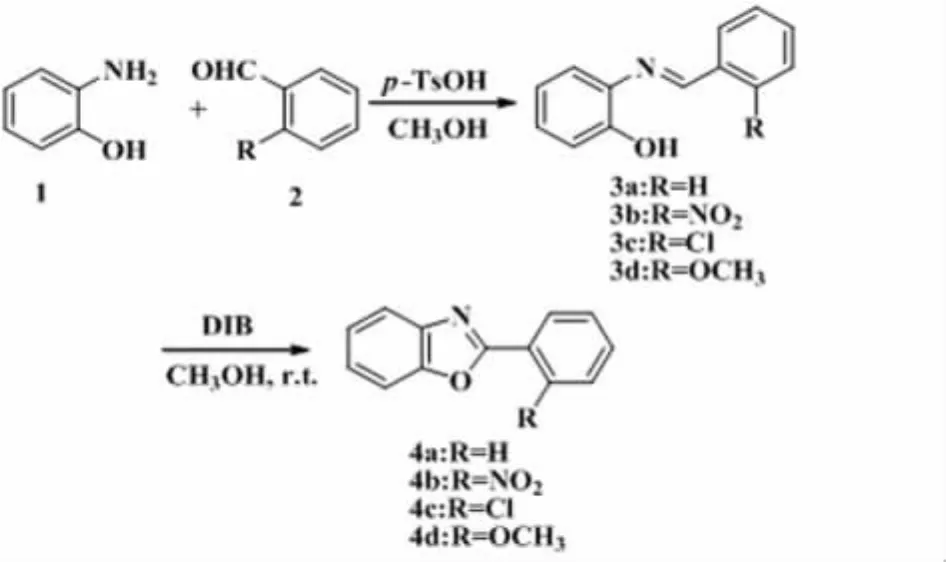
Scheme 1
1 实验部分
1.1 试剂与仪器 IR数据由Shimadzu IRPrestige-21型红外光谱测定仪(KBr压片)测定;1H NMR和13C NMR数据由Bruker Avance 300 MHZ(TMS为内标,CDCl3为溶剂)测定;HR-MS用GCT-ms质谱仪测定。所用试剂均为国产分析纯或化学纯试剂。
1.2 化合物3a-d的合成 将0.109 g(1 mmol)邻氨基酚1、1 mmol取代芳醛2和少量对甲苯磺酸加到10 ml无水甲醇中,溶解后在室温搅拌8 h,析出固体。过滤,固体用少量甲醇洗涤,TLC检测(乙酸乙酯∶石油醚为1∶6,v/v)为一纯点,干燥,得到目标化合物3a-d。
3a:白色粉末;产率 76%;IR(KBr,cm-1)ν:3600(ArO-H),3051(Ar-H),1579(C=N),1230(CO);1H NMR(CDCl3,300 MHz)δ:8.93(s,1H,-N=CH),7.85~6.88(m,9H,Ar-H),5.30(s,1H,Ar-OH);13C NMR(CDCl3,300 MHz) δ:160,151,141,136,131,129,123,120,116;HRMS(EI)m/z197.08(M+)。
3b:黄色粉末;产率 87%;IR(KBr,cm-1)ν:3611(ArO-H),3057(Ar-H),1570(C=N),1231(CO);1H NMR(CDCl3,300 MHz)δ:9.10(s,1H,-N=CH),8.05~6.97(m,8H,Ar-H),5.32(s,1H,Ar-OH);13C NMR(CDCl3,300 MHz) δ:160,151,148,141,135,132,130,128,124,123,120,115;HRMS(EI)m/z242.07(M+)。
3c:黄色粉末;产率 81%;IR(KBr,cm-1)ν:3595(ArO-H),3050(Ar-H),1574(C=N),1230(CO);1H NMR(CDCl3,300 MHz)δ:8.89(s,1H,-N=CH),7.86~6.97(m,8H,Ar-H),5.39(s,1H,Ar-OH);13C NMR(CDCl3,300 MHz) δ:160,151,141,134,132,130,129,127,123,120,115;HRMS(EI)m/z231.05(M+)。
3d:灰白粉末;产率 66%;IR(KBr,cm-1)ν:3611(ArO-H),3057(Ar-H),1570(C=N),1231(CO);1H NMR(CDCl3,300 MHz)δ:9.10(s,1H,-N=CH),8.05~6.97(m,8H,Ar-H),5.32(s,1H,Ar-OH),3.65(s,3H,-CH3);13C NMR(CDCl3,300 MHz)δ:160,151,148,141,135,132,130,128,124,123,120,115,56;HRMS(EI)m/z227.10(M+)。
1.3 化合物4a-d的合成 将1 mmol化合物3和1.1 mmol PhI(OAc)2加到10 ml无水甲醇中,在室温下搅拌,经TLC检测(乙酸乙酯∶石油醚为1∶9,v/v)反应完全,真空除溶剂,固相用碳酸钠水溶液中和,然后用CH2Cl2(15 ml×3)萃取,再经柱色谱纯化得到目标化合物4a-d。
4a:白色粉末;产率 80%;IR(KBr,cm-1)ν:1615,1573,1457,1242,925;1H NMR(CDCl3,300 MHz)δ:8.10(d,2H,Ar-H),7.85(m,2H,Ar-H),7.55-7.30(m,5H,Ar-H);13C NMR(CDCl3,300 MHz)δ:162,150,141,131,129,128,125,124,120,110;HRMS(EI)m/z195.02(M+)。
4b:黄色粉末;产率 91%;IR(KBr,cm-1)ν:1621,1569,1455,1241,910;1H NMR(CDCl3,300 MHz)δ:8.15(m,2H,Ar-H),8.01(m,1H,Ar-H),7.80-7.56(m,3H,Ar-H),7.43(d,2H,Ar-H);13C NMR(CDCl3,300 MHz) δ:160,151,148,141,135,132,130,128,124,123,120,115;HRMS(EI)m/z240.05(M+)。
4c:白色粉末;产率 86%;IR(KBr,cm-1)ν:1620,1570,1460,1240,920;1H NMR(CDCl3,300 MHz)δ:7.91(m,3H,Ar-H),7.65-7.30(m,5H,Ar-H);13C NMR(CDCl3,300 MHz) δ:163,150,141,137,130,129,127,124,120,110;HRMS(EI)m/z229.04(M+)。
4d:白色粉末;产率 72%;IR(KBr,cm-1)ν:1611,1577,1453,1238,927;1H NMR(CDCl3,300 MHz)δ:7.80-7.65(m,3H,Ar-H),7.45-7.30(m,3H,Ar-H),7.10(m,2H,Ar-H),3.77(s,3H,-CH3);13C NMR(CDCl3,300 MHz) δ:163,158,150,141,138,130,125,124,120,110,56;HRMS(EI)m/z225.09(M+)。
1.4 抑菌活性测试[9]采用打孔法,用沙氏固体培养基(蛋白胨1%、葡萄糖4%、琼脂2%)。将白念珠菌(ATCC10231)种于琼脂平板,37℃,16~18 h后挑选平板上的纯培养菌落,悬于3 ml生理盐水,调整浊度(0.5麦式单位);取20μl菌液并均匀涂布于培养基表面,待平板水分被琼脂完全吸收后,在琼脂上打孔加药(一种药剂浓度设3个重复,一个只加DMSO的对照);然后孵育20 h后取出,用十字交叉法测量抑菌圈直径。观察和测试结果如图1和表1所示。
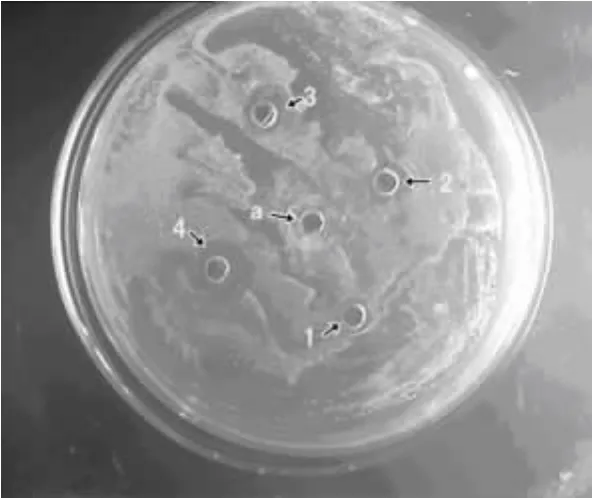
图1 白念珠菌在化合物4b不同药剂浓度下20 h后的观察结果Fig1 Results of antifungal activity at the concentration of 4b

表1 化合物4b抑菌活性测试结果(抑菌圈直径,单位mm)Tab1 Results of antifungal activity of 4b(diameter of inhibition zone,mm)
2 结果
用有机高价碘化合物醋酸碘苯(DIB)氧化苯酚亚胺分子内环化,得到了目标化合物4a-d,产物经过1H NMR,13C NMR,HRMS(EI)和 IR 等表征;拓展了用有机高价碘试剂氧化环化形成2-芳基苯并噁唑衍生物的合成方法。生物活性测试表明:化合物4b对白念珠菌有良好的抑菌活性。
3 讨论
在已有的氧化环化合成取代苯并噁唑衍生物的方法中,用有机高价碘试剂DIB作氧化剂反应条件温和、效率高、操作简单、环境友好;该合成方法具有普适性,可适用于不同取代基的芳醛,有吸电子基的芳醛作用后得到的目标产物产率高些。化合物4b对其他菌种的抑菌活性的测试,以及苯并噁唑2-位芳环上取代基对抑菌活性影响的研究工作正在进行中。这些为后续活性化合物的设计和合成工作奠定了基础。
[1]GRIMMET M.R.Comprehensive Organic Chemistry[M].Oxford:Pergamon Press,1979:357.
[2]OSDENE T S.Medical Chemistry[M].New York:wiley interscience,1970:662.
[3]RAJENDRA S,VARMA,SUDDA CHAUHAN.Synthesis of Substituted 2-Phenylbenzoxazoles as CNSActive Agents[J].Indian Journal of Chemistry,1985,24B(3):280-285.
[4]RAJENDER S.VARMA,OM PRAKASH.Hypervalent Iodine Oxidation of Phenolic Schiff's Bases[J].Tetrahedron Letter,1997,38(15):2621-2622.
[5]黄筱玲,刘欣,曲凡歧.植物病毒病化学防治剂的探寻Ⅳ.2-芳基-5-取代苯并噁唑衍生物的合成方法改进[J].武汉大学学报:自然科学版,1998,44(2):141-142.
[6]ZHDANKIN VV,STANG PJ.Recent Developments in the Chemistry of Polyvalent Iodine Compounds[J].Chem.Rev,2002,102:2523-2584.
[7]HUAN LIANG,MARCO A.Ciufolini.Synthetic aspects of the oxidative amidation of phenols[J].Tetrahedron,2010,66:5884-5892.
[8]ROBERT M.MORIARTY.Organohypervalent Iodine:Development,Applications,and Future Directions[J].J.Org.Chem,2005,70:2893-2903.
[9]刘刚,刘春萍,纪春暖,等.4-硫醚基喹唑啉类化合物的合成及抑菌活性研究[J].有机化学,2008,28(3):525-530.
