ApoM在不同肝细胞中的表达及其与临床病理因素的关系
2012-05-08黄丽珠陈昌杰杨清玲丁淑琴
黄丽珠,章 尧,陈昌杰,杨清玲,孙 淼,丁淑琴
(1.蚌埠医学院 临床检验诊断实验中心,安徽 蚌埠 233000;2.皖南医学院 生物化学教研室,安徽 芜湖 241002;3.蚌埠医学院 生化与分子生物学教研室,安徽 蚌埠233000;4.蚌埠医学院第一附属医院 检验科,安徽 蚌埠 233000)
载脂蛋白M(apolipoprotein M,ApoM)由Xu和Dahlbäck B于1999年首次发现并进行了克隆[1]。该蛋白分离于乳糜微粒,属于疏水性分子结合蛋白家族成员,在血浆中主要存在于高密度脂蛋白(HDL)。ApoM表达具有较高的组织特异性。在成人,ApoM主要表达于肝细胞和肾小管上皮细胞[1-2],可通过促进preβ-HDL生成和胆固醇逆转运reverse cholesterol transport(RCT),参与炎症反应及抗氧化作用。肝细胞癌(hepatocellular carcinoma,HCC)常继发于慢性肝炎或肝硬化。大部分肝炎、肝硬化患者肝功能均明显受损,因而对脂质和脂蛋白在人体内的代谢产生较大影响。目前有学者认为[3-5],肝脏发生癌变时,肝细胞受损,肝实质细胞减少,进而导致肝功能低下,脂蛋白合成受阻,导致血清中 HDL-c、ApoA-Ⅰ、ApoA-Ⅱ、Lpa、ApoB 等脂蛋白含量降低,故此,检测ApoA-Ⅰ及Lp(a)等可做为评估肝功能受损的辅助指标。Ooi等[3]报道,HDL在肝癌患者血清中表达明显低于正常对照人群。ApoM作为HDL的重要组成成分,其分子水平改变可间接反映出HDL变化,故为诠释HDL的复杂功能提供了新的视角。最新研究提示Apo-A4和Apo-A1可作为诊断肝细胞癌的独立因子[4],ApoE也可以作为肝癌组织标记物[5]。为探讨ApoM是否在肝癌发生、发展中发挥着特定作用,我们对ApoM在不同细胞类型肝组织及不同分化阶段肝癌组织中表达情况进行了研究,并就其相关性予以分析。
1 资料与方法
1.1 标本收集 79例肝细胞癌及癌旁组织石蜡标本用于免疫组化检测。标本来自于2007年4月~2010年12月蚌埠医学院第一附属医院肝胆外科肝细胞癌患者手术切除的肝细胞癌组织。患者术前均未接受过放化疗,年龄33~70岁,平均(50.4±10.7)岁,男47例,女32例。取癌缘外3cm处肉眼观察无异常,且经病理组织学检查未发现癌细胞的肝组织为癌旁组织。其中肝细胞癌标本79例,肝硬化标本32例,正常组织标本7例。79例肝癌标本中,高分化43例,中分化27例,低分化9例。肿瘤直径≥5 cm者36例,肿瘤直径<5 cm者43例;肿瘤位于左半肝者45例,位于右半肝者34例;发生肝内转移者33例,无转移者46例。正常人肝组织蜡块7例由解放军第一二三医院病理科提供。
1.2 方法 免疫组化测ApoM在肝癌组织中的表达
1.2.1 主要试剂 SP-免疫组化试剂盒(北京中杉金桥公司);鼠抗人ApoM抗体(Santa Cruz生物技术公司);辣根过氧化物酶标记的羊抗兔IgG、兔抗鼠IgG、β-actin抗体(北京中杉金桥公司)。
1.2.2 实验方法 所有切除标本均用10%甲醛固定,石蜡包埋,制成4μm厚切片,经脱蜡、脱苯、水化处理后,采用链霉素抗生物素蛋白-过氧化物酶法(SP法)检测ApoM蛋白表达情况。先经高温高压修复抗原,3%H2O2阻断内源性过氧化物酶活性,然后使用ApoM一抗(1∶250)4℃湿盒内反应过夜,次日依次滴加生物素标记的二抗和链霉素抗生物素蛋白-过氧化物酶,DAB显色,苏木素复染细胞核;以PBS代替一抗作为阴性对照。
1.2.3 判定标准 每张切片在显微镜(×400)下随机选取10个视野观测。每个视野计数100个肿瘤细胞,计数其中阳性细胞数,取平均值;染色强度分级:阴性为0;淡黄色为1;棕黄色为2;深棕色为3。30 d lethality阳性肿瘤细胞数分级:<5%为0;5%~25%为1;26%~50%为2;>50%为3。结果评定:按染色强度与阳性肿瘤细胞数乘积。0为阴性;1为弱阳性;2~4为阳性;6~9为强阳性。
1.3 统计学处理 ApoM蛋白在不同肝组织中分化程度和Edmondson分级间ApoM蛋白阳性表达率及ApoM蛋白表达强度差异采用SPSS 17.0软件包统计,Kruskal-Wallis秩和检验。P<0.05表示差异有统计学意义。
2 结果
免疫组化方法检测AopM在79例肝细胞癌组织和癌旁组织中的表达情况,结果显示其表达阳性信号定位于胞浆。AopM在肝硬化组织中,17例染色呈深棕色(53.13%,17/32),在79例肝癌组织中有22例染色呈深棕色(27.84%,22/79),高于相应癌旁组织的20例(25.32%,20/79)(P<0.05)见表1。AopM在癌组织分别与与癌旁组织、肝硬化组织及正常组织表达有差异,但在肝硬化组织与正常组织中表达,差异无统计学意义,见表1、图1。AopM在癌组织中表达与肿瘤组织的分化有关,中高分化表达高于低分化(P<0.05),结果见表2、图2;可能与性别有关,差异有统计学意义(P<0.05)。ApoM表达与年龄、肿瘤大小、肿瘤发生部位及淋巴转移等差异无统计学意义,结果见表2。
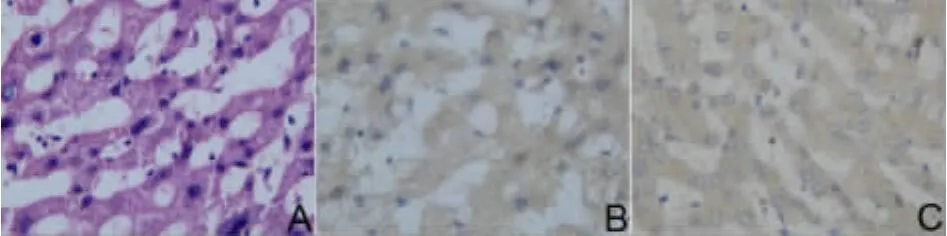
图1 肝硬化肝组织和正常肝组织中ApoM蛋白表达(HE,×400)Fig1 ApoM expression in the cirrhotic tissues and normal ones(HE,×400)
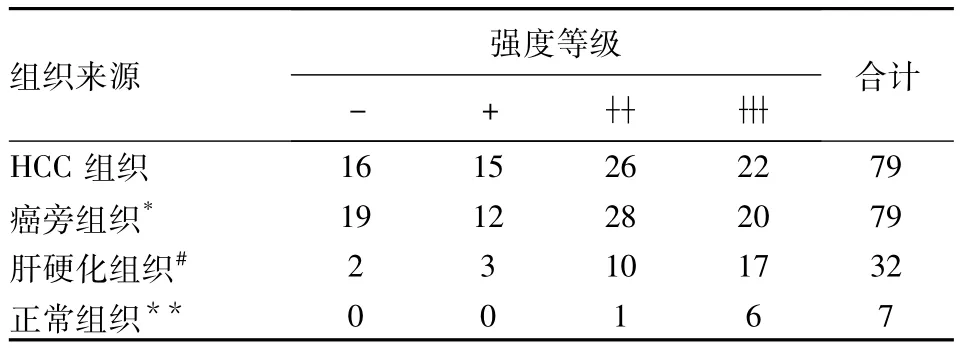
表1 ApoM蛋白在不同肝组织中的表达强度Tab1 The intensity of ApoM expressed in diverse hepatic tissues
3 讨论
肿瘤发生是一个复杂的多基因、多步骤的过程,而肝癌的发生、发展及癌细胞的生长代谢受到诸多复杂因素调节。本研究收集肝癌患者肝细胞癌组织、癌旁组织、肝硬化患者和正常人肝组织,检测ApoM蛋白水平在不同组织中表达有无差异。免疫组化结果显示,ApoM在肝癌患者癌组织中较高表达,肝硬化组织中表达最强,癌旁组织中表达较低,虽然在正常组织中表达较高,但是参考文献及以往研究结果我们认为ApoM在正常肝细胞中是弱表达。随着分化程度的降低,ApoM表达呈下降趋势,这一结果提示ApoM表达与肝癌分化程度相关。结果提示ApoM表达与性别相关,但尚需扩大样本量以确定在不同性别肝癌患者中其是否与肿瘤相关。而ApoM在肝硬化组织中表达高于正常组和肝癌组,Gu等[6]研究提示HBV感染后血浆ApoM反应性升高,可抑制HBV病毒复制。推测在肝硬化及肝癌发生过程中,ApoM参与炎症反应。慢性肝病期间,宿主免疫应答异常等改变可能会加强肝脏细胞ApoM合成,从而导致ApoM表达水平升高。ApoM在肝癌组织中表达高于癌旁组织与本课题组前期研究一致[7-8]。
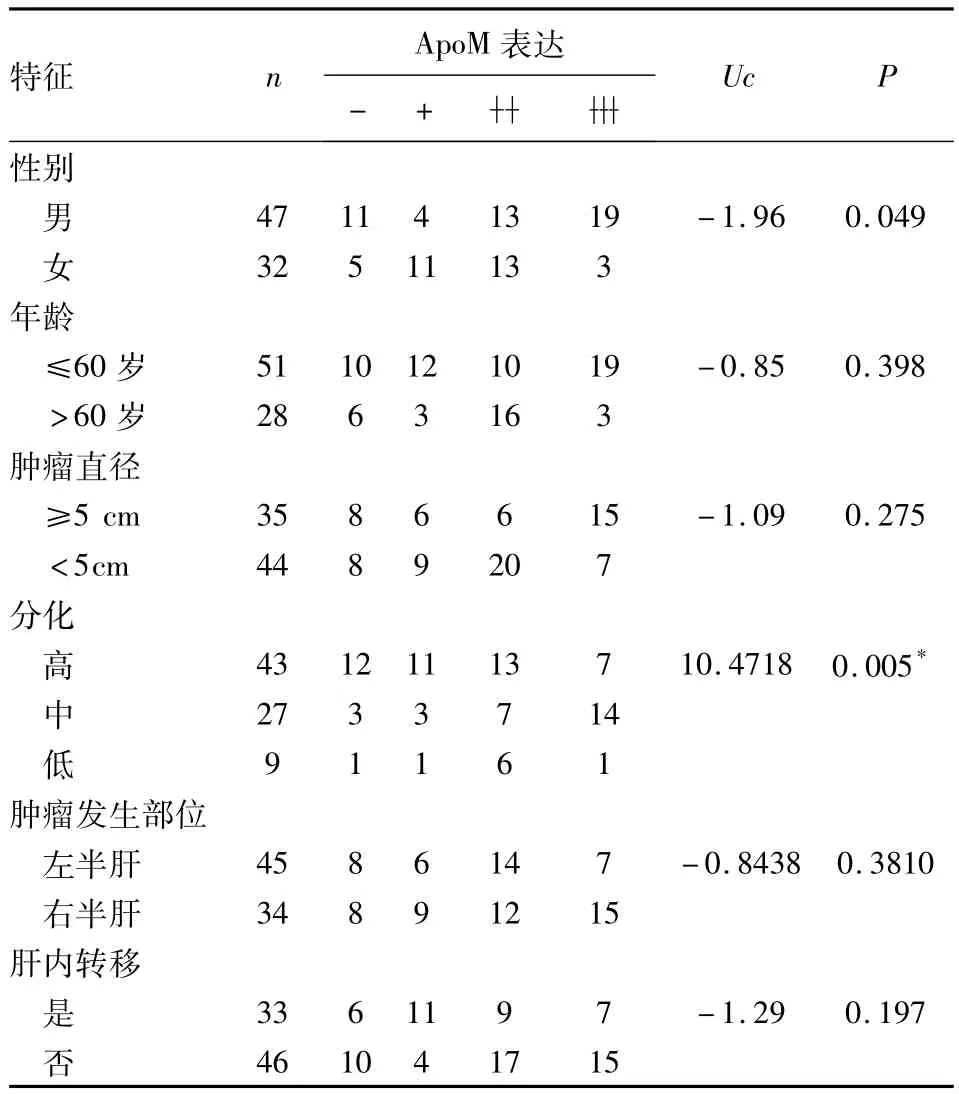
表2 免疫组化检测肝癌中ApoM的表达与临床病理学特征的关系Tab2 ApoM expression in the liver cancer and clinicopathological features by immunohistochemical test
肝癌发生、发展不仅与诸多因素有关,同时也受到多种因子复杂调控。顺式作用元件与反式作用因子在核酸水平控制着活细胞生命过程,而转录因子在肝癌发生、发展过程中发挥重要作用。ApoM基因的表达主要受转录因子调控,LRH-1、HNF-1α、Foxa2(HNF-3β)、HNF-4α为主要调控ApoM表达的转录因子,并同时参与调控肝细胞的分化[9-13]。这些转录因子能与肝细胞特异基因的启动子结合发挥作用,相互之间协同调控肝细胞特异性基因表达。其中HNF-1α,在HepG2细胞内,与转录因子c-Jun,JunB相互作用[14]调节ApoM表达。癌基因产物c-Jun及JunB属于AP-1超家族,AP-1/Jun转录因子家族的表达水平和细胞分化状态有关[13]。肝细胞同系物受体-1(LRH-1)作为肝细胞核受体超家族成员,以单体形式结合于调控序列。LRH-1调节胚胎分化某些转录因子表达如 Oct4、HNF-3β、HNF-4α、HNF-1α。本课题前期实验结果,提示干扰HepG2细胞HNF-1α后ApoM表达降低,处于上游调控转录因子的HNF不仅参与调控细胞分化,而且直接调节ApoM的表达。本实验结果提示ApoM在低分化组织中的表达明显低于中高分化组织,随着分化程度上升,ApoM可能参与肝细胞高分化状态的维持,与肝癌的分化程度相关。此外,我们发现在透明的细胞类肝细胞癌胞浆中ApoM几乎不表达,但在某些HE染色标本中胞浆丰富细胞内ApoM强阳性。ApoM表达与年龄、肿瘤大小、肿瘤发生部位及淋巴转移等差异无统计学意义。
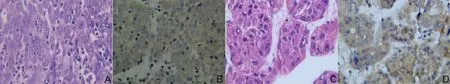
图2 肝细胞癌组织中ApoM蛋白表达(HE,×400)Fig2 ApoM expression in the hepatocellular carcinoma(HE,×400)
本研究统计分析结果表明ApoM的表达情况与肝癌的分化程度有关。ApoM随肿瘤分化程度升高,其表达水平亦随之上升,据此推测,ApoM可能与维持细胞高分化状态有关。目前认为ApoM作为HDL的组成成分主要参与胆固醇的逆向转运、炎症反应,发挥着抗氧化作用,但ApoM在其他肿瘤中的表达及其作用、具体功能等目前尚不清楚,对此有待进一步研究。
[1]XU N,DAHLBÄCK B.A novel human apolipoprotein(ApoM)[J].The Journal of biological chemistry,1999,274(44):31286-31290.
[2]ZHANG XIAOYING,DONG XUAN,ZHENG LU,et al.Specific tissue expression and cellular localization of human apolipoprotein M as determined by in situ hybridization[J].Acta histochemica,2003,105(1):67-72.
[3]OOI K,SHIRAKI K,SAKURAI Y,et al.Clinical significance of abnormal lipoprotein patterns in liver diseases[J].Int JMol Med,2005,15(4):655-660.
[4]PLEGUEZUELO M,LOPEZ-SANCHEZ LM,RODRIGUEZ-ARIZA A,et al.Proteomic analysis for developingnew biomarkers of hepatocellular carcinoma[J].World JHepatol,2010,27;2(3):127-135.
[5]YOKOYAMA Y,KURAMITSU Y,TAKASHIMA M,et al.Protein level of apolipoprotein E increased in human hepatocellular carcinoma[J].Int JOncol,2006,28(3):625-631.
[6]GU JINGANG,ZHU CHENGLIANG,CHENG DUOZHI,et al.Enchanced levels of Apolipoprotein M during HBV infection feedback suppresses HBV replication [J].Lipids in Health and Disease,2011,10:154.
[7]程龙强,章 尧,陈昌杰,等.肝细胞癌中载脂蛋白 M,肝受体同系物1和肝细胞核因子1α表达的相关性分析[J].癌变.畸变.突变,2010,22(2):130-133.
[8]章尧,陈昌杰,杨清玲,等.干扰肝细胞核因子-1α对HepG2细胞载脂蛋白M及胆固醇相关代谢酶表达的影响[J].中华肝脏病杂志,2011,19(2):121-126.
[9]VENTECLEF N,HARONITIA,TOUSAINT JJ,et al.Regulation of anti-atherogenic apolipoprotein M gene expression by the orphan nuclear receptor LRH-1 [J].Biol Chem,2008,283(7):3694-3701.
[10]RICHTER S,SHIH DQ,PEARSON ER,et al.(2003)Regulation of apolipoprotein M gene expression by MODY3 gene hepatocyte nuclear factor-1a:haploinsufficiency is associated with reduced serum apolipoprotein M levels[J].Diabetes,2003,52(12):2989-2995.
[11]WOLFRUM C,HOWELL JJ,NDUNGO E,et al.(2008)Foxa2 activity increases plasma high density lipoprotein levels by regulating apolipoprotein M [J].Biol Chem,2008,283(24):16940-16949.
[12]MOSIALOU I,ZANNIS VI,KARDASSIS D.Regulation of human apolipoprotein m gene expression by orphan and ligand-dependent nuclear receptors[J].Biol Chem,2010,285(40):30719-30730.
[13]曾益新.肿瘤学[M].2版.北京:人民卫生出版社,2003:181-184.
[14]MOSIALOU I,KRASAGAKISK,KARDASSISD.Opposite regulation of the human apolipoprotein M gene by hepatocyte nuclear factor 1 and Jun transcription factors[J].Biol Chem,2011,286(19):17259-17269.
