P53、MDM2在基底细胞癌中的表达及意义
2012-04-29艾东方冯世军马敬
艾东方 冯世军 马敬

[摘要]目的:研究p53和MDM2蛋白在皮肤基底细胞癌中的表达,探讨基底细胞癌的发生和发展机制。方法:选取50例基底细胞癌标本,30例正常皮肤组织。采用免疫组化S-P法检测p53与MDM2蛋白的表达情况。结果:p53、MDM2蛋白在基底细胞癌组织中的阳性表达率分别为58%(29/50)、46%(23/50),与正常皮肤组织比较,有显著性差异(P<0.05)。基底细胞癌组织中p53蛋白的表达与MDM2蛋白的表达呈正相关(r=0.460)。结论:p53和MDM2蛋白在基底细胞癌中的异常表达,说明在基底细胞癌的发生及发展过程中起重要作用。
[关键词]p53;MDM2;基底细胞癌;免疫组织化学
[中图分类号]R739.5[文献标识码]A[文章编号]1008-6455(2012)06-0939-03
基底细胞癌(BCC)大约占所有皮肤癌的75%,而且以3%~8%的速度逐年递增,BCC好发于头颈部,虽然生长缓慢,很少转移,但却有毁损性。BCC的发生是多基因相互作用的结果,目前,在其他多种肿瘤中可以检测到突变型p53和MDM2的表达,而对于二者在BCC组织中的表达情况及相关性,则研究较少。我们在此采用免疫组织化学方法检测了p53、MDM2在BCC组织及正常皮肤组织中的表达情况,探讨p53、MDM2在BCC发病中的意义。
1资料和方法
1.1 一般资料:组织标本来自2005年10月~2009年10月期间沧州市中心医院门诊及住院患者,手术切除后经病理证实为BCC。50例BCC中,男性26例,女性24例,年龄36~82岁,平均62.34岁,病程6个月~12年,平均40.25个月,头面部42例(84%),躯干部位8例(16%)。排除标准:取材前1年内肿瘤经过放射线治疗;取材前3个月内局部应用过咪喹莫特、干扰素等药物或系统应用过维甲酸等化疗性药物。另选取正常人包皮手术切除标本30例,年龄18~40岁,平均23岁。
1.2 研究方法:手术切除标本均经10%多聚甲醛溶液固定,常规石蜡包埋,切片厚度4μm,使用S-P免疫组化染色方法对切片进行染色,免疫组化操作步骤严格按试剂盒说明进行。鼠抗人p53单克隆抗体及鼠抗人MDM2单克隆抗体均购自上海太阳生物技术有限公司。用已知阳性切片作阳性对照,用碱性磷酸盐缓冲液(PBS)代替一抗作阴性对照。
1.3 结果判断:p53免疫组化阳性信号位于细胞核,呈棕黄色或棕褐色,MDM2免疫组化阳性信号位于细胞核或胞浆,呈棕黄色,染色结果参照文献[1]评分方法,高倍镜下取5个不同视野,各计数200个细胞,计算阳性细胞所占百分比,阳性细胞数计数分:阳性数<5%为0;35%>阳性数≥5%为1;70%>阳性数≥35%为2;阳性数>70%为3。着色强度计分:不着色为0,弱着色(呈淡棕黄色)为1,强着色(呈明显的棕黄色)为2。阳性分级:以上两项相加,0~1分为(-),2分为(±),3分为(+),4分为(++),5分为(+++),-~±记为阴性,+~+++记为阳性。
1.4 统计学处理:采用SPSS13.0统计学软件进行统计学处理,p53和MDM2阳性百分率的比较采用计数资料的χ2检验,P<0.05表示有统计学差异。
2结果
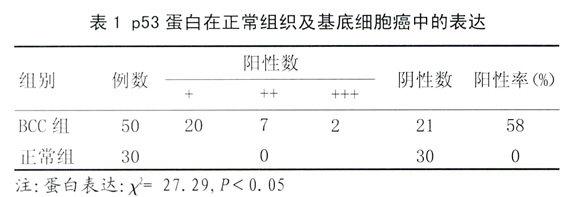
2.1 正常皮肤组织中p53蛋白表达率为0(0/30);BCC组织中p53蛋白阳性表达率为58%(29/50)(见图1、2),癌组织中p53蛋白阳性率与正常皮肤组织相比,差异有统计学意义(P<0.05),见表1。
2.2正常皮肤组织中MDM2蛋白表达率为0(0/30);BCC组织中MDM2蛋白阳性表达率为46%(23/50)(见图3、4),癌组织中MDM2蛋白阳性率与正常皮肤组织相比,差异有统计学意义(P<0.05),见表2。
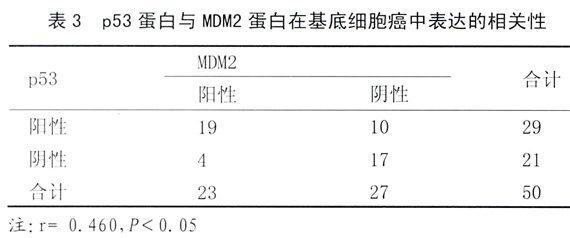
2.3p53蛋白与MDM2蛋白表达的相关性分析,p53蛋白与MDM2蛋白有一个比较高的共同表达率,在50例BCC组织中有19例共同表达,阳性表达率为38%,通过相关分析表明,二者在BCC组织中的表达有明显的相关性(P<0.05),见表3。
3讨论
p53与基底细胞癌发生发展的关系:p53蛋白分为野生型和突变型两种,野生型p53阻碍受损伤细胞进入DNA合成期,抑制细胞的分裂和增殖,使受损的DNA有时间修复,或启动程序性死亡过程,防止细胞恶变,在p53基因缺失或突变的细胞,受损伤的DNA无法通过p53介导的途径停止在G1期进行修复,细胞的遗传信息受阻,导致恶性转化、增殖以及肿瘤的发生,但由于野生型p53基因的半衰期短,不易被检测出,而突变型p53基因半衰期长,所以一般认为,免疫组化法阳性的就表示存在突变型p53基因。BCC由正常角质形成细胞恶性转化而成,好发于曝光部位,过度紫外线照射是诱因之一,研究证明BCC存在p53突变,且大多数为光突变(C→T或CC→TT转换),光照导致的p53基因突变参与光致癌过程。P53蛋白在BCC中的阳性表达率报道结果不一,Gorji[2]认为p53阳性率为48.5%,而Adamkov[3]报道p53蛋白的阳性率可高达90.3%,另有研究表明[4]p53的表达可以作为预测BCC侵袭性的一个标记,而与患者年龄和肿瘤部位没有相关性。我们的试验结果显示:p53蛋白在BCC中的阳性表达率为58%(29/50),相对与Gorji的研究结果相近,和正常皮肤组织p53蛋白表达相比,差异有统计学意义(P<0.05),表明p53参与BCC的发病过程。
MDM2与基底细胞癌发生发展的关系:MDM2是癌基因,对细胞的生长有调节作用,参与细胞的基本生理活动,但在正常组织中MDM2蛋白的表达水平很低,MDM2基因突变或表达异常后则会引起细胞转化和肿瘤的发生[5],一方面,MDM2基因通过其编码的P90蛋白与野生型p53基因结合,使p53基因失去正常功能,导致肿瘤的发生[6];另一方面,MDM2本身也可以通过数个非p53依赖性作用方式直接致癌。早期研究认为只有在无p53突变的肿瘤中,才能够有较高水平的MDM2基因扩增以及相应mRNA和蛋白质的表达,然而近年来越来越多的具有p53突变的肿瘤也被发现存在MDM2蛋白的过度表达。BCC具有较高的p53突变率,Cho HS[7]报道MDM2蛋白在BCC中的阳性表达率为50%,其中,MDM2(+)/p53(+)占39%,显示MDM2蛋白在BCC中有较高的表达,并且与p53蛋白的表达有一个较密切的关系,近期,Almquist[8]分析了902例基底细胞癌和676例鳞状细胞癌,发现携带MDM2SNP309G等位基因伴随一个升高的非黑素瘤皮肤癌的风险。我们的试验结果显示:MDM2蛋白在BCC中的阳性表达率为46%(23/50),与Cho HS的研究结果相近,和正常组织MDM2蛋白表达相比,差异有统计学意义(P<0.05),表明MDM2参与了BCC的发生发展过程。
p53与MDM2在基底细胞癌发病过程中的相互关系:肿瘤的发生、发展较为复杂,其中涉及到原癌基因的激活和抑癌基因的失活以及二者之间的相互作用,本试验表明p53和MDM2表达升高在BCC发病过程中扮演着重要角色,由于BCC好发于老年人,推测在BCC发病过程中,长期的紫外线照射等诱因促使p53基因突变,突变型p53不能修复受损的DNA,DNA损伤后,激活MDM2并促使其表达,而MDM2降解突变型p53的能力减弱,导致突变型p53蛋白与MDM2蛋白的慢性蓄积,并反复加重此循环过程,最终引起细胞的恶性转化、增殖及肿瘤形成。在MDM2(+)/p53(-)病例,推测MDM2通过表达P90蛋白并与野生型p53蛋白结合,使野生型p53功能丧失,同样不能使受损的DNA恢复正常,而且,作为癌基因的MDM2,有可能与启动整个细胞周期的基因启动子结合,使细胞从G1期向S期转化,引起细胞成瘤性增强。由于BCC的发生、发展是一个多基因相互作用的复杂过程,在均无MDM2、p53表达的病例,可能有不依赖于二者的作用机制促进了BCC的发病,目前仍需要进一步的研究。
[参考文献]
[1]Shimizu M,Saitoh Y,Itoh H. Immunohistochemical staining of Ha-ras oncogene product in normal, benign, and m alignant human pancreatic tissues[J]. Hum Pathol,1990,21(6):607-612.
[2]Gorji H,Shahbazi N,Habibollahi P,et al.The glutathione-S-transferase P1 polymorphisms correlates with changes in expression of TP53 tumor suppressor in cutaneous basal cell carcinoma[J].J Dermatol Sci,2009,56(3):208-210.
[3]Adamkov M,Halasova E,Rajcani J,et al. Relation between expression pattern of p53 and survivin in cutaneous basal cell carcinomas[J]. Med Sci Monit,2011,17(3):74-80.
[4]Ansarin H,Daliri M,Soltani-Arabshahi R. Expression of p53 in aggressive and non-aggressive histologic variants of basal cell carcinoma[J]. Eur J Dermatol,2006,16(5):543-547.
[5]Weissman AM.Themes and variations on ubiquitylation[J].Nat Rev Mol Cell Biol, 2001,2(3):169-178.
[6]Momand J,Zambetti GP,Olson DC,et al.The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation[J].Cell,1992,69(7):1237-1245.
[7]Cho HS,Park EJ,Kim CW,et al.Immunohistochemical Study of p53 and MDM2 Expression on the Epithelial Tumors of the Skin[J]. Korean J Dermatol,2007,45(6):534-540.
[8]Almquist LM,Karagas MR,Christensen BC,et al.The role of TP53 and MDM2 polymorphisms in TP53 mutagenesis and risk of non-melanoma skin cancer[J].Carcinogenesis,2011,32(3):327-330.
[收稿日期]2012-03-06[修回日期]2012-04-21
编辑/张惠娟
