格列本脲人工抗原的合成与鉴定
2012-04-01郑海涛何计国
刘 盼,郑海涛,何计国
(中国农业大学食品科学与营养工程学院,北京 100083)
格列本脲人工抗原的合成与鉴定
刘 盼,郑海涛,何计国*
(中国农业大学食品科学与营养工程学院,北京 100083)
目的:合成格列本脲人工抗原。方法:采用对氨基苯甲酸法制备半抗原,将半抗原分别与牛血清白蛋白(BSA)和卵清蛋白(OVA)通过碳二亚胺法偶联制备免疫原(Gli-BSA)和包被原(Gli-OVA),利用紫外扫描进行抗原的化学鉴定,通过免疫原免疫Balb/c小鼠,间接酶联免疫吸附法测定抗血清进行生物鉴定。结果:制备了Gli-BSA、Gli-OVA的人工抗原,经紫外光谱扫描,偶联比分别为4:1和17.7:1。免疫小鼠后获得抗血清的效价均达到32000以上,半抑制质量浓度为10μg/mL。结论:成功合成了格列本脲人工抗原,并获得了格列本脲抗体,为格列本脲的免疫学检测方法进一步研究提供了实验基础。
格列本脲;半抗原;载体蛋白;完全抗原
格列本脲,又名优降糖,作为第二代的磺酰脲类降糖西药被广泛用于糖尿病的治疗。磺酰脲类药物具有刺激β细胞分泌胰岛素、减轻胰岛素抵抗,降低空腹和餐后血糖的作用,是目前治疗非胰岛素依赖型糖尿病最主要的口服降糖药[1]。主要不良反应有过敏反应,胃肠反应和低血糖反应,年老体弱和肝肾功能不全者易发生低血糖反应造成昏迷与死亡。死亡率可达11%,不可逆脑损伤可达5%[2-3]。作为一种处方药,使用时有其严格的剂量与时间要求,而由于格列本脲较好的降糖效果和低廉的价格,常被商家非法添加到保健食品和中成药中,对消费者的身体健康产生不良影响,因此有必要开发一种快速有效的检测方法。现有检测方法主要为:薄层色谱法[4-5]、液相色谱法[6-7]、液质联用法[8-9]
等。薄层色谱法只能进行定性检测,且假阳性率高,其他方法则前处理复杂、烦琐耗时、仪器价格昂贵,且不适宜于现场检测。近年来,免疫分析技术已经越来越广泛的应用于农兽药残留分析和掺伪食品鉴定领域,以其简单、廉价、快捷、灵敏度高、适用于大批量样品检测等优点而成为一种重要的分析方法。目前尚未见格列本脲的免疫化学检验方法及产品的报道,因此本实验进行了格列本脲免疫原的和包被原合成,为格列本脲单克隆抗体的制备和检验试剂的研发提供研究试材。
1 材料与方法
1.1 材料与试剂
格列本脲(99%) Afla(天津)有限公司。
6周龄雌性Balb/c小鼠8只,20g/只,SPF级,购于军事医学科学院实验动物中心。
对氨基苯甲酸 天津市精细化工研究所;N- 羟基琥珀酰亚胺(NHS) 德国Merck-Schuehardt公司;对乙基-N,N-二甲基丙基碳二亚胺(EDC)(化学纯) 国药集团化学试剂有限公司;N,N-二甲基甲酰胺(DMF)、乙二胺(EDA)、硼酸、盐酸、亚硝酸钠(化学纯) 北京化学试剂公司;牛血清白蛋白(BSA)第五组分(含量>98.0%)、卵清白蛋白(OVA)、弗氏完全佐剂、弗氏不完全佐剂 美国Sigma公司;薄层色谱硅胶预制板 烟台市化学工业研究所;Tween-20(纯度>98.0%) 美国Fluka公司;0.01mol/L pH7.4的PBS溶液(磷酸缓冲液)、考马斯亮蓝染液、包被缓冲液(0.05mol/L pH9.6 的碳酸盐缓冲液)、封闭液(含1%明胶的0.05mol/L pH9.6 的碳酸盐缓冲液)、洗涤液PBST(含0.05% Tween-20的0.01mol/L,pH7.4的PBS)、底物缓冲液(pH5.0的磷酸-柠檬酸缓冲液)、底物TMB(2mg/mL DMSO)、终止液(2mol/L H2SO4)均为实验室配制。
1.2 仪器与设备
FA1004 电子分析天平 北京东南仪诚实验室设备有限公司;722S 分光光度计 上海精密科学仪器有限公司;UV-2450 紫外-可见分光光度计 日本岛津分析仪器公司;Alpha-Pure 纯水系统 上海瑞枫生物科技有限公司;LGJ-10冷冻干燥机 北京四环科学仪器厂;JB21磁力搅拌器 上海雷磁新泾仪器;ROTINA35 台式离心机 德国Hettich公司;透析袋(分子质量12000~14000D)北京拜尔迪有限公司。
1.3 抗原合成
1.3.1 半抗原的合成
1.3.1.1 格列本脲的脱甲基化[10]
试剂与条件:BBr3,CH2Cl2,温度0℃后逐渐至室温,时间为2d,按图1的合成路线委托其他实验室合成。
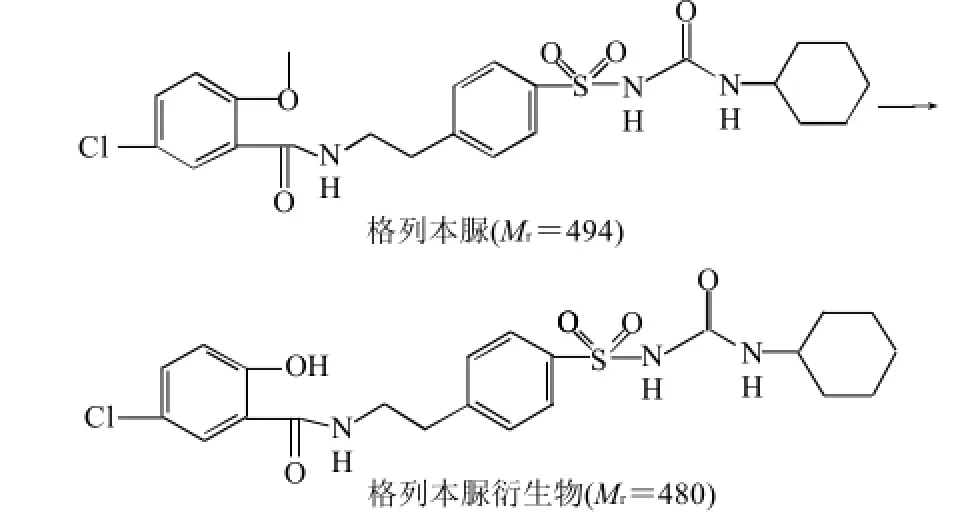
图1 格列本脲衍生物的合成路线Fig.1 Synthetic route of glibenclamide derivatives
1.3.1.2 半抗原的合成[11]
称取20mg(145μmol)对氨基苯甲酸(Mr=137)溶于2.2mL 0.2mol/L的HCl,0~4℃搅拌,得到A液。将12mg (174μmol)NaNO2溶于0.35mL蒸馏水,得到B液。将B液逐滴加入A液中,避光搅拌反应1h,得到C液,溶液略带微黄色。称取30.1mg(62.7μmol)格列本脲衍生物,溶于600μL DMF,再加入10mL 4℃的0.05mol/L硼砂缓冲液(pH8.5,含0.15mol/L NaCl),0~4℃搅拌、反应,得到D液。将1.5mL C液加入到D液中,避光反应2h。加H3BO3晶体调节pH值至7.4,得到半抗原。
通过薄层层析法和质谱法进行半抗原合成的鉴定。合成路线见图2。

图2 格列本脲半抗原的合成路线Fig.2 Synthetic route of glibenclamide hapten
1.3.2 完全抗原的合成
免疫原(Gli-BSA)的合成采用牛血清白蛋白(BSA)为载体。先活化BSA蛋白得到cBSA。
cBSA的制备[10]:将18mg(300μmol) EDA慢慢滴入4℃的20mL(0.01mol/L pH7.4)磷酸盐缓冲液PBS中,0~4℃搅拌,向该溶液中逐滴加入浓盐酸,调pH值至7.4;称取1g BSA(15 μ mol)和56mg (300 μ mol)EDC加入上述EDA的溶液中,室温反应2h。反应完毕后,反应液用玻砂漏斗抽滤,取上清液透析以除去多余的EDA。用PBS (0.01mol/L pH7.4)缓冲液0~4℃透析5d,每8h更换一次透析液。将透析后的溶液冻干,得白色絮状固体,-20℃保存。
免疫原的合成[12]:加入136mg(2μmol)的cBSA,随后加入120mg(626μmol)EDC,36mg(313μmol)的NHS,室温搅拌3 h。得到酒红色反应液(合成的目标产物Mr=628.1)。用PBS(0.01mol/L,pH7.4)0~4℃透析3d,每8h更换一次透析液。
另以卵清蛋白(OVA)为载体蛋白,同法合成包被原(Gli-OVA)。
通过考马斯亮蓝G-250法测定合成抗原的蛋白浓度,紫外(200~400nm)扫描测定偶联比。
偶联比的计算方法[13]:

式中:A330nm为抗原在小分子最大吸收波长处(330nm)的吸光度;为BSA在其最大吸收波长处(278nm)的吸光度;为BSA在小分子最大吸收波长处(330nm)的吸光度;为小分子在其最大吸收波长处(330nm)的吸光度;为小分子在BSA最大吸收波长处的吸光度;A278nm为偶联物在BSA最大吸收波长处的吸光度;C1为小分子标准物浓度(mol/L);C2为BSA标准物浓度(mol/L)。
Gli-OVA偶联物鉴定方法同上。
1.4 动物免疫
选取8只6周龄的Balb/c雌性小鼠,两只用作阴性对照,另外6只用免疫原BSA-Gli进行免疫。免疫剂量为100μg/只,首次免疫采用等量弗氏完全佐剂乳化后皮下多点注射,以后每两周免疫一次,采用等量弗氏不完全佐剂乳化后注射。第3次免疫后7d对小鼠进行眼眶采血约0.1mL/只,室温静置1h,再置4℃冰箱过夜,4000r/min离心10min,收集血清,-20℃保存。采用间接ELISA方法[14],用Gli-OVA作为包被原测定免疫小鼠的抗血清。
2 结果与分析
2.1 半抗原的合成
通过重氮化反应,将对氨基苯甲酸以氮氮双键连接于格列本脲的苯环上,采用薄层层析法和质谱法进行产物鉴定。
2.1.1 薄层色谱鉴定
薄层色谱法[15](展开剂:氯仿、环己烷、乙醇、冰醋酸体积比8:13:1:1),结果显示,在硅胶板上Rf为0.74处出现新的展开点(脱甲基格列本脲的Rf为0.86、对氨基苯甲酸的Rf为0.57),表明反应产生了不同于格列本脲衍生物和对氨基苯甲酸的物质,说明发生了重氮化反应并产生了新物质。
2.1.2 质谱鉴定
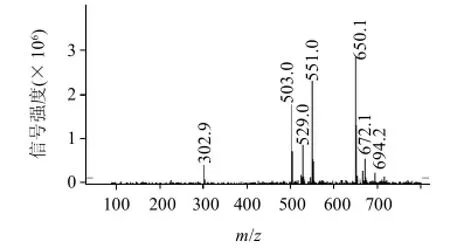
图3 格列本脲半抗原的质谱鉴定图Fig.3 Mass spectrum of glibenclamide hapten
由图3可见,反应物中存在m/z为650.1的质谱峰,由于本次质谱为加钠的分子离子峰[M+Na-H],因此650.1的质谱峰表明生成了相对分子质量为628.10(650.1-23+1)的产物,该产物相对分子质量与目标产物的相对分子质量628.15一致,结合反应路线,可以推断合成产物即为所需的目标半抗原,说明该合成路线可以用于格列本脲半抗原的合成。同时可见,650.1的分子离子峰是最强峰,表明新产物为反应体系中的主要物质,说明反应产物具备相对较高的纯度。
2.2 完全抗原的制备
通过碳二亚胺法将半抗原的羧基与载体蛋白的氨基偶联,分别制备免疫原和包被原,产物采用考马斯亮蓝G-250法测定蛋白质含量,采用紫外扫描鉴定偶联比。
2.2.1 完全抗原的蛋白质质量浓度
用考马斯亮蓝G-250法[16]测定完全抗原的蛋白质质量浓度,以标准蛋白质量浓度(mg/mL)为横坐标,以吸光度的相对百分数(%)为纵坐标做工作曲线,分别得到BSA的工作曲线方程为y=0.7295χ+0.0229,R2=0.9999;OVA的工作曲线方程为y=0.52χ-0.01,R2=0.9984。根据BSA、OVA的工作曲线计算Gli-BSA、Gli-OVA的蛋白质质量浓度分别为8.1、4.6mg/mL。
2.2.2 完全抗原的鉴定及偶联比
用紫外扫描检测法测定两种不同方法合成的人工抗原中半抗原与载体蛋白的偶联情况。根据偶联物中所测蛋白的质量浓度,将载体蛋白及偶联物均配制成0.2mg/mL,格列本脲衍生物配成0.02mg/mL,并将上述溶液在200~400nm扫描其紫外吸收,根据扫描图谱进行偶联产物的鉴定。

图4 免疫原Gli-BSA的紫外扫描图谱Fig.4 UV scanning spectrum of immunogen Gli-BSA
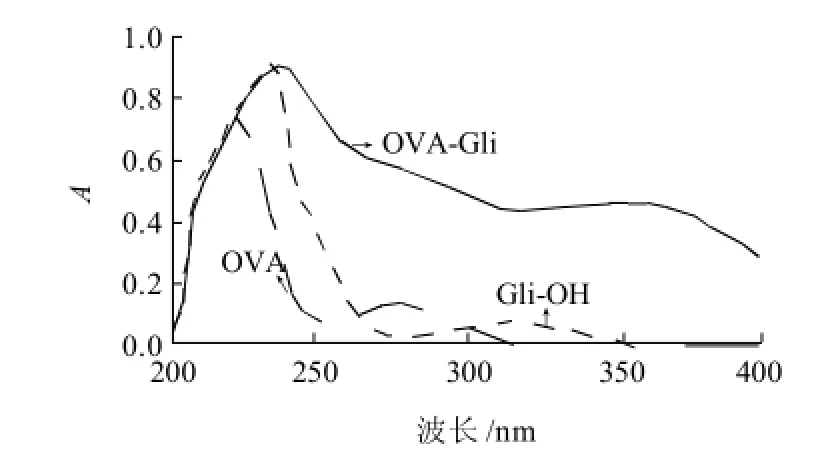
图5 包被原Gli-OVA的紫外扫描图谱Fig.5 UV scanning spectrum of coating antigen Gli-OVA
由图4、5可见,偶联物Gli-BSA/Gli-OVA与BSA/OVA在相同的蛋白质质量浓度下,吸收曲线发生了改变,在Gli-OH的最大吸收范围内,吸光度增加,表明偶联物的紫外吸收峰为蛋白质和半抗原吸收峰的叠加,说明载体蛋白成功偶联上了一定数目的小分子半抗原,生成了完全抗原,与BSA偶联的可以作为免疫原,与OVA偶联的可以作为包被原。
根据图谱计算结果为免疫原Gli-BSA和包被原Gli-OVA的偶联比分别是:4:1和17.7:1。
2.3 免疫效果的测定结果
用Gli-OVA作为包被原,用间接ELISA法测定免疫原Gli-BSA免疫小鼠3次后获得的小鼠抗血清,效价均达到32000以上,半抑制质量浓度(IC50)为10μg/mL,说明合成的免疫原能够刺激小鼠产生抗体,该抗体和格列本脲小分子具有一定的亲和力,格列本脲小分子可以和包被原竞争该抗体,能够制备间接竞争法测定格列本脲的测试试剂盒,并可以通过细胞融合制备单克隆抗体。
3 讨 论
格列本脲相对分子质量为494.01(<1000), 为小分子物质,只有反应原性而无免疫原性,不能诱导机体产生抗体和致敏淋巴细胞,因而需要与大分子的载体蛋白偶联,合成既有反应原性又有免疫原性的人工全抗原[17]。
抗原合成有多种方法,都是要通过半抗原小分子上一定的官能团(如—COOH或—NH2)连接到载体蛋白上,没有特征官能团的小分子则需先经过衍生等分子修饰使其带上可连接载体的官能团。因为格列本脲的分子结构没有可以偶联载体蛋白的活性基团,本实验选择通过去甲基,使苯环上的甲氧基变成酚羟基,再通过酚羟基的邻位反应,用对氨基苯甲酸的重氮盐取代酚羟基邻位的氢,从而给格列本脲分子接上一个对氨基苯甲酸作为间隔臂,同时也提供了可接蛋白的活性基团—COOH。这个结构完整的保留了格列本脲分子中可能的抗原决定簇部分磺酰脲基团和苯环上的杂原子氯。磺酰脲结构是磺酰脲类降糖药的共性结构,如果产生了针对此部分的抗体,则可建立检测整个磺酰脲类的ELISA检测方法,具有重要意义。
采用了碳二亚胺法将半抗原与载体蛋白相偶联合成抗原,碳二亚胺作为一种脱水剂,可使小分子和蛋白载体间经过羟氨缩合反应连接,格列本脲半抗原的—COOH和载体蛋白分子的—NH2在碳二亚胺的脱水作用下连接。
免疫原的特异性不仅与偶联物的分子及结构性质相关,还与每个蛋白分子上偶联的小分子的数目相关,因此在免疫前,测定人工抗原中载体上连接的小分子数目是非常重要的。通常每一载体上含有8~25个半抗原能得到效价较高的抗体[18],也有研究认为,偶联比为3:1~45:1时,免疫原性较强[19]。本研究用紫外吸收光度法测得免疫原和包被原偶联比分别为4:1和17.7:1,在3:1~45:1的范围内,免疫小鼠的实验结果显示,三免后效价均达到32000以上,半抑制浓度达到10μg/mL,也间接说明了抗原合成成功,与赵肃清等[19]的报道一致。
4 结 论
通过对氨基苯甲酸法合成了格列本脲半抗原,碳二亚胺法成功合成了格列本脲免疫原和包被原,偶联比分别为4:1和17.7:1,免疫小鼠效价均达32000以上,半抑制质量浓度达到10μg/mL,可以用于下一步单克隆抗体的制备及免疫学快速检测方法的建立。
[1]MARCHETTI P, NAVALESI R. Pharmacokinetic-pharmacodynamic relationships of oral hypoglycemic agents[J]. An Update Clin Pharmacokinet, 1989, 16: 100.
[2]刘万群. 口服格列本脲过量致昏迷1例[J]. 药学实践杂志, 1998, 16(6): 362.
[3]杨幼青. 传统 磺酰脲类药物:降血糖药物中[J]. 上海医药, 2009, 30(7): 333.
[4]宋家玉, 周景洋, 丰硕, 等. 薄层色谱法检测降糖中药制品中的格列本脲[J]. 中国卫生检验杂志, 2006, 16(11): 1339-1340.
[5]PAMELA G T, SHANTA R J. The identification, assay and purity determination of chlorpropamide, glibenclamide and tolbutamide and their tablet preparations by thin-layer chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 1983, 1(2): 189-193.
[6]黄作君, 黎月玲, 郑企琨, 等. 高效液相色谱法测定人血浆中格列本脲浓度[J]. 中国医院药学杂志, 2004, 24(1): 22-23.
[7]ABURUZ S, MILLERSHIP J, MCEINAY J. The development and validation of liquid chromatography method for the simultaneous determination of metformin and glipizide, gliclazide, glibenclamide or glimperide in plasma[J]. Journal of Chromatography B, 2005, 817(2): 277-286.
[8]胡青, 崔益泠, 张甦. 降血脂和降糖类中药及保健食品中违禁添加17种化学药物的液相色谱-离子阱质谱定性检测[J]. 中国医药工业杂志, 2009, 40(2): 124-127.
[9]SURESH B N, BRIAN J K, MARY F H, et al. Validation of a sensitive LC-MS assay for quantification of glyburide and its metabolite 4-transhydroxy glyburide in plasma and urine: an OPRU Network study original research article[J]. Journal of Chromatography B, 2007, 860(1): 34-41.
[10]HENDRA G, GUO Junliu, MAXWELL R B, et al. Cubyl amides: Novel P2X7receptor antagonists[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(13): 3720-3723.
[11]张玉兰. 四环素、沙丁胺醇、特布他林酶联免疫吸附测定法的建立[D]. 济南: 山东大学, 2007.
[12]肖甄磊, 谢忠良, 何计国. 卡巴氧的代谢物喹喔啉-2-羧酸人工抗原的合成及其多克隆抗体的制备[J]. 食品科学, 2008, 29(5): 60-64.
[13]于洪侠. 莱克多巴胺酶联免疫吸附法(ELISA)的建立[D]. 北京: 中国农业科学院, 2005.
[14]朱学加. 喹乙醇单克隆抗体制备与初步应用研究[D]. 北京: 中国农业大学, 2007.
[15]陈斌, 胡赵俊, 余岳林, 等. 中成药和保健食品中非法添加西药成分检测方法的探索[J]. 药物分析杂志, 2009, 29(10): 1677-1680.
[16]汪家, 政范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2000, 73: 77-101.
[17]张梅, 张继瑜, 李剑勇. 兽药人工抗原合成的研究进展[J]. 中兽医医药杂志, 2006, 25(1): 63-65.
[18]LI Qingxiao, ZHAO Mengshu, GEE S L, et al. Development of enzymelinked immunosorbent assays for 4-nitrophenol and substituted 4-nitrophenols[J]. Agric Food Chem, 1991, 39(9): 1685-1692.
[19]赵肃清, 孙远明, 乐学义, 等. 农药人工抗原和成的研究进展[J]. 农药, 2002, 41(3): 9-11.
Synthesis and Identification of Artificial Antigen for Glibenclamide
LIU Pan,ZHENG Hai-tao,HE Ji-guo*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Objective: To synthesize artificial antigen for glibenclamide. Methods: Hapten was synthesized by diazo reaction with p-aminobenzoic acid, and conjugated separately with BSA (bovine serum albumin) and OVA (ovalbumin) by carbodiimide method. Immunogen and coating antigen were obtained and designated as Gli-BSA and Gli-OVA, respectively. The synthesized artificial antigens were identified by mass spectrometry and UV spectroscopy. The immunogen was used to immunize Balb/c mice and the generated anti-serum was analyzed by indirect ELISA. Results: Gli-BSA and Gli-OVA were successfully synthesized with a coupling ratio of 4:1 and 17.7:1, respectively. The anti-serum titers after the first, second and third immunization of Balb/c mice were all above 32000 and the IC50 was 10 μg/mL. Conclusion: Artificial antigens for glibenclamide has been successfully synthesized and anti-glibenclamide antibodies have been acquired. This study can provide a basis for further studies on immunological detection of glibenclamide.
glibenclamide;hapten;carrier protein;complete antigen
TS201.2
A
1002-6630(2012)01-0200-04
2011-03-22
刘盼(1986—),女,硕士研究生,研究方向为营养与食品安全。E-mail:pingdiguo2137@yahoo.com.cn
*通信作者:何计国(1966—),男,副教授,研究方向为功能食品以及食品安全检测。E-mail:hejiguo0870@sina.com
