外源诱导物对百里香植株再生过程中脂氧合酶活性的影响
2012-03-13李翠霞李志忠
李翠霞,李志忠,张 继
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050; 2.西北师范大学生命科学院,甘肃 兰州 730030)
百里香(Thymusvulgaris)是唇形科百里香属多年生芳香植物[1],百里香属植物所含的化学成分主要为挥发性脂肪酸衍生物等[2-3]。在百里香中脂肪酸衍生物合成的主要调控酶是脂氧合酶(LOX),它能够催化亚油酸、亚麻酸等不饱和脂肪酸转变为挥发性物质[4]。挥发性物质的释放与百里香植株抵抗和防御非生物机械损伤和环境胁迫而做出的反应有关[5]。已有研究报道表明,植物中LOX通常处于静止状态,只有当生物体发育到一定阶段或受到环境胁迫时才启动[6-7]。因此,研究不同外源处理因素对LOX活性的影响,可以为研究植物在抵抗不同的自然环境、防御非生物机械损伤以及环境胁迫的反应提供理论依据。本研究以百里香为材料,分析在培养基中添加不同的碳氮源配比、前体诱导因素以及喷施不同外源诱导物对增殖百里香中LOX活性的影响,以期揭示LOX的诱导机制。
1 材料与方法
1.1材料与仪器 百里香种子采自甘肃康乐地区。试验材料处理方法及仪器试剂参见文献[8]。
1.2试验处理
1.2.1碳氮源调控 培养基中碳源和氮源的调控方法参见文献[8]。
1.2.2前体调控 在1/2 MS培养基上分别添加浓度为0、0.2、0.4、0.6、0.8、1.0 mmol·L-1的苯丙氨酸、谷氨酸和丙酮酸3种前体诱导物,每个处理均设8个重复,观察再生植株的生长情况,培养30 d后测定不同诱导处理下再生植株中脂氧合酶活性。
1.2.3外源处理因素的调控 外源诱导处理方法参见文献[8]。分别在处理后0、12、24、48、72、96和120 h取样,测定LOX活性,每个处理设3次重复。
1.3脂氧合酶活性测定 取0.3 g百里香,参考文献[9]中方法并略作修改,加入3 mL磷酸提取缓冲液[pH值6.5,1%TritonX-100R(V/V)和1%PVP]于冰浴中研磨成浆。4 ℃、9 000 r·min-1下离心15 min,测定上清液LOX活性。反应液组成:0.1 mL Tween-20分散于10 mL硼酸缓冲液中(0.2 mol·L-1,pH值9.0),加入0.1 g亚油酸充分混匀,再加入1.0 mol·L-1的NaOH 0.3 mL充分震荡,pH值调至6.2,稀释20倍。测定酶活性时,将0.1 mL酶液和0.5 mL的底物混合置于25 ℃的水浴中保温4 min,加入2.4 mL的无水乙醇终止反应,234 nm处测定OD值。LOX活性以每克植株鲜质量每分钟1个OD234 nm值的变化为酶活单位。
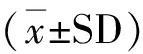
2 结果与分析
2.1碳氮源调控对LOX活性的影响 在蔗糖浓度为1%~4%时,随着蔗糖浓度的升高LOX的活性逐渐升高,蔗糖为4%时LOX活性为32.7 U·g-1,极显著高于对照(3%)(P<0.01),当蔗糖浓度为1%和5%时,其活性分别仅为18.1和22.4 U·g-1,这说明蔗糖浓度对LOX影响较大,但是高浓度的碳源会抑制植株的生长,并且使叶片较小(图1)。当NO3--N/NH4+-N比例为0∶1时LOX活性达到最大,为33.19 U·g-1,但由于缺乏氨态氮,植株出现叶片发黄,茎段较细,生长慢等现象,比例为2∶1(对照)时LOX活性较高,酶活达30.99 U·g-1,并且此时植株生长最旺盛。
2.2前体调控 添加前体物质会影响LOX的活性,添加0.6 mmol·L-1苯丙氨酸诱导百里香植株时,LOX活性达到峰值,为对照组的138.9%,而添加0.4 mmol·L-1谷氨酸诱导百里香植株时,LOX活性达到峰值,为对照组的116.4%。高浓度的谷氨酸会抑制LOX活性,添加1.0 mmol·L-1谷氨酸时,LOX活性为对照的86.8%,添加丙酮酸对LOX活性基本没有影响(图2)。
2.3外源处理因素调控
2.3.1茉莉酸甲酯诱导 不同浓度的茉莉酸甲酯处理后,3个发育阶段百里香植株LOX活性的变化存在显著差异(P<0.05)(图3)。20 d的植株经1.0 mmol·L-1MeJA诱导后,LOX的活性显著增加,48 h时达到峰值,为对照组的655.4%。30 d和40 d的植株经0.5 mmol·L-1MeJA诱导后48 h达到峰值,分别为对照组的688.1%和456.1%,48 h后缓慢下降。可见,茉莉酸甲酯对不同年龄百里香再生植株中LOX活性的诱导存在最佳浓度和最佳时间。
2.3.2水杨酸诱导 不同浓度的水杨酸(SA)处理后,3个发育阶段百里香植株LOX活性的变化有显著差异(图4)。经150 mg·L-1SA诱导12 h时LOX活性显著增加,达到峰值,20 d的植株诱导后为对照组的503.8%。30 d的植株诱导后为对照组的383.8%,48 h后下降。40 d的植株经SA诱导后,LOX活性增加缓慢,诱导效果不明显。水杨酸对百里香中LOX活性的影响存在最佳诱导浓度和诱导时间。
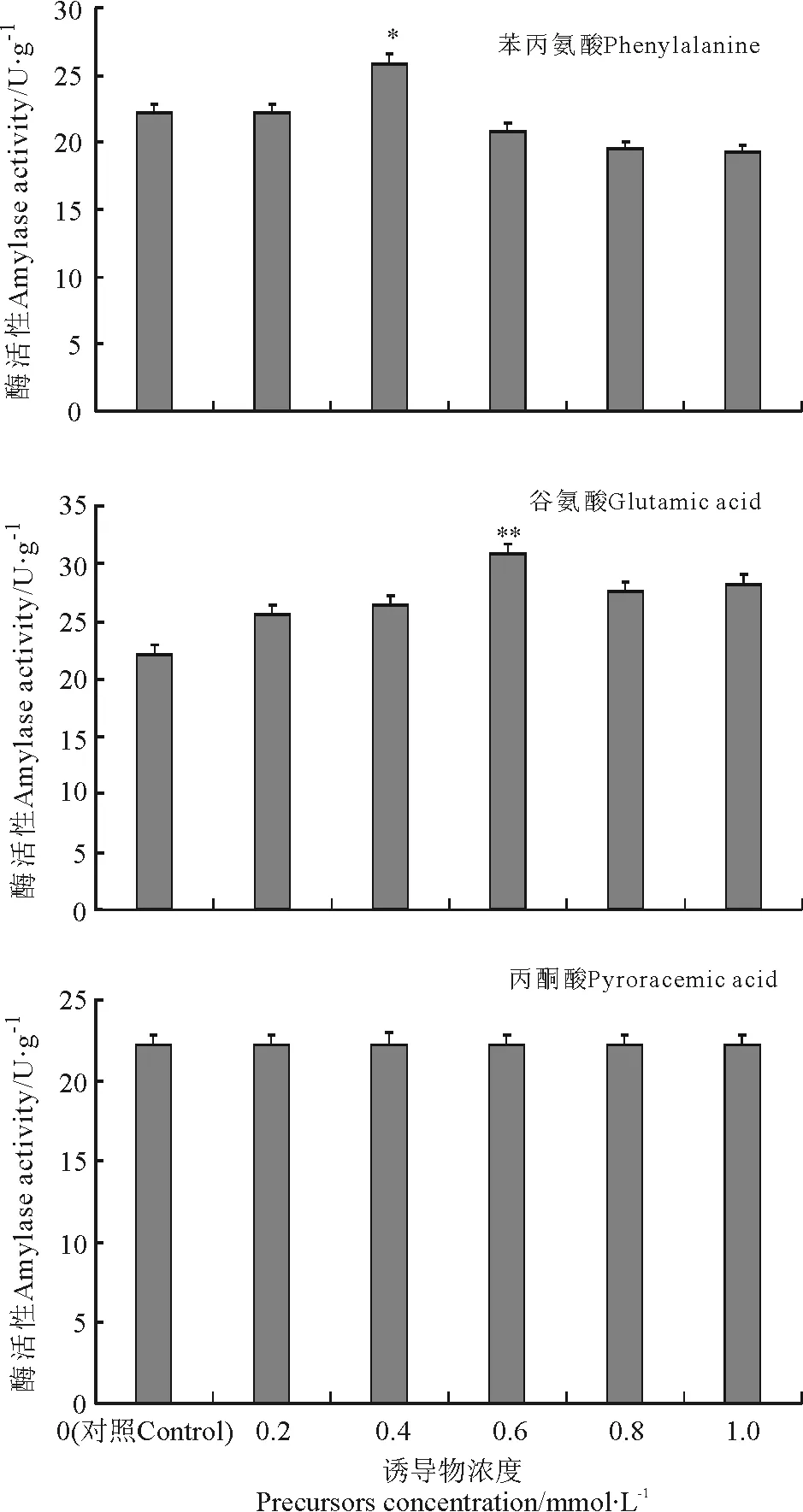
图2 不同浓度的前体诱导物对对百里香再生植株内LOX影响Fig.2 Effects of different precursors on LOX activity in leaves of Thymus vulgaris
2.3.3壳聚糖诱导 采用不同浓度的壳聚糖(Chitosan)处理后,3个发育阶段百里香植株LOX活性的变化存在显著差异(图5)。经200 mg·L-1壳聚糖诱导后,LOX的活性显著增加,24 h时达到峰值,20和30 d的植株LOX的活性分别为对照组的429.1%和360.8%,72 h后急速下降,120 h酶活性减少。40 d的植株经200 mg·L-1壳聚糖诱导后,LOX活性增加缓慢,并在处理72 h时达到峰值,为对照组的379.5%。壳聚糖对百里香中LOX活性的影响存在最佳诱导浓度和诱导时间。
3 讨论
植物在外源处理因素的作用下会做出一系列的抗逆反应,引起植物体内抗逆信号分子以及诱导抗性蛋白的合成,进而引起一系列抗胁迫反应[10]。本研究分析了不同处理因素对不同生长阶段百里香植株中挥发性物质合成途径中关键酶LOX活性的影响。

图3 茉莉酸甲酯诱导对20、30和40 d百里香再生植株内脂氧合酶活性的影响Fig.3 Effects of MeJA on LOX activity in leaves of Thymus vulgaris cultured for 20, 30 and 40 d
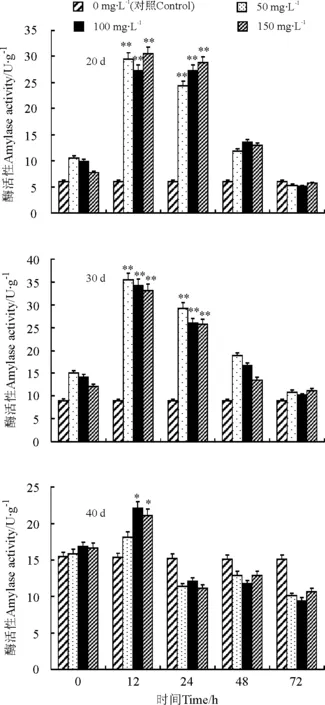
图4 水杨酸诱导对20、30和40 d百里香再生植株内脂氧合酶活性的影响Fig.4 Effects of SA on LOX activity in leaves of Thymus vulgaris cultured for 20, 30 and 40 d
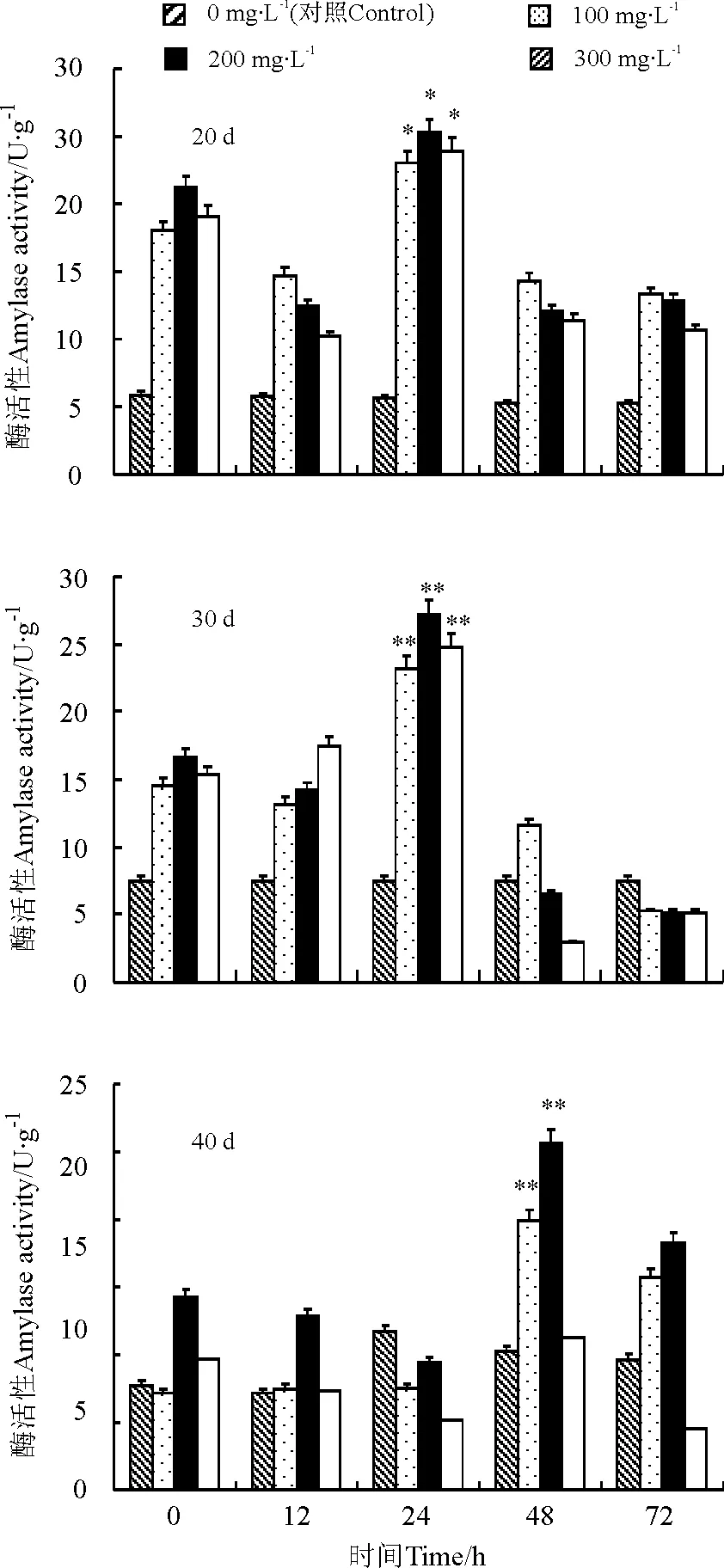
图5 壳聚糖诱导对20、30和 40 d百里香再生植株内脂氧合酶活性的影响Fig.5 Effects of chitosan on LOX activity in leaves of Thymus vulgaris cultured for 20, 30 and 40 d
糖是植物生长过程中不可缺少的碳源,其种类和浓度对培养物的生长起着重要作用[11]。本试验是在1/2 MS培养基上,以3%为对照组,改变不同的碳源的浓度,培养30 d后,测定LOX活性,当蔗糖浓度为4%时,能量充足,酶活性达到最高,但由于过高的渗透压对植物的生长有抑制作用, 蔗糖浓度为3%时,酶活较高,生长状态最好,达到适宜配比,此结果与已有研究结论相一致。氮源是细胞中核酸的组成成分,植物在生长过程中不可或缺,其种类和浓度对植物生长影响也非常显著[12]。氮源调控结果表明,在百里香生长和LOX活性调控中氮源起到一定的作用,缺乏硝态氮和氨态氮都会影响植物生长以及LOX活性,在调控中硝态氮起主要作用,比例为0∶1的NO3--N/NH4+-N时LOX活性达到最大,但缺乏硝态氮时植株发育不良且生长缓慢。有研究证明其可能原因是培养基中NH4+量太高导致培养基酸化[13],细胞毒性增加,抑制植物生长。当NO3--N/NH4+-N比例为2∶1时,获得百里香最佳生长状态和LOX活性最高的最佳配比,说明前诱导物碳源和氮源的改变能够调节百里香挥发性物质产生过程中关键酶LOX的活性,碳源和氮源可改变百里香中挥发性物质的产生。
有研究报道,在培养基中添加氨基酸能够被植物吸收,与无机氮共存时也能被植物所利用,且不同种类的氨基酸表现出不同的生理效应,被吸收后能在植物体内运转、分配,其代谢的机制有一定的差异[14]。在培养基中添加已知或假定的前体氨基酸,能消除关键酶阻碍或阻断内源性中间体的分隔[15]。在三尖杉(Cephalotaxusfortunei)悬浮细胞培养过程中,添加前体物质酪氨酸和苯丙氨酸也不同程度地提高了三尖杉酯碱的含量[16]。本研究通过在特定培养基上加入苯丙氨酸、谷氨酸、丙酮酸后发现,前两种前体物质均在一定程度上提高了百里香植株中的LOX活性,而丙酮酸对LOX活性影响效果不明显。李彩凤等[17]研究证明LOX活性部位基团和芳香族氨基酸残基等有关。此结果与已有其他科植物的部分研究结果一致,但对百里香中的研究尚无报道。
外源诱导物能够改变植物次生代谢途径中酶活性或活化次生代谢途径中特定的酶,然后诱导新酶的形成,引起次生代谢途径的代谢途径和生化反应速率的改变[18]。植物体内存在一类外源大分子物质,其可以激发植物的抗病防御反应,这类大分子物质能诱导与植物防御反应相关的结构或生物化学反应[19]。本研究对不同生长阶段的百里香使用外源茉莉酸甲酯、水杨酸和壳聚糖进行处理。茉莉酸及其甲酯广泛存在于高等植物体内,它是由亚麻酸经脂氧合酶、丙二烯氧化物合成酶等一系列酶促反应而生成[20]。SA是植物体内产生的一种酚类化合物,也是植物组织中一种天然活性物质,它作为一种信号分子对一些重要的代谢过程起调控作用[21]。前人研究发现壳聚糖也可以提高作物对病原菌的抗性[22]。这3种外源诱导因素均能改变百里香中挥发性物质合成的关键酶LOX活性,并且外源处理因素存在最佳诱导浓度和诱导时间。试验结果表明不同处理因素在不同浓度和时间条件下LOX的活性不同,该结论为外源处理因素诱导百里香挥发性物质的合成和积累提供了一定的试验依据,同时也为研究百里香抗逆反应的机理提供了一定的依据。
Rangel等[23]研究发现,诱导物质如茉莉酸甲酯等对LOX活性有一定的影响。本研究通过对不同生长阶段百里香植株进行诱导处理后也得到类似结论,此结论为揭示该类植物的抗逆生理机制以及诱导次生代谢产物合成过程中关键酶活性的提高提供了一定的理论依据,进而为诱导处理因子对植物调控机理方面的研究奠定了一定基础。
[1] 张继,田玉汝,刘忠旺.百里香属植物研究进展[J].北方园艺,2010(1):226-228.
[2] 贾红丽,计巧灵,张丕鸿.新疆拟百里香挥发油的气相色谱-质谱分析[J].质谱学报,2008,29(1):36-41.
[3] Penuelas J,Llusia J.PVOCs:Plant defense against climatic warming[J].Trends in Plant Science,2003(8):105-109.
[4] Blee E.Impact of phyto oxylipins in plant defense[J].Trends in Plant Science,2002(7):315-321.
[5] Minke A N,Gerrit A V.Johannes F G V.Fatty acid hydroperoxide lyase: A plant cyto-chro-me P450 enzyme involved in wound healing and pest resistance[J].Chembiochem,2001,32(7):494-504.
[6] Gardner W H.Biological roles and biochem is try of the lipoxygenase pathway[J].Hortscience,1995,30(2):197-205.
[7] 陈惠萍,徐朗莱.壳聚糖调节植物生长发育及诱发植物抗病性研究进展[J].云南植物研究,2005,27(6):613-619.
[8] 杨宁,李翠霞,李志忠,等.诱导子对百里香再生植株中苯丙氨酸解氨酶活性的影响[J].西北植物学报,2012,32(2):0330-0335.
[9] Axelrod B,Cheesbrough T M,Leakso S.Lipoxygenase from soybeans[J].Methods in Enzymology,1981(7):443-451.
[10] 梅伏生,孟祥高,赵显珍,等.脂氧合酶——植物抗胁迫响应的关键酶[J].华中师范大学学报(自然科学版),2005,39(3):346-350.
[11] 董诚明,苏秀红,王伟丽.氮碳源对冬凌草再生植株生长及次生代谢产物的影响[J].西北植物学报,2009,29(3):494-498.
[12] 高增平,江佩,芬何斌.野生石蒜与其组织培养品的化学成分对比研究[J].北京中医药大学学报,1995,18(3):60-64.
[13] 郭肖红,高文远,李克峰.丹参不定根组织培养的研究(Ⅱ)碳源、氮源和磷源对丹参不定根培养的影响[J].中草药,2007,35(6):907-911.
[14] 马林.植物对氨基酸的吸收和利用[J].西南科技大学学报,2004,19(1):102-107.
[15] 方唯硕.植物组织培养的应用与局限性[J].国外医药——植物药分册,1995,10(5):213-217.
[16] Dlxon R A.Natural products and plant disease resistance[J].Nature,2001(41):843-847.
[17] 李彩凤,赵丽影,陈业婷,等.高等植物脂氧合酶研究进展[J].东北农业大学学报,2010,41(10):143-149.
[18] Bi J L,Murphy J B,Felton G W.Antinutritive and oxidative components as mechanisms of induce in cotton to helicoverpa zea[J].Journal of Chemical Ecology,1997,23(1):97-117.
[19] 赵红莲,于荣敏.诱导子在植物细胞培养中应用研究进展[J].沈阳药科大学学报,2000,17(2):152-156.
[20] 蔡昆争,董桃杏,徐涛.茉莉酸类物质(JAs)的生理特性及其在逆境胁迫中的抗性作用[J].生态环境,2006,15(2):397-404.
[21] 郑伟尉,臧运祥.水杨酸(SA)与植物抗病性关系的研究进展[J].河北果树,2005(1):1-2.
[22] 宋满坡,段晓琴.壳聚糖对黄瓜常见病原菌的抑制效应[J].江苏农业科学,2007(1):61-67.
[23] Rangel M,Machado O L,da Cunha M,etal.Accumulation of chloroplast-targeted lipoxygenase in passon fruit leaves in response to methyl jasmonate [J].Phytochemistry,2002,60:6219-6251.
