响应面优化百里香多糖提取工艺及其抗氧化作用
2019-08-26王娣李雨晴程柏李妍曹珂珂
王娣,李雨晴,程柏,李妍,曹珂珂
(蚌埠学院 食品与生物工程学院,安徽 蚌埠 233030)
百里香是由国际标准组织公布的香辛料之一,广泛分布于非洲北部、欧洲及亚洲温带,百里香属唇形科植物,有很强的芳香气味,有消炎、防腐等作用[1]。全世界百里香属植物大约有300~400种,我国百里香属植物主要分布于西北,资源较为丰富[2]。百里香中含有丰富的活性成分,例如黄酮、多酚和多糖等,具有一定开发前景[3]。植物多糖具有生物活性,具体包括免疫调节、抗肿瘤、降血糖、降血脂等保健作用,越来越受到专家的关注[4-9]。本文采用超声波辅助碱水法从百里香全草中提取多糖,以提取pH、料液比、提取时间为影响因素,进行响应面优化试验,并对提取的多糖进行抗氧化活性研究,以期为我国百里香资源的进一步开发利用提供一定参考依据。
1 材料与方法
1.1 材料
百里香全草(Thymusmongolicus):购于陕西省吴起县,自然风干,置于阴凉干燥处避光储存备用。
1.2 试剂
葡萄糖标准品、Vc标准品:购自国药集团化学试剂有限公司;H2SO4、NaH2PO4、Na2HPO4、C2H5OH、H2O2、FeSO4、C7H6O3等:均为分析纯,购自天津市永大化学试剂有限公司。
1.3 试验仪器
LD-T300A高速万能粉碎机 上海顶帅电器有限公司;SK-1漩涡振荡器 金坛市白塔新宝仪器厂;KDC-160HR高速冷冻离心机 安徽中科中佳科学仪器有限公司;SB-3200DTD超声波清洗机 宁波新芝生物科技股份有限公司;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;XMA-600电热鼓风干燥箱 余姚市亚泰仪表有限公司。
1.4 试验方法
1.4.1 百里香的预处理
百里香干燥粉碎后过60目筛,脱脂后于棕色瓶中低温保存备用。
1.4.2 多糖测定方法
采用苯酚-硫酸法,以葡萄糖为标准品来计算多糖的提取率。
1.4.3 葡萄糖标准曲线的绘制
1 mg/mL葡萄糖标准液的制备:先将葡萄糖在60 ℃的条件下干燥至恒重,然后精确称取葡萄糖0.100 g,加超纯水溶解于100 mL的容量瓶中,定容,摇匀。分别吸取0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mL标准液于10 mL容量瓶中,用超纯水定容,摇匀。吸取1.0 mL不同浓度的葡萄糖溶液置于试管中,加入80%苯酚溶液50 μL,然后加入5 mL的浓硫酸溶液,混匀后静置5 min,以超纯水作为对照,在490 nm处下测定反应液吸光度,每个样品平行试验3次,取平均值,并且用葡萄糖浓度为横坐标,吸光度为纵坐标,绘制出标准曲线。
1.4.4 百里香多糖的提取方法
称取一定量的百里香,超声波300 W,50 ℃恒定条件下,在一定pH下提取一定时间,4000 r/min下离心10 min,得上清液,用苯酚-硫酸法检测百里香多糖的提取率。
1.4.5 单因素试验
1.4.5.1 提取时间对百里香多糖提取率的影响
称取0.50 g百里香5份,加入20.0 mL超纯水,用缓冲溶液调pH为10.0。在超声波300 W、50 ℃恒定条件下提取5,10,15,20,25 min,4000 r/min下离心10 min,检测得到百里香多糖的提取率。
1.4.5.2 料液比对百里香多糖提取率的影响
称取0.50 g百里香5份,分别加入10,15,20,25,30 mL超纯水,用缓冲溶液调pH为10.0。在超声波300 W、50 ℃恒定条件下提取10 min,4000 r/min离心10 min,检测得到百里香多糖的提取率。
1.4.5.3 pH对百里香多糖提取率的影响
称取0.50 g百里香5份,按照1∶40的料液比,用缓冲溶液调pH为10.0,11.0,12.0,13.0,14.0。在超声波300 W、50 ℃恒定条件下提取10 min,4000 r/min下离心10 min,检测得到百里香多糖的提取率。
1.4.6 响应面优化试验
以提取液中百里香酚的含量作为考察指标进行分析,试验因素及水平编码见2.3.1中表1。以提取pH、料液比、时间为考察因素,选取合适的因素水平,采用Box-Behnken设计四因素三水平回归试验,使用Design Expert 8.0软件进行响应面优化试验设计及结果分析。
1.4.7 百里香多糖的抗氧化作用研究
1.4.7.1 百里香多糖纯化
将百里香多糖提取液加入50%乙醇,4 ℃静置12 h,抽滤,取滤液,再加入70%乙醇,放置于冰箱中,4 ℃静置12 h,抽滤,取滤液,用丙酮与滤液(4∶1)充分震荡,静置,取下层液,浓缩后冷冻干燥,得纯化多糖[10]。
1.4.7.2 清除DPPH自由基能力的测定[11,12]
将纯化后的百里香多糖,配制成质量浓度分别为0.20,0.40,0.60,0.80,1.00,1.20 mg/mL的百里香多糖溶液后,分别取2 mL上述浓度的多糖溶液放入6支试管中,再分别加入2.0 mL质量浓度为0.2 mmol/L DPPH溶液,避光静置30 min后,在517 nm处测得其吸光度数值,用Vc作为对照。DPPH自由基的清除率计算公式为:
清除率=[1-(A2-A1)/A0]×100%。
式中:A0为未加样品时DPPH溶液的吸光值;A1为样品溶液的吸光值;A2为加入样品后DPPH溶液的吸光值。
1.4.7.3 清除OH自由基能力的测定[13,14]
将超声波提取的百里香多糖冷冻干燥成粉状,配制成质量浓度分别为1,2,3,4,5,6,8,10 mg/mL的百里香多糖溶液,分别加入9 mmol/L FeSO4和9 mmol/L 乙醇-水杨酸,加入适量的超纯水,最后加入8 mmol/L H2O2后混匀,在510 nm下测定其吸光度,用Vc作为对照。OH自由基清除率计算公式为:
清除率=[A0-(AX-AX0)]/A0×100%。
式中:A0为空白对照的吸光度数值,AX为加样品的吸光度数值,AX0为不加H2O2的吸光度数值。
2 试验结果与分析
2.1 苯酚-硫酸法标准曲线
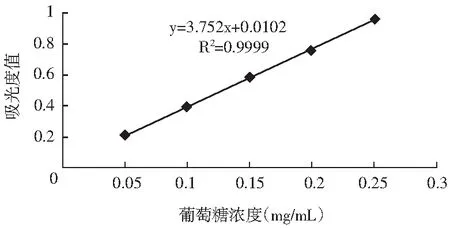
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
由图1可知,标准曲线方程为y=3.752x+0.0102(R2=0.9999),在0.05~0.25 mg/mL范围内时,葡萄糖浓度与吸光度呈现出良好的线性关系。
2.2 百里香多糖提取单因素试验结果
2.2.1 提取时间对百里香多糖提取率的影响
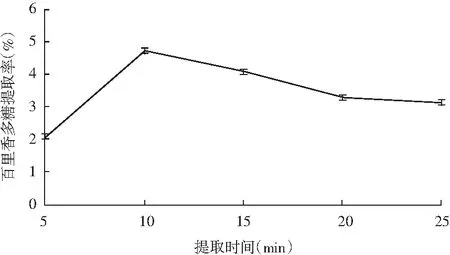
图2 提取时间对百里香多糖提取率的影响Fig.2 Effect of extraction time on the extracion rate of thyme polysaccharides
由图2可知,百里香多糖提取率随提取时间的增加先上升再下降,当提取时间在10 min时,百里香多糖的提取率最大,10 min后,百里香多糖的提取率开始明显下降,可能是提取时间过长破坏了产物的结构。综合考虑,提取时间10 min为最适提取时间。
2.2.2 料液比对百里香多糖提取率的影响
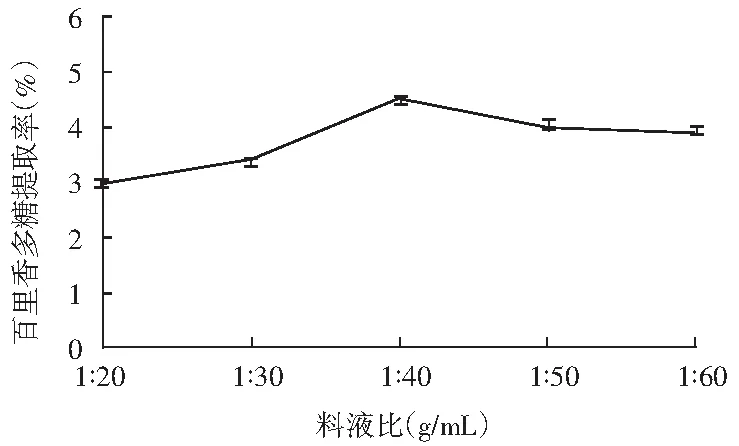
图3 料液比对百里香多糖提取率的影响Fig.3 Effect of ratio of solid to liquid on the extraction rate of thyme polysaccharides
由图3可知,料液比由1∶20增至1∶40时,多糖提取率逐渐增加,随后随着料液比再增加,百里香多糖的提取率反而开始下降。综合考虑,百里香多糖提取料液比为1∶40时最适宜。
2.2.3 pH对百里香多糖提取率的影响
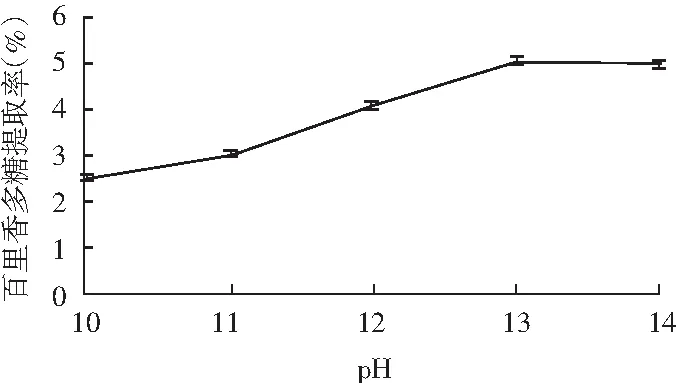
图4 pH对百里香多糖提取率的影响Fig.4 Effect of pH on the extraction rate of thyme polysaccharides
由图4可知,随着pH的不断增大,百里香多糖的提取率不断升高并逐渐趋于平稳,综合考虑,选择pH 13为百里香多糖提取的最适pH。
2.3 响应面优化试验结果分析
2.3.1 响应面优化分析
试验设计因素编码、水平及结果见表1。

表1 响应面试验因素水平Table 1 Factors and levels of response surface experiment
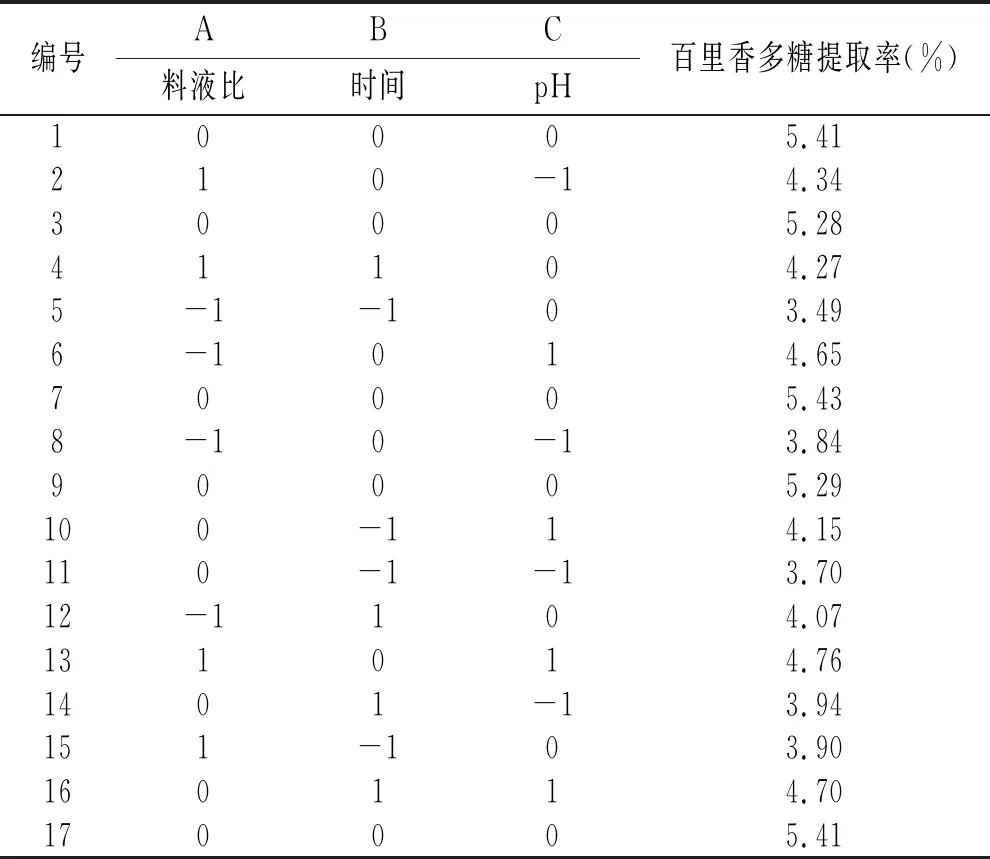
表2 Box-Behnken试验设计与结果Table 2 Design and results of Box-Behnken test
注:表中百里香酚提取率为均值(N=3)。

表3 方差分析Table 3 Analysis of variance
以百里香多糖提取率为考察指标,提取时间、料液比、pH为自变量,回归拟合后得到多糖提取率的回归方程式模型为:Y=5.36+0.15A+0.22B+0.31C-0.58A2-0.85B2-0.39C2-0.053AB-0.09AC+0.077BC。
由表3方差分析可知模型的P<0.0001,表明该模型方差极显著。实验结果显示提取时间、提取pH对百里香多糖提取的影响极显著,料液比的影响显著,二次项A2、B2、C2是极显著的,R2=99.21%表明回归方程能较好地描述各单因素与响应值之间的关系。根据二次回归方程的系数绝对值的大小C>B>A,可判断3个因素对多糖提取率的影响大小为:pH对百里香多糖提取率的影响效果最为显著,然后依次为提取时间、料液比。通过软件分析得到超声提取百里香多糖的最佳工艺条件:提取时间为10.5 min,料液比为1∶40.8,pH为13.4,提取率为5.45%。
2.3.2 三维曲面图
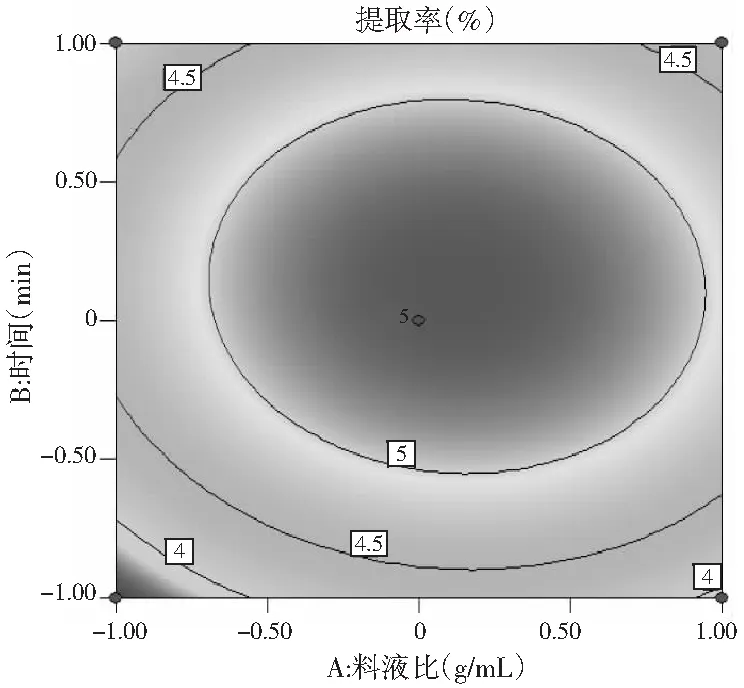
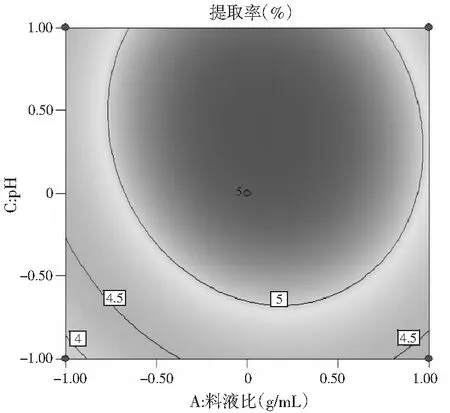
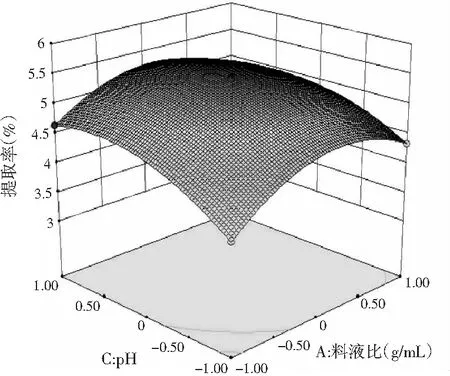
响应面图能直观地反映出各个因素间的交互作用,通过多元回归方程做响应面图,见图5。

A料液比与时间
B料液比与pH
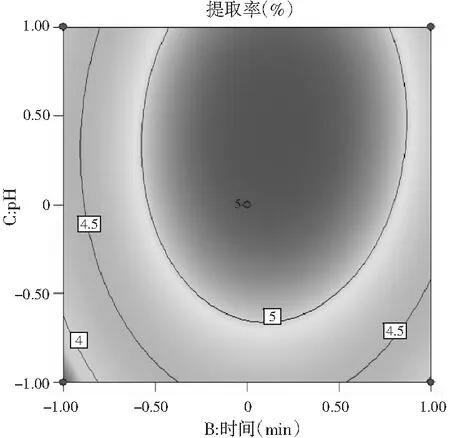
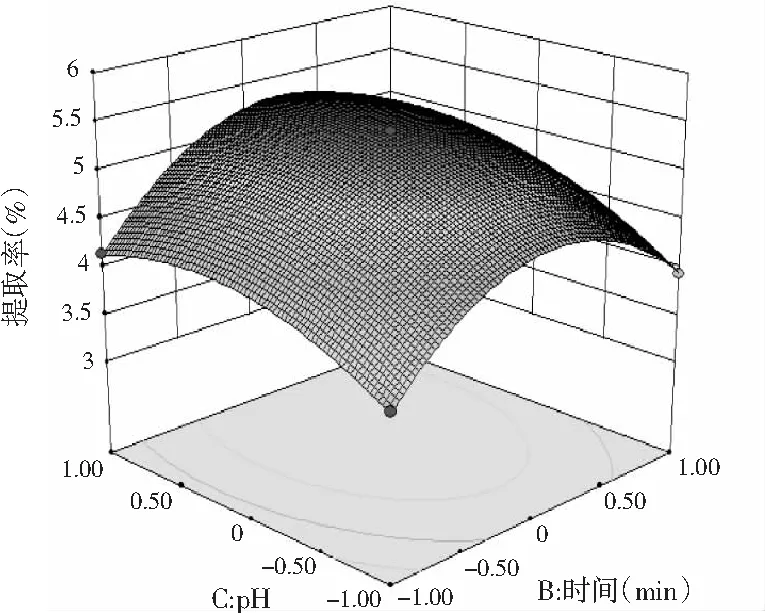
C时间与pH
由图5可知,3个响应曲面均为开口向下的凸形曲面,同时等高线最小椭圆的中心在所选的-1~1范围内,说明响应值(百里香多糖提取率)在3个因素设计的范围内存在最大值。由图5A可知,在一定的提取时间内,百里香多糖提取率随着料液比的增大而增大,但达到一定程度后,多糖提取率呈现下降趋势。由图5B可知,多糖的提取率随着pH和料液比的增加先增大后减少。由图5C可知,多糖提取率随着pH与提取时间的增加先增加后减少。由图5B和图5C等高线可以看出,等高线的椭圆形较明显,从而证明了料液比与pH、提取时间与pH这两组因素的交互作用显著。
2.3.3 响应面优化结论验证
由响应面法分析得到的百里香多糖提取的最佳工艺条件:提取时间为10.5 min,料液比为1∶40.8,pH为13.4,在该条件下进行验证试验,平行3次,最终得率为5.45%。
2.4 百里香多糖抗氧化作用的结果与分析
2.4.1 清除DPPH自由基能力的测定
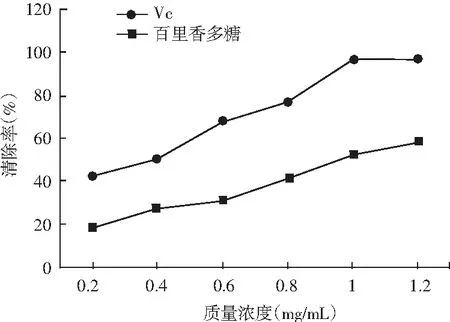
图6 百里香多糖对DPPH自由基的清除作用Fig.6 Scavenging effect of thyme polysaccharides on DPPH free radicals
由图6可知,随着百里香多糖浓度的增加,对DPPH自由基的清除率不断提高,当百里香多糖的浓度为1.2 mg/mL时达到了最高值58%,但是与Vc的DPPH清除能力比较略低。
2.4.2 百里香多糖对OH自由基的清除作用
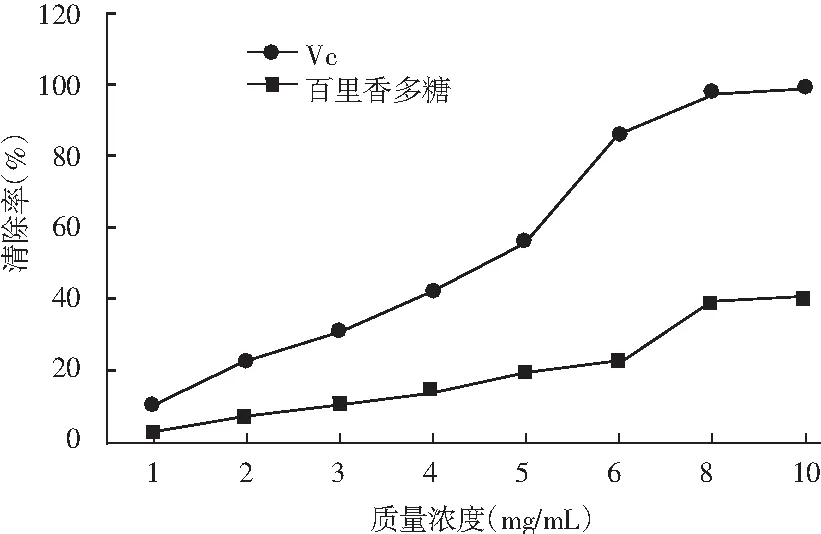
图7 百里香多糖对OH自由基的清除作用Fig.7 Scavenging effect of thyme polysaccharides on OH free radicals
由图7可知,随着百里香多糖浓度的增加,对羟基自由基的清除能力稳定增强,当百里香多糖浓度超过8.0 mg/mL后,对羟基自由基的清除能力趋于稳定。百里香多糖的浓度为10 mg/mL时,清除率最高,为39.74%。相比等量Vc的OH自由基清除能力,比百里香多糖对羟基自由基的清除能力高。
3 结论
采用超声波辅助碱水提取百里香多糖过程中,pH对百里香多糖提取率的影响效果最为显著,然后依次为提取时间、料液比。响应面优化得知百里香多糖最佳的提取工艺条件:提取时间为10.5 min,料液比为1∶40.8,pH为13.4,百里香多糖的提取率为5.45%;抗氧化试验结果表明百里香多糖具有一定的抗氧化活性,试验结果表明,百里香多糖的浓度为1.2 mg/mL时,对DPPH自由基的清除率为58%;百里香多糖的浓度为10 mg/mL时,对OH自由基的清除率为39.74%,但与等浓度Vc相比抗氧化作用略低,有待进一步研究。
