反复自然流产患者妊娠组织中Survivin、VEGF及Stat3的表达及相关性
2012-03-06张素芝杜丽荣韩宏伟李国正韩省华刘效群赵邦荣张亦心
张素芝 杜丽荣 韩宏伟 李国正 韩省华 刘效群 赵邦荣 张亦心
反复自然流产(recurrent spontaneous abortion,RSA)是指连续发生2次或2次以上的自然流产。其病因复杂,在发病患者中有60%~70%是不明原因的。滋养细胞的分化、浸润行为十分复杂,但调节极为精细,时间仅限于早孕期,滋养细胞具有与肿瘤细胞相似的浸润性生长的生物学特性,早孕期滋养细胞迅速增生并侵蚀子宫内膜。生存素(Survivin)是一类结构独特的哺乳类动物凋亡抑制蛋白,具有抑制细胞凋亡和调节细胞有丝分裂的双重功能,可表达于大多数肿瘤组织及多种转化细胞。近来研究发现,Survivin基因的上游启动片段中存在信号传导子和转录活化子3(STAT3)的反应元件,STAT3可能从上位调节Survivin的表达[1];而血管内皮生长因子(VEGF)亦可以通过激活Akt/PKB信号途径,提高Survivin基因在细胞中的表达。本研究从滋养层细胞浸润能力的调控角度,探讨RSA患者孕早期妊娠组织中Survivin、VEGF及Stat3的表达及可能调控途径。
1 资料与方法
1.1 一般资料 选择2007年1至6月石家庄市妇幼保健院妇科门诊就诊的20~35岁RSA患者40例(RSA组)。病例选择条件:发生过2次或2次以上自然流产;孕周12周;流产前B超证实胚胎停育;夫妇外周染色体核型正常,无家族遗传病史;血三碘甲状腺原氨酸(T3)、甲状腺素(T4)和促甲状腺激素(TSH)检查无甲状腺功能异常、黄体功能不全、多囊卵巢综合症、高泌乳素血症等内分泌疾病;排除子宫畸形、Rh血型不合及TORCH(弓形虫抗体、风疹病毒抗体、巨细胞病毒抗体、柯萨奇病毒抗体和生殖器疱疹病毒抗体)检测异常。同期随机选择无不良孕产史,有正常足月分娩史或无生育史的正常同年龄段、孕周相同要求人工流产的正常早孕女性20例做对照(对照组)。
1.2 研究方法
1.2.1 主要试剂与仪器:兔抗人VEGF单克隆抗体、兔抗人Survivin多克隆抗体(北京中杉金桥生物技术有限公司),TNF-α酶联免疫分析(ELISA)试剂盒(北京博奥森生物公司),联苯二胺(DAB)底物显色试剂盒(北京中杉金桥生物技术有限公司)。流式细胞仪Epics-XLⅡ型(Beckman Coulter,美国),全自动酶联免疫检测仪Bio-Rad 255型(Bio-Rad,美国)。
1.2.2 组织免疫化学(SP法):10%甲醛溶液固定,石蜡包埋,切片厚4 μm,经逐级酒精水化至蒸馏水,微波抗原修复,磷酸盐缓冲液(PBS)洗,3%过氧化氢孵育5 min阻断内源性过氧化酶,加正常羊血清封闭后,滴加一抗,37℃孵育1 h,PBS洗涤3次,每次3 min,加生物素标记的抗兔IgG,37℃10 min,PBS洗涤3次,每次3 min,加辣根过氧化物酶标记的链霉素卵白素,37℃10 min,PBS洗涤3次,每次3 min,DAB显色,苏木素淡复染,封片。阳性对照Survivin为人胃癌组织,VEGF为人结肠癌组织,PBS代替一抗作为阴性对照。在光镜下观测结果。
1.2.3 结果判定:细胞中出现棕黄色颗粒者为阳性细胞。根据阳性细胞显色强度分级为阴性(0分)、黄色为弱阳性(1分)、棕黄色为阳性(2分)、深棕黄色为强阳性(3分)。然后,应用Image-Pro Plus多功能真彩色细胞图象分析管理系统(Media Cybernetics,美国)进行图象分析,每张切片随机选取5个视野,观察高倍视野中的所有细胞,记录阳性染色细胞百分数,0%~1%记0分,2%~10%记1分、11%~50%记2分、51%~80%记3分、81%~100%记4分。将细胞显色强度和阳性染色细胞百分数计分相乘得免疫组织化学积分(IHS)值[2]。
1.3 统计学分析 应用SPSS 16.0统计软件分析,计数资料采用秩和检验,两因素间的相关性采用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
VEGF仅在绒毛膜滋养层细胞和蜕膜细胞的胞质中有表达;Survivin、Stat3在绒毛膜滋养层细胞和蜕膜细胞的胞质及胞核中均有表达。RSA患者绒毛组织中Survivin、VEGF的表达水平高于对照组(P<0.05),二者在绒毛中的表达呈正相关(r=0.268,P<0.05);RSA组与对照组的绒毛中Stat3的表达差异无统计学意义(P>0.05),绒毛中Survivin与Stat3的表达不存在相关关系(r=-0.006,P>0.05);RSA组与对照组蜕膜中Survivin、VEGF和 Stat3的表达差异无统计学意义(P>0.05)。见表1~6。

表1 2组Survivin绒毛中的表达 例

表2 VEGF在RSA组与对照组的绒毛中的表达 例
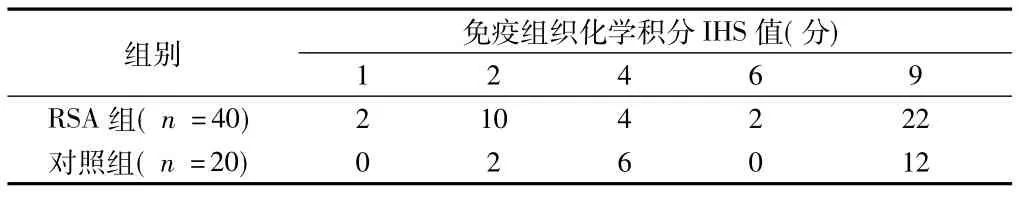
表3 Stat3在RSA组与对照组的绒毛中的表达 例

表4 Survivin在RSA组与对照组的蜕膜中的表达 例

表5 VEGF在RSA组与对照组的蜕膜中的表达 例

表6 Stat3在RSA组与对照组的蜕膜中的表达 例
3 讨论
在胚胎植入和胎盘形成的过程中,滋养细胞生长与浸润、胎盘与子宫内膜血管的构建以及胎盘浸润蜕膜组织的行为与肿瘤组织的浸润性生长过程相似。滋养细胞具有高度增殖和浸润性生长的潜能;但在正常妊娠过程中,滋养细胞不发生过度增殖和远处转移,提示可能受到细胞直接或间接分子调控作用,使滋养细胞浸润性生长的能力维持生理性动态平衡。母-胎界面滋养细胞浸润能力在分子水平的调控可以影响胚泡正常的植入和生长。正常妊娠时胎盘形成后滋养细胞即停止侵入,如滋养细胞继续浸润则将形成滋养细胞肿瘤。滋养细胞通过其自身和子宫胎盘单位产生的生长因子、激素等进行着精确的调控,使其侵袭具有严格的时间性和空间性,限制于孕早期及子宫壁的1/3处。
Survivin在大多数肿瘤组织及多种具有分化潜能的细胞中表达。近来研究发现,人及其他哺乳类动物胚胎组织、造血干细胞、分泌期子宫内膜、早期绒毛以及蜕膜等增殖活跃的组织均有Survivin表达[2],其他的已分化组织一般不表达或弱表达。Survivin基因的表达对于生物体早期胚胎发育起着十分重要的作用,抑制处于胚胎发育早期的Survivin基因的表达,往往造成生物体畸形发育。Fest等[3]发现Survivin在促进滋养细胞生长、浸润和胎盘形成的过程中起重要作用。冯苗等[4]发现,Survivin在正常早孕绒毛组、葡萄胎组、侵蚀性葡萄胎组、绒癌组的表达由弱至强。在早期妊娠绒毛及葡萄胎滋养层中,Survivin在细胞核中表达水平高于细胞浆;而在侵蚀性葡萄胎、绒癌滋养细胞中,Survivin在细胞浆及细胞核表达水平相同;说明Survivin的过度表达势必产生异常的抗凋亡作用,从而增强滋养细胞的侵蚀性。随着Survivin表达水平的增加,妊娠滋养细胞从正常发展为可控的良性肿瘤,再由良性向不可控的恶性肿瘤转化。孟海云等[5]也发现Survivin在不同类型滋养细胞中均有表达,并随着滋养细胞恶性程度的增加,染色程度显著升高。
许多细胞因子均可诱导Survivin基因的表达。VEGF、血管生成素1可以通过激活Akt/PKB信号途径,提高Survivin基因在细胞中的表达,从而在血管生成过程中抑制细胞凋亡,维持血管内皮细胞的存活。近来大量实验研究表明在肿瘤的发生、发展、浸润和转移的过程中VEGF与Survivin起着关键性的作用,二者的表达相关。VEGF在受精卵着床过程中发挥重要作用,并参与整个妊娠期间胎盘生长过程中的血管形成,妊娠后胎盘组织VEGFmRNA表达与外周血中VEGF水平均有明显上升[6]。Ma ACh等[7]在研究斑马鱼胚胎发育时发现,注射人VEGF蛋白可使Survivin的表达增加,而应用VEGF受体抑制因子能明显减少血管生成和抑制Survivin的表达。
但也有一些研究发现,Survivin基因的上游启动片段中存在Stat3的反应元件,阻断Stat3信号将会抑制Survivin的表达,诱导细胞凋亡。有研究表明白细胞介素-11(IL-11)可以通过激活转录信号转导物及激活剂3(Stat3)来促进Survivin的表达,且其mRNA水平的提高与IL-11存在剂量依赖关系[8]。Kim等[1]研究推测Stat3可能从上位调节Survivin的表达,共同作用于抑制细胞的凋亡过程;Schlette等[9]也发现Survivin是Stat3传导通路中的目的基因,Stat3基因的激活与Survivin基因的表达相关;Garcia等[10]检测了同种基因的低流产鼠、流产鼠和压力刺激流产鼠模型母-胎界面的Survivin和Stat3的表达,研究发现Survivin在流产鼠和压力鼠模型孕7.5 d时均高表达,而在正常孕鼠则为低表达;认为小鼠植入窗期母-胎界面Survivin高表达而p-Stat3低表达与鼠流产相关。
23号非转移性基因H1型(nm23-H1)是经典的肿瘤细胞侵袭抑制基因。Nm23-H1在母-胎界面促进滋养细胞和蜕膜基质细胞间交叉对话及滋养细胞侵袭行为的控制机制中起重要作用。侯晓帆等[11]从mRNA和蛋白水平分析绒毛与蜕膜组织的nm23-H1表达水平发现,自然流产患者绒毛及蜕膜nm23-H1表达水平明显高于正常早孕期;认为人早孕期母-胎界面nm23-H1高表达可能导致妊娠失败。
本研究显示RSA患者绒毛滋养层细胞中Survivin、VEGF的表达水平高于正常对照组(P<0.05),二者在绒毛滋养层细胞中的表达呈正相关(P<0.05);RSA组与正常对照组的绒毛中Stat3的表达差异无统计学意义(P>0.05),Survivin与Stat3的表达不存在相关关系(r=-0.006,P>0.05)。研究发现,VEGF通过上调Survivin,参与胚胎着床、胎盘生长和浸润;而Stat3与其无相关关系,孕早期绒毛滋养层细胞中Survivin的上调可能不通过 JAK-STAT3途径。提示 Survivin和VEGF的过度表达打破了母-胎界面滋养细胞侵袭调控的动态平衡,可能导致了胚胎被机体免疫系统误认为异常增生而启动调节机制,增加肿瘤细胞侵袭抑制基因的表达,从而导致自然流产的发生,而Stat3在RSA绒毛中的正常表达,不会使滋养细胞持续过度增殖,发展为滋养细胞肿瘤。
1 Kim KW,Mutter RW,Cao C,et al.Inhibition of signal transducer and activator of transcription 3 activity results in down-regulation of Survivin following irradiation.Mol Cancer Ther,2006,5:2659-2665.
2 Fukuda S,Pelus LM.Regulation of the inhibitor-of-apoptosis family member survivin in normal cord blood and bonemarrowCD34(+)cells by hematopoietic growth factors:implication of survivin expression in normal hematopoiesis.Blood,2001,98:2091-2100.
3 Fest S,Brachwitz N,Schumacher A.Supporting the hypothesis of pregnancy as a tumor:survivin is upregulated in normal pregnant mice and participates in human trophoblast proliferation.Am J Reprod Immunol,2008,59:75-83.
4 冯苗,王自能,杨艳东.survivin(存活素)在早孕绒毛及妊娠滋养细胞疾病中的表达,暨南大学学报(医学版),2005,26:185-189.
5 孟海云,李福琴,赵琳琳,等.MMP9、存活素在妊娠滋养细胞疾病中的表达及其临床意义.哈尔滨医科大学学报,2008,42:293-295.
6 Hildebrandt VA,Babischkin J,Koos RD,et al.Developmental regulation of vascular endothelial growth/permeability factor messenger ribonucleic acid levels in and vascularization of the villous placenta during baboon pregnancy.Endocrinology,2001,142:2050-2057.
7 Ma Ach,Lin R,Chan PK,et al.The role of survivin in angiogenesis during zebrafish embryonic development.BMC Dev Biol.2007,18:50.
8 Mahboubi K,Li F,Plescia J,et al.Interleukin-11 up-regulates survivin expression in endothelial cells through a signal transducer and activator of transcription-3 pathway.Lab Invest,2001,81:327-334.
9 Schlette EJ,Medeiros LJ,Goy A,et al.Survivin expression predicts poorer prognosis in anaplastic large-cell lymphoma.J Clin Oncol,2004,22: 1682-1688.
10 Garcia MG,Tirado-Gonzalez I,Handjiski B,et al.High expression of survivin and down-regulation of Stat-3 characterize the feto-maternal interface in failing murine pregnancies during the implantation period. Placenta,2007,28:650-657.
11 侯晓帆,赵洪波,金莉萍,等.转移抑制基因nm23-H1及在母胎界面的表达.国际生殖健康/计划生育杂志,2009,28:41-43.
