转基因和基因敲除内脂素对小鼠脂肪积累的对比研究
2012-02-03关菲菲全雄志张晓娟张连峰
关菲菲,全雄志,朱 皓,高 珊,张晓娟,张连峰
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
内脂素(visfatin)是从内脏脂肪组织中分离出的一种脂肪因子[1],经基因序列比对发现该cDNA片段与前B细胞集落增强因子(pre-B cell colonyenhancing factor,PBEF)序列一致,PBEF在体内作用是协同增强干细胞因子与白介素-7(IL-7)的作用促进前B细胞形成[2];另外该蛋白还被归属为尼克酰胺磷酸核糖基转移酶(nicotinam ide phosphoribodyltransferase,Nampt)是哺乳动物体内辅酶尼克酰胺腺嘌呤二核苷酸(nicotinamid adenine dinucleotide,NAD)生物合成途径中一个重要的限速酶[3]。除内脏脂肪外,内脂素在肝脏、胰腺、肾脏、巨噬细胞、血管内皮细胞及肌肉组织等均表达,研究表明其在糖代谢、肥胖、胰岛素抵抗、代谢综合症、心血管疾病、细胞凋亡、炎症反应和癌症中都起到重要的作用[4,5]。
近年来,针对内脂素与肥胖的关系开展了很多研究,结论仍然存在分歧,甚至是相悖的[6]。Haider等[7]对83名16岁以下的单纯性肥胖儿童进行调查发现,肥胖组儿童血浆visfatin浓度显著高于正常体重儿童。Wang等[8]发现在雄性18~20周龄Lyon高血压大鼠血液中内脂素含量明显高于对照Lyon正常大鼠,且与体重、脂肪总量、甘油三酯、总胆固醇等呈正相关。Araki等人对比调查了56位肥胖的日本儿童和20位不肥胖儿童的血浆内脂素水平与皮下脂肪面积、内脏脂肪面积、甘油三酯、胰岛素等关系,发现在排除了年龄和性别因素后,内脏脂肪面积与血浆内脂素含量呈显著偏相关,血浆内脂素水平是一个很好的证明内脏肥胖的分子标记物[9]。而Pagano等[10]报道了相反的结果,在肥胖人群中血浆和脂肪组织中内脂素的表达量均低于健康人群;Krzyzanowska等[11],研究发现36名肥胖症患者通过胃减容手术减肥后1年左右血浆内脂素浓度明显上升;Rongya Tao等[12]人发现Foxo1/Foxo3/Foxo4肝脏特异性的敲除小鼠(LTKO)中,内脂素表达显著下调,而肝中甘油三酯的积累增加,出现脂肪肝,同时,还利用腺病毒载体通过小鼠尾静脉注射的方法,分别增强和下调了小鼠体内内脂素的表达量,发现相应的肝中甘油三酯的积累降低了31%和增加了38%。Ping wang等[13]比较了40位非糖尿病普通人群和35位具有家族性高血脂病的非糖尿病人群血浆中内脂素、甘油三酯、高密度胆固醇等一些生理生化指标,发现在普通人群中,血浆中visfatin含量与甘油三酯和内脏脂肪细胞面积呈负相关,在具有家族性高血脂病的人群中内脂素和甘油三酯的关系呈现相似的结果。
总之,内脂素的作用究竟是脂肪组织积聚的原因还是抑制脂肪组织增长改善胰岛素抵抗的结果,或者只是伴随心血管疾病的一种偶然现象,目前尚无定论。很多实验都是体外或者间接的证据,本研究是利用内脂素转基因和内脂素基因敲除杂合子小鼠为研究对象,探讨内脂素与脂肪积累的关系。
1 材料和方法
1.1 实验动物
内脂素转基因小鼠由本所构建[14],雌性C57BL/6J野生鼠购自中国医学科学院实验动物研究所康蓝公司(SCXK-京2004—001),SYXK(京) 2009—0003。内脂素基因敲除杂合子小鼠于2010年从日本引入本所(纯合子小鼠胚胎致死)。以上3种小鼠选取雌性在2月龄时开始饲喂高脂饲料,高脂饲料能量组成为蛋白质20%,脂肪35%,碳水化合物45%(购自康蓝公司)。本实验方案已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为ILAS-GC-2012-001。
1.2 脂肪总重量测定
9月龄时颈椎脱臼处死小鼠,小心剥离皮下脂肪和腹腔脂肪,并称重。
1.3 Westernblot鉴定内脂素蛋白的表达
内脂素蛋白的表达分析按文献进行[15],提取内脂素转基因小鼠和同月龄野生鼠以及内脂素敲除杂合子小鼠内脏脂肪总蛋白,进行SDS-PAGE凝胶电泳,蛋白转移至NC膜上(Millipore,美国),置于5%脱脂奶粉中封闭,兔抗内脂素多克隆抗体检测内脂素蛋白表达水平(BioVison,美国),辣根过氧化物酶(HRP)偶联的羊抗兔抗体结合一抗(Pierce,美国),HRP偶联的鼠抗甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体作为内参(康成生物,中国)。
1.4 MRI成像
MRI成像采用Varian公司生产的7T/160 mm孔径的小动物磁共振成像系统,将动物用2%异氟烷与氧气混合气进行麻醉,用体线圈进行采集和接收。由于腹部呼吸运动会产生伪影,采集过程中用呼吸门控控制信号的采集。本实验选择SE(自旋回波序列)T1W I分别对内脂素转基因小鼠、同月龄野生鼠和部分内脂素基因敲除小鼠行冠状位和横断位扫描,冠状位扫描参数:TR(重复时间)/TE(回波时间):230 ms/16 ms;FOV(视野):70 mm×45 mm;层厚:1 mm;层间距:1 mm;叠加次数:4;扫描矩阵:256×256;总扫描时间:3 m in 55 s。横断位扫描参数:FOV:40 mm×45 mm,其它参数同前。
1.5 小鼠腹腔脂肪组织学观察
颈椎脱臼法牺牲小鼠,打开腹腔取出腹腔脂肪,将脂肪组织固定在中性福尔马林中24 h,脱水,石蜡包埋及切片,HE染色后显微镜下观察(Laica显微镜,德国)组织学变化。
1.6 统计分析
实验数据以Mean±S.E.M.表示,用Student's t-tests或one-way ANOVA分析处理数据,P<0.05为有显著性差异。
2 结果
2.1 转基因、野生和基因敲除小鼠腹腔脂肪内脂素的表达
分别提取2月龄内脂素转基因小鼠(TG),野生鼠(WT)和内脂素基因敲除杂合子(KO(+/-))雌性小鼠脂肪组织总蛋白,Western blot分析内脂素在腹腔脂肪组织中的表达(图1a)。利用Image J软件,GADPH作为内参,密度扫描定量分析结果显示,内脂素转基因小鼠脂肪组织中内脂素的表达量比野生小鼠增加37%,基因敲除杂合子小鼠比野生小鼠降低了55%(图1b)。2月龄时,3种小鼠在体重、血清总胆固醇和高密度胆固醇含量上没有区别,而在空腹血糖、甘油三酯和低密度胆固醇含量上,内脂素基因敲除杂合子小鼠要高于野生鼠和转基因小鼠(表1)。经检测发现3种小鼠血清中内脂素的水平没有显著差异(未显示)。
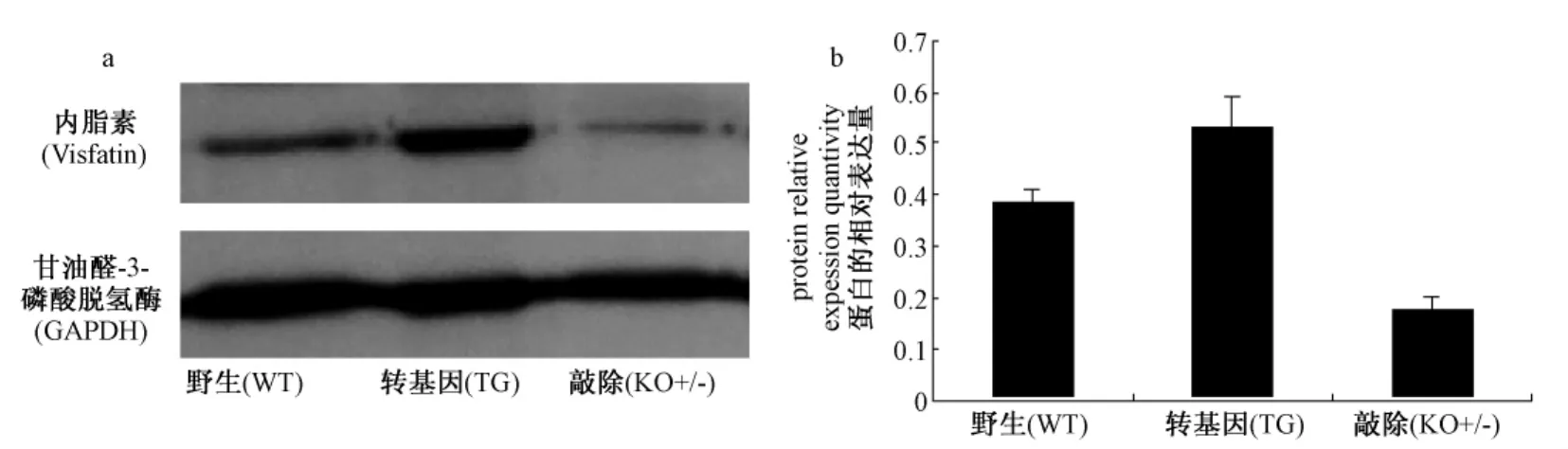
图1 内脂素在脂肪组织的表达注:分别提取2月龄内脂素转基因小鼠(TG),野生鼠(WT)和内脂素基因敲除杂合子雌性小鼠(KO-/+)脂肪组织总蛋白,a,Western blot分析内脂素在腹腔脂肪组织中的表达,b,GAPDH作为内对照,密度扫描定量Fig.1 The expression of Visfatin in the visceral fat tissueNote:The total lysates of visceral fat tissues were isolated from visfatin transgenic mice(TG),wild type mice(WT)and heterozygous visfatin+/-mice(KO+/-)at2 months of age.a,the expression of visfatin in the visceral fat tissue;b,the quantitative analysis of the expression of visfatin using GAPDH for normalization

表1 2月龄内脂素转基因、野生和敲除小鼠体重及基础血生化Tab.1 Body weight and blood biochemical parameters of visfatin TG,WT and KO+/-2-month-old mice
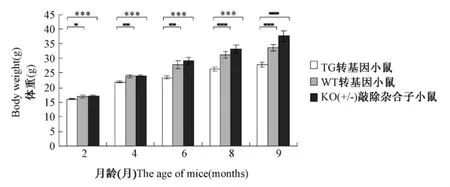
图2 小鼠的体重变化分析注:内脂素转基因(TG),野生(WT)和内脂素基因敲除杂合子(KO+/-)雌性小鼠饲以高脂饲料,自由采食,分别在2,4,6,8,9月龄测定其体重(n≥9)Fig.2 The change of body weight in miceNote:TG,WT and KO+/-female mice were given high fat diet,ad libitum feeding,the body weightwas determined at 2,4,6,8,9 month age(n≥9)
2.2 内脂素表达对小鼠体重的影响
内脂素转基因,野生和内脂素基因敲除杂合子雌性小鼠从2月龄开始,饲喂高脂饲料,分别在2,4,6,8,9月测定其体重(图2)。结果表明,2月龄时,内脂素基因敲除杂合子雌性小鼠略大于野生小鼠和转基因小鼠,随着高脂饲料的饲喂和年龄的增长,在测定终点9月龄时,转基因小鼠体重平均27.8±0.8 g,野生小鼠体重平均33.6±1.1 g,基因敲除杂合子小鼠体重平均37.6±1.9 g。
2.3 内脂素表达对小鼠脂肪积累的影响
9月龄时,采用7T/160 mm孔径的小动物磁共振成像系统(varian)分别对内脂素转基因,野生和内脂素基因敲除杂合子雌性小鼠进行冠状位和横断位扫描(图3b,3c),图中白色部分为高反射的脂肪组织,结果显示内脂素转基因小鼠的脂肪组织面积最小,其次是野生鼠,基因敲除杂合子雌性小鼠的面积最大。分别剥离皮下脂肪和腹腔脂肪组织,称重,结果显示,转基因小鼠的皮下和腹腔脂肪总重量比野生小鼠降低了40%,基因敲除杂合子小鼠的脂肪总重量比野生小鼠增加了37%。对比体重变化,内脂素转基因小鼠体重与野生小鼠比,平均减少5.8 g,脂肪重量平均减少3.2 g;基因敲除杂合子小鼠体重与野生小鼠比,平均增加了4.0 g,脂肪重量平均增加3.0 g,由此可见转基因,野生和基因敲除杂合子的体重差异主要是由于脂肪积累不同所导致的。结合Western blot显示的3种小鼠内脂素表达量的关系,发现内脂素的表达量越高,体重越轻,皮下和腹腔脂肪总重量也越小。由此说明小鼠体重及皮下和腹腔脂肪总重量与内脂素的表达呈负相关。
2.3 内脂素表达对小鼠脂肪组织形态的影响
腹腔脂肪H&E染色发现,内脂素转基因小鼠的脂肪细胞面积最小,其次是野生鼠,基因敲除杂合子雌性小鼠脂肪细胞的面积最大(图4)。利用ScanScope软件比较3种小鼠脂肪细胞大小,结果显示内脂素转基因小鼠脂肪细胞平均大小比野生小鼠减少47%,内脂素基因敲除杂合子小鼠的脂肪细胞平均比野生小鼠增加了67%,结合western blot显示的3种小鼠内脂素表达量的关系,说明腹腔脂肪细胞大小与内脂素表达呈负相关。
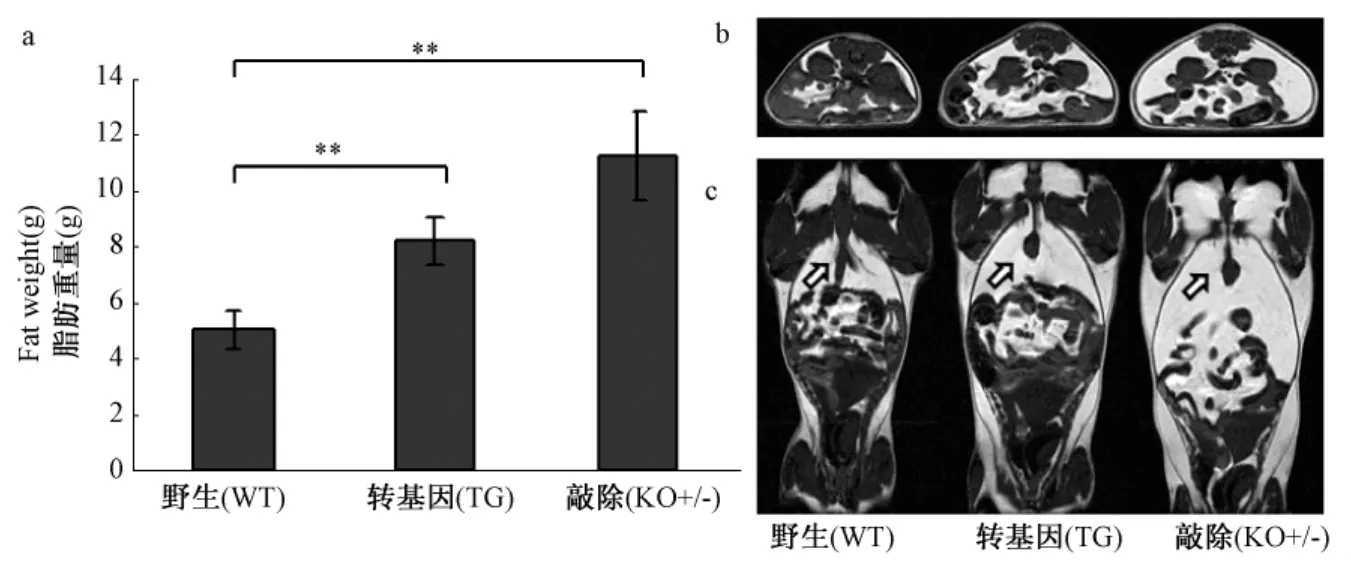
图3 小鼠脂肪组织定量分析注:内脂素转基因(TG),野生(WT)和内脂素基因敲除杂合子(KO+/-)雌性小鼠饲以高脂饲料,自由采食。a,3种小鼠皮下脂肪和腹腔脂肪组织的总重量比较(n≥9)。b,9月龄利用核磁成像对小鼠的横断面扫描图。c,9月龄利用核磁成像对小鼠的冠状面扫描图,其中箭头所示白色部分为高反射的脂肪组织Fig.3 The quantitative analysis in visceral fat tissue ofmiceNote:TG,WT and KO(+/-)femalemice were given high fat diets,ad libitum feeding,(a)The weight of visceral fat(n≥9);(b)Axial views of MRI,(c)Coronal views of MRI,the part ofwhite stands for adipose tissue(arrows)

图4 腹腔脂肪组织的组织学观察注:在9月龄采集内脂素转基因(TG),野生(WT)和内脂素基因敲除杂合子(KO+/-)雌性小鼠腹腔脂肪组织,进行常规H&E染色和光镜观察(100×)Fig.4 Histopathology observation of visceral adipose tissueNote:Hematoxylin-eosin(H&E)staining patterns of the female TG,WT and KO(+/-)visceral adipose tissue,opticalmicroscope were observed(100×)
3 讨论
近年来,关于内脂素与肥胖的关系,有很多研究报道,尤其是针对肥胖的女性[16-19],然而作用效果存在争议。在实验中同时选择了雌雄鼠为研究对象,但结果只显示雌鼠在脂肪积累上有显著差异(雄鼠结果未显示)。实验中利用内脂素表达量不同的3种小鼠:内脂素转基因小鼠、野生小鼠和内脂素基因敲除杂合子小鼠,从体重、腹腔和皮下脂肪总重量以及腹腔脂肪细胞的大小3个角度考察了内脂素与脂肪积累的关系,结果证实,内脂素表达量与体重、皮下和内脏脂肪总重量及脂肪细胞大小呈负相关。此结果与Krzyzanowska及Rongya Tao等[10-13]报道一致,Rongya Tao等[20,21]研究表明内脂素与脂肪积累关系是通过调节去乙酰化酶(sirtuin)的活性来完成的。内脂素也被称为尼克酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyltansferase,Nampt),是尼克酰胺腺嘌呤二核苷酸(NAD+)生物合成路径中重要的限速酶,NAD+水平的高低直接影响去乙酰化酶的活性,而该酶是调控脂代谢的关键酶。体内NAD+水平降低,去乙酰化酶活性降低,引起与脂合成相关的酶类表达水平降低,从而减少了脂肪积累[12]。从我们的实验结果可以看出,内脂素并非是引起肥胖的原因,高表达时可以抑制脂肪积累。
[1]Ahima RS,Flier JS.Adipose tissue as an endocrine organ[J].Trends Endocrinol Metab,2000,11(8):327-332.
[2]Rongvaux A,Shea RJ,Mulks MH,et al.Pre-B-cell colonyenhancing factor,whose expression is up-regulated in activated lymphocytes,is a nicotinamide phosphoribosyltransferase,a cytosolic enzyme involved in NAD biosynthesis[J].Eur J Immunol,2002,32(11):3225-3234.
[3]Song HK,Lee MH,Kim BK,et al.Visfatin:a new player in mesangial cell physiology and diabetic nephropathy[J].Am J Physiol Renal Physiol,2008,295(5):1485-1494.
[4]de Boer JF,Bahr MJ,Boker KH,et al.Plasma levels of PBEF/ Nampt/visfatin are decreased in patients with liver cirrhosis[J].Am J Physiol Gastrointest Liver Physiol,2009,296(2):196 -201.
[5]Tuva B,Sverre H,Pal A,et al.Visfatin/NAMPT:A multifaceted molecule with diverse roles in physiology and pathophysiology[J].Annu.Rev.Nutr,2012,32:229-243.
[6]Chang YH,Chang DM,Lin KC,et al.Visfatin in overweight/ obesity,type 2 diabetes mellitus,insulin resistance,metabolic syndrome and cardiovascular diseases:a meta-analysis and systemic review[J].Diabetes Metab Res Rev,2011,27(6):515-527.
[7]Dominik GH,Gregor H,Georg S,et al.The adipokine visfatin is markedly elevated in obese children[J].J Pediatr Gastroenterol Nutr,2006,43(4):548-549.
[8]Wang P,Bai C,Xu QY,et al.Visfatin is associated with lipid metabolic abnormalities in Lyon hypertensive rats.Clin Exp Pharmacol Physiol[J],2010,37(9):894-899.
[9]Shunsuke A,Kazushige D,Kazuyasu K,et al.Plasma visfatin concentration as a surrogate marker for visceral fat accumulation in obese children[J].Obesity,2008,16(2):384-388.
[10]Claudio P,Catia P,Massimiliano O,et al.Reduced plasma visfatin/Pre-Bcell colony-enhancing factor in obesity is not related to insulin resistance in humans[J].J Clin Endocrinol Metab,2006,91(8):3165-3170.
[11]Katarzyna K,Friedrich M,Walter K,et al.Increase in visfatin after weight loss induced by gastroplastic surgery[J].Obesity,2006,14(11):1886-1889.
[12]Tao R,Wei D,Gao H,et al.Hepatic FoxOs Regulate Lipid Metabolism via modulation of expression of the nicotinamide phosphoribosyltransferase gene[J].J.Biol.Chem.2011,286 (16):14681-14690.
[13]Wang P,van Greevenbroek MM,Bouwman FG,et al.The circulating PBEF/NAMPT/visfatin level is associated with a beneficial blood lipid profile[J].Pflugers Arch-Eur J Physiol,2007,454(6):971-976.
[14]全雄志,董伟,高凯,等.内脂素对转基因小鼠血糖和运动性的影响[J].中国比较医学杂志,2009,19(9):11-15.
[15]吕丹,陈炜,曹兴水,等.神经组织特异表达CTF1转基因小鼠的建立[J].中国比较医学杂志,2010,20(1):28-32.
[16]Ximena T,Teresa A,Isabel Q,et al.Increased levels and adipose tissue expression of visfatin in morbidly obese women.the relationship with proinflammatory cytokines[J].Clin Endocrinol,2012,77(5):691-698.
[17]Daniel ADL,Olatz I,Rosa C,et al.Visfatin levels in female,morbid,nondiabetic obese patients after biliopancreatic diversion surgery[J].Surg Obes Relat Dis,2011,7(2):195-198.
[18]Manja R,Tjalf Z,Hugo WH,et al.Ethnic-specific correlations of visfation with circulating markers of endothelial im flammation and function[J].Obesity,2009,17(12):2210-2215.
[19]Dong S,W i YS,Sung H,et al.Effects of12 weeks of combined exercise training on visfatin and metabolic syndrome factors in obese middle-aged women[J].Journal of Sports Science and Medicine,2011,10(1):222-226.
[20]Bhaskar P,Dong HK,Zhen X,et al.SIRT1 Deacetylates and inhibits SREBP-1C activity in regulation of hepatic lipid metabolism[J].JBiol Chem,2010,285(44):33959-33970.
[21]Matthew DH,Tadahiro S,Eric G,et al.SIRT3 regulates mitochondrial fatty-acid oxidation by reversible enzyme deacetylation[J].Nature,2010,464(7285):121-125.
