二氢生物喋呤还原酶参与调控HEK293T细胞自噬作用的初步研究
2012-02-03古艳婷赵婷婷张浩军韩文兵孙斯凡
古艳婷,赵婷婷,李 平,张浩军,朱 斌,韩文兵,董 晞,费 敏,孙斯凡
(1.北京协和医学院,北京 100021;2.卫生部中日友好医院临床医学研究所,北京 100029)
糖尿病肾病的发病机制复杂,至今仍未完全阐明。许多研究认为糖尿病肾病时存在着自噬活性的下调,自噬途径受到抑制可导致细胞内受损的细胞器或蛋白大量积聚,足细胞完整性受到破坏、肾小管上皮细胞损伤及肾肥大等病理进程,参与了DN的发生发展[1],而自噬激活对肾损伤有保护作用并可维持足细胞完整性。课题组在前期差异蛋白质组学中发现,二氢生物喋呤还原酶(dihydropteridine reductase,QDPR)在自发性II型糖尿病模型OLETF大鼠肾脏损害时的氨基酸发生突变,但该基因产物是否参与糖尿病肾病的发生发展还未有报道。本研究构建了野生型和突变型的QDPR重组质粒初步探讨了二氢生物喋呤还原酶对自噬作用的影响,以期为深入研究其在糖尿病肾病发病机制中的作用奠定基础。
1 材料和方法
1.1 材料
HEK 293T细胞、绿色荧光蛋白(GFP)为中日友好医院临床医学研究所药物药理室保存;真核表达载体pcDNA3.1/V5-His(美国Invitrogen公司);新型pUM-T快速克隆试剂盒(北京百泰克生物技术有限公司)、大肠杆菌DH5α感受态细胞(北京鼎国昌盛生物技术有限公司);高保真PCR扩增试剂盒(德国Roche公司),T4 DNA连接酶、限制性内切酶EcoR V、Pst I、Xba I(美国NewEngland Biolabs公司);限制性内切酶Xba I、逆转录试剂盒(加拿大Fermentas公司);凝胶回收纯化试剂盒、质粒中提试剂盒(德国QIAGEN公司);DNA Maker DM5000(北京康为世纪生物技术有限公司);鼠单抗V5抗体(美国Invitrogen公司);兔多抗LC3(美国Sigma公司),兔多抗Beclin1抗体(美国Sigma-Aldrich公司),山羊抗小鼠IgG抗体(美国Abcam公司);羊抗兔IgG抗体(美国Abcam公司);Western Lightening ECL(美国Perkin Elmer公司);胎牛血清(美国GIBCO公司);高糖DMEM培养基干粉(美国GICBO-BRL公司)。
1.2 野生型和突变型QDPR重组质粒的构建
1.2.1 引物设计与RT-PCR扩增 根据 G eneBank中大鼠QDPR mRNA序列设计引物,上游引物引入EcoR V酶切位点,下游引物引入 X ba I酶切位点,由北京擎科生物技术有限公司合成。引物序列如下:上游5'-AGATATCTGGCGGCTTCGGGCGAGGC-3';下游5'-ATCTAGAGAAATAGGCTGGAGTAAGCT-3',分别以正常LETO大鼠与OLETF糖尿病大鼠肾脏皮质cDNA为模板,采用高保真PCR试剂盒扩增正常QDPR以及突变QDPR cDNA片段,PCR反应体系(50μL)中上、下游引物各1μL,cDNA 2μL。反应条件为:94℃预变性2 m in;94℃变性30 s;54℃退火30 s;72℃延伸1 m in;共循环32次后72℃延伸10 m in。对PCR产物用1.2%琼脂糖凝胶电泳进行分离,之后进行回收纯化,-20℃保存。
1.2.2 pUM-T克隆 PCR产物回收纯化后克隆至pUM-T载体,转化到 D H5α感受态细胞,挑选阳性单克隆进行酶切鉴定及测序。
1.2.3 重组质粒的构建 用EcoR V、Xba I双酶切QDPR/pUM-T获得QDPR目的片段;用EcoR V、Xba I双酶切 p cDNA3.1/V5-His作为载体。用 T 4DNA连接酶连接目的片段与载体,构建野生型 r QDPR/ pcDNA3.1/V5-His重组质粒(rQDPRwt)和突变型rQDPR/pcDNA3.1/V5-His重组质粒(rQDPRmut)。
1.3 HEK293T细胞转染及分组
HEK 293T细胞常规培养于含10%胎牛血清的DMEM培养基中,于转染前24 h传代,以2x106/孔的细胞密度接种于 1 0 cm培养皿中,在37℃、5%CO2条件下培养24 h,细胞贴壁后利用磷酸钙共沉淀法转染,共转染3次。实验分组:野生型重组质粒组(rQDPRw t组),突变型重组质粒组(rQDPRmut组),pcDNA3.1/V5-His载 体组(control vector组)。绿色荧光蛋白(GFP)作为转染效率的参照物,转染72 h后倒置荧光显微镜下观察转染效率。
1.4 RT-PCR检测LC3,Beclin1转录水平表达
转染72 h后收集细胞,Trizol法提取细胞总RNA。取2μg RNA进行反转录,按Fermentas cDNA反转录试盒的步骤进行。PCR采用立陶宛MBl公司试剂盒PCR反应扩增,以CyclophilinB作为内参照。各引物序列见表1。PCR反应体系(12.5μL)中上、下游引物各0.5μL,cDNA 2μL。反应条件为:94℃预变性2 min;94℃变性30 s;退火30 s(LC3为52℃,Beclin1为56℃);72℃延伸45 s;共循环35次后72℃延伸10 min。PCR产物在2%琼脂糖凝胶上电泳,用凝胶成像系统观察条带,以目的条带吸光度值与CyclophilinB吸光度值比值作为目的产物的半定量值,Image J软件进行分析。
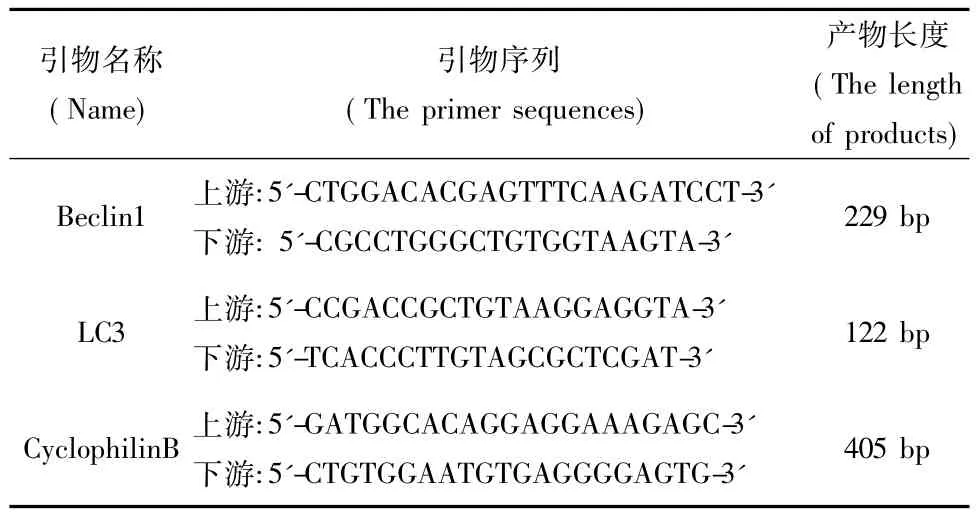
表1 PCR引物序列及产物长度Tab.1 The primer sequences and the length of products
1.5 WesternBlot检测测LC3I,II,Beclin1蛋白水平表达
转染72 h后收集细胞,吸弃培养液,PBS轻洗,加入预冷的细胞裂解液,冰浴10 min后移至离心管,超声离心,分光光度计进行蛋白定量。分别取60μg蛋白样品进行SDS-PAGE电泳并电转移至PVDF膜,5 g/L脱脂奶粉封闭2 h,TBST洗膜,用鼠单抗V5抗体(1∶5000),LC3抗体(1:2000),Beclin1抗体(1∶2000)及抗β-actin抗体(1∶2000),4℃过夜。山羊抗鼠IgG(1∶10000),山羊抗兔IgG (1∶3000)孵育1 h,TBST洗膜3次后ECL化学发光显色后显影。ImageJ软件进行分析吸光度(A)值,并计算LC3I,II和Beclin1的A值与β-actin A值的比值,分析各组LC3 I,II和Beclin1蛋白的相对表达水平。
1.6 统计学方法 数据资料用(±SD)
表示,采用SPSS 16.0统计软件对数据进行处理。组间差异采用One-way ANOVA,P<0.05有统计学意义。
2 结果
2.1 重组质粒鉴定结果
重组质粒构建后经酶切鉴定,结果显示酶切条带与预期一致,野生型重组质粒测序结果与GeneBank BLAST比较后证实为QDPR cDNA序列,突变型重组质粒测序结果也显示突变位置正确,说明野生型和突变型重组质粒构建成功(数据未显示)。
2.2 WesternBlot检测融合蛋白水平表达
转染72 h后收集细胞蛋白,用鼠单抗V5抗体检测到rQDPRwt组和rQDPRmut组融合蛋白的表达,对照组未见目的蛋白表达,见图1。结果表明野生型和突变型重组质粒能够在HEK 293T细胞中正确表达。
2.3 QDPR高表达以及QDPR突变高表达后对LC3,Beclin1mRNA水平的影响

图1 Western blot检测转染后融合蛋白表达Fig.1 The detection of fusion protein after transfection
野生型QDPR重组质粒和突变型QDPR重组质粒转染细胞72 h后,RT-PCR检测结果显示,与对照组相比,rQDPRwt组LC3 mRNA表达水平显著上调(P<0.05),Beclin1表达水平无统计学意义,rQDPRmut组与对照组相比LC3和Beclin1表达水平差异均无统计学意义(P>0.05)。(图2,3)。
2.4 QDPR高表达以及QDPR突变高表达后对LC3,Beclin1蛋白水平的影响
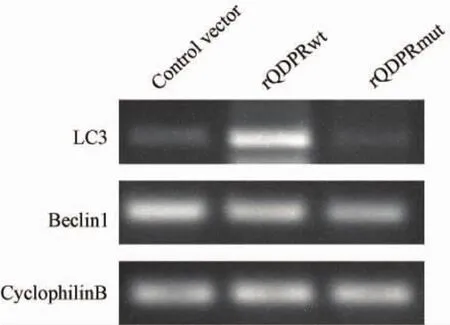
图2 QDPR对LC3和Beclin1 mRNA表达的影响Fig.2 The effect of QDPR on the mRNAlevel of LC3 and Beclin1

图3 QDPR对LC3和Beclin1 mRNA表达影响的半定量分析(*P<0.05 vs.control)Fig.3 The semiquantitative analysis of QDPR on the mRNA level of LC3 and Beclin1(*P<0.05 vs.control)
野生型QDPR重组质粒和突变型QDPR重组质粒转染细胞72 h后,Western blot检测结果显示,与对照组相比,rQDPRwt组LC3和Beclin1蛋白表达量显著上调(P<0.05),rQDPRmut组LC3和Beclin1表达差异无统计学意义(P>0.05)。(图4,5)。
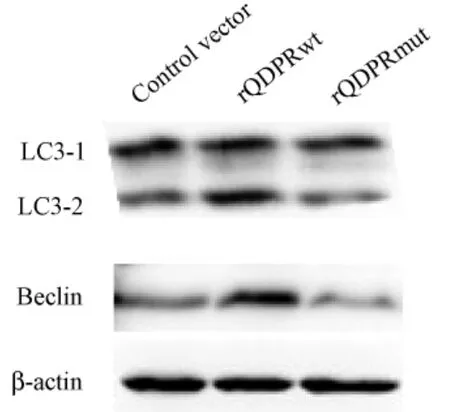
图4 QDPR对LC3和Beclin1蛋白表达的影响Fig.4 The effect of QDPR on proteinlevel of LC3 and Beclin1
3 讨论
二氢生物喋呤还原酶蛋白以二聚体形式在动物体内广泛分布[2],该酶在四氢生物喋呤(tetrahydrobiopterin,BH4)再生过程中起到重要作用,其主要功能是催化醌型二氢生物喋呤(quinonoid dihydrobiopterin,qBH2)还原成BH4,对维持体内BH4含量稳定有着重要意义[3]。BH4生理功能广泛,而这些生理功能和DN的发生关系密切。BH4是3种一氧化氮合酶(nitric oxide syhthase,NOS)激活所必需的辅助因子,而NOS是体内NO产量的主要来源[4]。有研究表明NO和自噬有密切关系[5]。课题组在前期差异蛋白质组学研究中发现,与正常LETO大鼠相比,自发性II型糖尿病模型OLETF大鼠QDPR基因发生突变,但该基因是否参与糖尿病及其并发症的发生发展有待进一步研究。

图5 QDPR对LC3和Beclin1蛋白表达影响的半定量分析(*P<0.05 vs.control,**P<0.01 vs.control)Fig.5 The semiquantitative analysis of QDPR on proteinlevel of LC3 and Beclin1(*P<0.05 vs.control,**P<0.01 vs.control)
自噬是细胞通过溶酶体对自身结构的吞噬降解过程,主要是清除、降解细胞内受损伤的细胞结构、不需要的生物大分子以及衰老的细胞器等,同时也为细胞器的构建提供原料[6]。然而,过度的自噬也会引起细胞的损伤或死亡。因此,自噬对细胞的作用具有两面性[7]。近年来有研究显示在STZ诱导的1型DN大鼠肾组织自噬标志分子LC3-2明显降低,糖尿病肾病存在着自噬活性的下调,而自噬激活在肾损伤中可能发挥着细胞保护作用[8]。自噬作用可通过Western blotting检测自噬蛋白LC3和的Beclin-1表达量等方法来反映。LC3前体(proLC3)在蛋白水解酶的作用下剪切C末端形成LC3I,最后经泛素样加工修饰过程成为与磷脂酰乙醇胺(PE)结合的LC3II,能靶向定位于自噬体膜,参与自噬的形成[9]。目前认为LC3II是自噬体的标志分子,是代表自噬作用的主要指标。Beclin-l基因是哺乳动物最早发现的一个自噬基因,其表达强度与自噬活性密切相关[10]。本研究通过构建QDPR野生型和突变型重组质粒,观察了QDPR对HEK293T细胞自噬作用的影响,结果显示野生型QDPR重组质粒组LC3II水平和Beclin-l水平显著高于对照组和突变组,提示QDPR可能诱导自噬活性或者使发生自噬的潜能增加,当其93位氨基酸突变后对自噬的这一调控作用下降。由此我们推测QDPR可能和糖尿病肾病的发生发展有关,并且课题组发现的QDPR突变位点可能是其调控自噬作用的关键位点。但是它是如何调控自噬并参与疾病的具体分子机制还不清楚,有可能是通过影响NO的生成和氧化应激的一些变化或某些信号转导机制来完成,但在疾病中究竟发挥了何种作用,目前仍在探索,也是我们下一步研究的方向。
[1]Barbosa JA,Zhou H,Hultenschmidt D,et al.Inhibition of cellular autophagy in proximal tubular cells of the kidney in streptozotocin-diabetic and uninephrectomized rats[J].Virchows Arch B Cell Pathol Incl Mol Pathol,1992,61(6):359-366.
[2]Thony B,Auerbach G,and Blau N.Tetrahydrobiopterin biosynthesis,regeneration and functions[J].Biochem J,2000, 347(Pt1):1-16.
[3]Rakovich T,Boland C,Bernstein I,et al.Queuosine deficiency in eukaryotes compromises tyrosine production through increased tetrahydrobiopterin oxidation[J].J Biol Chem.,2011 286 (14):doi:10.1074/jbc.M111.219576.
[4]Katusic ZS,Duscio LV,and Nath KA.Vascular protection by tetrahydrobiopterin:progress and therapeutic prospects[J].Trends Pharmacol Sci,2009,30(1):48-54.
[5]Sovan S,Viktor IK,Maurizio R,et al.Complex Inhibitory Effects of Nitric Oxide on Autophagy.Molecular Cell,2011,43:19-32.
[6]Klionsky DJ,Abeliovich H,Agostinis P,et al.Guidelines for the use and int erpret at ion of assays formonitoring aut ophagy in higher eukaryotes[J].Autophagy,2008,4(2):151-175.
[7]Mathew R,Kongara S,Beaudoin B,et al.Autophage suppresses tumor progression by limiting chromosomal instablity[J].Genes Dev,2007,21(11):1367-1381.
[8]Wu WH,Zhang MP,Zhang F,et al.The role of programmed cell death in streptozotocin-induced early diabetic nephropathy[J].JEndocrinol Invest,2011,34(9):e296-301.
[9]Mizushima N.Methods for monitoring autophagy[J].Int.J Biochem CeIIBiol,2004,36(12):2491-2502.
[10]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammaIian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720 -5728.
